Celle fotovoltaiche (galvaniche)
Per illustrare i principi di base di una cella galvanica, consideriamo la reazione dello zinco metallico con lo ione cuprico (Cu2+) per dare rame metallico e ione Zn2+. L’equazione chimica bilanciata è la seguente:
Possiamo far avvenire questa reazione inserendo una barra di zinco in una soluzione acquosa di solfato di rame(II). Mentre la reazione procede, la barra di zinco si dissolve e si forma una massa di rame metallico. Questi cambiamenti avvengono spontaneamente, ma tutta l’energia rilasciata è sotto forma di calore piuttosto che in una forma che può essere usata per fare lavoro.
Questa stessa reazione può essere effettuata usando la cella galvanica illustrata nella figura \(\PageIndex{3a}). Per assemblare la cella, una striscia di rame viene inserita in un becher che contiene una soluzione 1 M di ioni Cu2+, e una striscia di zinco viene inserita in un altro becher che contiene una soluzione 1 M di ioni Zn2+. Le due strisce di metallo, che servono da elettrodi, sono collegate da un filo, e i compartimenti sono collegati da un ponte di sale, un tubo a forma di U inserito in entrambe le soluzioni che contiene un elettrolita liquido concentrato o gelificato. Gli ioni nel ponte salino sono selezionati in modo che non interferiscano con la reazione elettrochimica ossidandosi o riducendosi o formando un precipitato o un complesso; cationi e anioni comunemente usati sono Na+ o K+ e NO3- o SO42-, rispettivamente. (Gli ioni nel ponte salino non devono essere gli stessi di quelli della coppia redox in entrambi i comparti). Quando il circuito è chiuso, avviene una reazione spontanea: lo zinco metallico è ossidato a ioni Zn2+ all’elettrodo di zinco (l’anodo), e gli ioni Cu2+ sono ridotti a Cu metallico all’elettrodo di rame (il catodo). Mentre la reazione procede, la striscia di zinco si dissolve, e la concentrazione di ioni Zn2+ nella soluzione Zn2+ aumenta; contemporaneamente, la striscia di rame guadagna massa, e la concentrazione di ioni Cu2+ nella soluzione Cu2+ diminuisce (Figura \PageIndex{3b}). Così abbiamo realizzato la stessa reazione che abbiamo fatto usando un solo becher, ma questa volta le semi-reazioni ossidativa e riduttiva sono fisicamente separate l’una dall’altra. Gli elettroni che vengono rilasciati all’anodo scorrono attraverso il filo, producendo una corrente elettrica. Le celle galvaniche quindi trasformano l’energia chimica in energia elettrica che può essere usata per fare lavoro.
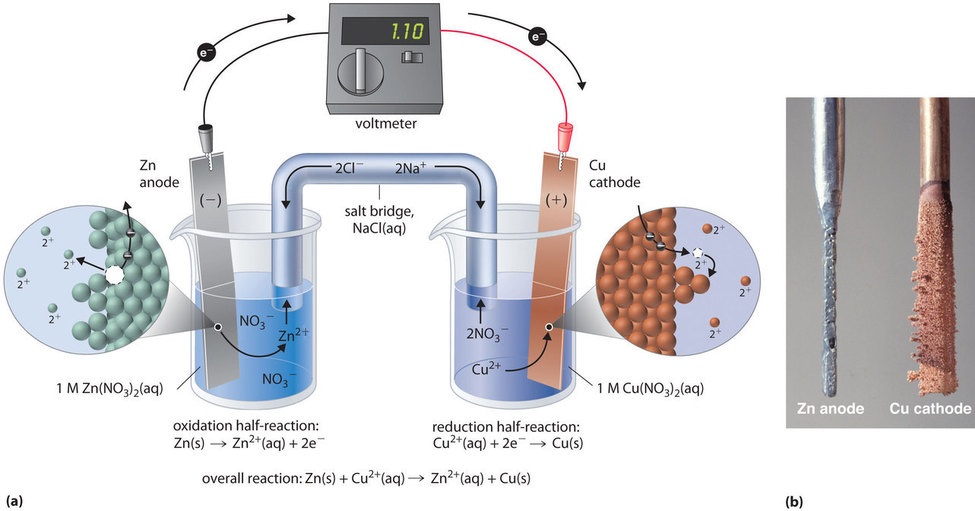
L’elettrolita nel ponte salino serve a due scopi: completa il circuito trasportando la carica elettrica e mantiene la neutralità elettrica in entrambe le soluzioni permettendo agli ioni di migrare tra esse. L’identità del sale in un ponte salino non è importante, finché gli ioni componenti non reagiscono o subiscono una reazione redox nelle condizioni operative della cella. Senza tale collegamento, la carica positiva totale nella soluzione Zn2+ aumenterebbe man mano che il metallo zinco si dissolve, e la carica positiva totale nella soluzione Cu2+ diminuirebbe. Il ponte salino permette alle cariche di essere neutralizzate da un flusso di anioni nella soluzione Zn2+ e un flusso di cationi nella soluzione Cu2+. In assenza di un ponte salino o di qualche altro collegamento simile, la reazione cesserebbe rapidamente perché la neutralità elettrica non potrebbe essere mantenuta.
Un voltmetro può essere usato per misurare la differenza di potenziale elettrico tra i due scomparti. Aprendo l’interruttore che collega i fili all’anodo e al catodo si impedisce alla corrente di scorrere, quindi non avviene alcuna reazione chimica. Con l’interruttore chiuso, tuttavia, il circuito esterno è chiuso, e una corrente elettrica può fluire dall’anodo al catodo. Il potenziale (\(E_cella})) della cella, misurato in volt, è la differenza di potenziale elettrico tra le due semireazioni ed è correlato all’energia necessaria per spostare una particella carica in un campo elettrico. Nella cella che abbiamo descritto, il voltmetro indica un potenziale di 1,10 V (Figura \PageIndex{3a}). Poiché gli elettroni della mezza reazione di ossidazione sono rilasciati all’anodo, l’anodo in una cella galvanica è carico negativamente. Il catodo, che attrae gli elettroni, è caricato positivamente.
Non tutti gli elettrodi subiscono una trasformazione chimica durante una reazione redox. L’elettrodo può essere fatto di un metallo inerte e altamente conduttivo come il platino per evitare che reagisca durante un processo redox, dove non appare nella reazione elettrochimica complessiva. Questo fenomeno è illustrato nell’esempio \(\PageIndex{1}).
Una cella galvanica (voltaica) converte l’energia rilasciata da una reazione chimica spontanea in energia elettrica. Una cella elettrolitica consuma energia elettrica da una fonte esterna per guidare una reazione chimica non spontanea.
Esempio \(\PageIndex{1})
Un chimico ha costruito una cella galvanica composta da due becher. Un becher contiene una striscia di stagno immersa in acido solforico acquoso, e l’altro contiene un elettrodo di platino immerso in acido nitrico acquoso. Le due soluzioni sono collegate da un ponte di sale e gli elettrodi sono collegati da un filo. La corrente comincia a scorrere e sull’elettrodo di platino appaiono delle bolle di un gas. La reazione redox spontanea che si verifica è descritta dalla seguente equazione chimica bilanciata:
Per questa cella galvanica,
- scrivi la mezza reazione che si verifica a ciascun elettrodo.
- indica quale elettrodo è il catodo e quale l’anodo.
- indicare quale elettrodo è l’elettrodo positivo e quale l’elettrodo negativo.
Data: cella galvanica e reazione redox
Chiesto: mezze reazioni, identità di anodo e catodo, e assegnazione dell’elettrodo come positivo o negativo
Strategia:
- Identificare la mezza reazione di ossidazione e la mezza reazione di riduzione. Poi identifica l’anodo e il catodo dalla semi-reazione che si verifica in ogni elettrodo.
- Dalla direzione del flusso di elettroni, assegna ogni elettrodo come positivo o negativo.
Soluzione
A Nella semi-reazione di riduzione, il nitrato viene ridotto a ossido nitrico. (L’ossido nitrico reagirebbe poi con l’ossigeno nell’aria per formare NO2, con il suo caratteristico colore rosso-marrone). Nella semi-reazione di ossidazione, lo stagno metallico viene ossidato. Le semi-reazioni corrispondenti alle reazioni reali che avvengono nel sistema sono le seguenti:
riduzione: \
ossidazione: \
Così il nitrato si riduce a NO, mentre l’elettrodo di stagno si ossida a Sn2+.
Perché la reazione di riduzione avviene all’elettrodo Pt, esso è il catodo. Al contrario, la reazione di ossidazione avviene all’elettrodo di stagno, quindi è l’anodo.
B Gli elettroni fluiscono dall’elettrodo di stagno attraverso il filo all’elettrodo di platino, dove si trasferiscono al nitrato. Il circuito elettrico è completato dal ponte di sale, che permette la diffusione dei cationi verso il catodo e degli anioni verso l’anodo. Poiché gli elettroni fluiscono dall’elettrodo di stagno, esso deve essere elettricamente negativo. Al contrario, gli elettroni fluiscono verso l’elettrodo di Pt, quindi quell’elettrodo deve essere elettricamente positivo.
Esercitazione \(\PageIndex{1})
Considera una semplice cella galvanica composta da due becher collegati da un ponte di sale. Un becher contiene una soluzione di \ce{MnO_4^{-}} in acido solforico diluito e ha un elettrodo Pt. L’altro becher contiene una soluzione di \(\ce{Sn^{2+}} in acido solforico diluito, sempre con un elettrodo di Pt. Quando i due elettrodi sono collegati da un filo, la corrente scorre e si verifica una reazione spontanea che è descritta dalla seguente equazione chimica bilanciata:
Per questa cella galvanica,
- scrivi la mezza reazione che si verifica a ciascun elettrodo.
- indica quale elettrodo è il catodo e quale l’anodo.
- indica quale elettrodo è positivo e quale è negativo.
Rispondi a
\ce{Sn^{2+}(aq)} &→ \ce{Sn^{4+}(aq) + 2e^{-}
Risposta b
L’elettrodo Pt nella soluzione di permanganato è il catodo; quello nella soluzione di stagno è l’anodo.
Risposta c
Il catodo (elettrodo nel becher che contiene la soluzione di permanganato) è positivo, e l’anodo (elettrodo nel becher che contiene la soluzione di stagno) è negativo.