Al meeting dell’American Academy of Ophthalmology del 2013 ho partecipato a un dibattito sui pro e i contro dell’uso dei generici rispetto ai farmaci di marca. Mi è stato chiesto di argomentare a favore dei farmaci di marca, ma come nella maggior parte dei dibattiti, è una semplificazione eccessiva prendere ciecamente una parte o l’altra. La realtà è più complicata. I generici hanno costi a loro favore, ma a volte non forniscono le stesse specifiche di trattamento o risultati dei farmaci di marca, nonostante gli sforzi della Food and Drug Administration per garantire che lo facciano.
Qui vorrei parlare di alcuni dei modi in cui i generici possono differire dai farmaci di marca che sostituiscono, e di ciò che i clinici devono tenere d’occhio.
La questione della bioequivalenza
Gli ostacoli necessari per immettere sul mercato un nuovo farmaco “innovatore” sono sostanzialmente diversi da quelli per un farmaco generico. Naturalmente, questo è parte della ragione per cui un farmaco di marca costa di più. Dove il farmaco innovatore iniziale deve dimostrare la sicurezza e l’efficacia attraverso studi clinici, un generico deve solo dimostrare la bioequivalenza.
Anche se la bioequivalenza suona come se coinvolgesse la conduzione di studi biologici, la FDA la definisce come il significato che dovete dimostrare che gli ingredienti della vostra versione generica sono una copia esatta degli ingredienti del farmaco originale, compresi sia i principi attivi che gli eccipienti. (Se gli ingredienti attivi e gli eccipienti non sono identici, il farmaco non è considerato un generico; deve passare attraverso la regolare approvazione della FDA proprio come qualsiasi nuovo farmaco). La premessa è che questo farà sì che il generico abbia la stessa sicurezza ed efficacia del farmaco di marca.
Purtroppo, l’idea che i generici siano uguali ai farmaci di marca perché gli ingredienti sono gli stessi non è necessariamente vera. Molti fattori che influenzano l’efficacia di un farmaco topico sono indipendenti dagli ingredienti all’interno della bottiglia. Per esempio:
– Il materiale del flacone conta. Gli ingredienti di molti farmaci di marca sono abbinati al materiale del flacone utilizzato. Questo è stato certamente il caso del latanoprost, dove la compatibilità con il materiale del flacone è stata una grande parte del processo di ricerca e sviluppo per portare Xalatan sul mercato. Questo non è qualcosa che viene indagato direttamente dalla FDA.
– La forma e la dimensione del flacone influenzano l’uso. Gli studi sui farmaci innovativi non solo testano il farmaco ma anche il flacone in cui sarà consegnato ai pazienti, quindi l’impatto della forma e della dimensione del flacone è stato preso in considerazione. Tuttavia, i produttori di farmaci generici non sono tenuti a copiare la forma e la dimensione del flacone, e questo può fare la differenza nella facilità con cui i pazienti possono usare il farmaco.
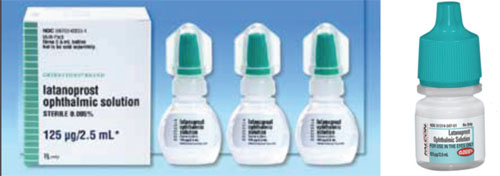
Un problema che può causare confusione quando si passa da un farmaco di marca a un generico, o da un generico a un altro, è la differenza di forma e colore del tappo.
Per esempio, Xalatan si presenta in una bottiglia piatta e piccola che richiede un certo sforzo e finezza per spremere al fine di instillare una goccia. Al contrario, alcune delle bottiglie generiche di latanoprost sono rotonde e più rigide, rendendo la bottiglia più difficile da spremere per il paziente. (Molti dei nostri pazienti sono anziani e hanno limitazioni fisiche. Se sono abituati a spremere un particolare flacone che è piatto e leggermente meno rigido, e poi passano a un flacone che è rotondo e più rigido, il processo di applicazione – e la loro aderenza al farmaco – potrebbe essere diverso da quando usavano il flacone precedente. Inoltre, poiché la forma e la dimensione del flacone sono scelte da ogni produttore generico, i pazienti possono a volte ricevere il farmaco in un flacone piatto e altre volte in un flacone rotondo. Questo ha creato molta confusione con i nostri pazienti.
– Il colore del tappo non sempre corrisponde. I colori dei tappi dei flaconi di farmaci oftalmici sono destinati ad essere coordinati in base alla categoria del farmaco. La FDA cerca di garantire che il colore sia corretto, ma ci sono stati casi in cui un tappo di colore diverso è sfuggito. Come risultato, a volte il colore del tappo del flacone del farmaco generico (così come la forma e la dimensione) è diverso da quello del farmaco di marca (vedi esempio sopra). Questo crea molta confusione quando i pazienti cercano di ricordare quale delle varie gocce devono prendere in quale momento.
Anche se un paziente non ha mai usato il farmaco di marca con il colore corretto del cappuccio, un colore alterato è ancora un problema; il nuovo colore del cappuccio potrebbe effettivamente essere lo stesso colore di un altro farmaco che il paziente sta prendendo. Per esempio, i flaconi degli analoghi delle prostaglandine dovrebbero avere tappi color teal. Se il vostro paziente sta usando una versione generica il cui flacone ha un tappo bianco, potrebbe confonderlo con altre classi di farmaci che si suppone abbiano un tappo bianco.
Se notate un esempio di colore errato del tappo, la FDA ha detto che vorrebbe saperlo in modo che possano essere presi provvedimenti per correggere la discrepanza.
– La dimensione della goccia può essere diversa. I flaconi di gocce topiche sul mercato in questo momento forniscono una dose da 30 a 50 µl per goccia. Sfortunatamente, ci può essere molta variabilità tra le formulazioni di marca e quelle generiche semplicemente perché la punta potrebbe avere un foro più grande o più piccolo. Ovviamente, questo può influenzare la quantità di farmaco che effettivamente arriva nell’occhio; potrebbe essere meno o più.
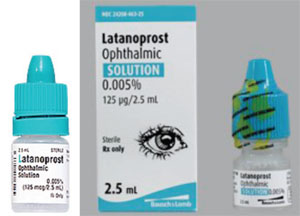
Un altro problema sono le differenze nella forma e nella rigidità delle bottiglie, che possono rendere l’applicazione delle gocce più difficile per un paziente anziano. Per esempio, lo xalatan è disponibile in una bottiglia piatta; molti generici del farmaco sono disponibili in bottiglie rotonde che sono più difficili da spremere.
Ancora più interessante, c’era un timololo generico che è arrivato sul mercato che non aveva affatto un foro nella punta; il paziente doveva forare la punta per far uscire il farmaco, simile a un tubo di supercolla. Questo ha creato confusione con molti pazienti; alcuni non si sono resi conto che dovevano fare questo, e hanno cercato di usare le gocce comunque. Pensavano di mettere una goccia, ma non avevano mai aperto la bottiglia e quindi non usciva nulla. Altri pensavano che la bottiglia fosse difettosa o vuota. Inoltre, un foro fatto da sé potrebbe finire per essere di qualsiasi dimensione, influenzando la dose, e il processo di fare il foro potrebbe facilmente compromettere la sterilità del contenuto.
Tutte queste considerazioni – materiale della bottiglia, forma e dimensione, colore del tappo e diametro dell’apertura della goccia – sono molto importanti sia per il medico che per il paziente. Sfortunatamente, queste considerazioni possono essere trascurate, perché l’attenzione è sul tentativo di provare la bioequivalenza.
– Il farmaco generico di un paziente può avere un aspetto diverso da un mese all’altro. Questo è un altro sfortunato effetto collaterale dei farmaci generici. Succede perché ci possono essere più produttori di un dato generico, ognuno con una bottiglia diversa. Per esempio, ci sono da sei a otto diversi produttori di latanoprost generico nel mercato statunitense in questo momento. Quello che una data farmacia vende può cambiare, perché una catena come CVS, Walgreens o Walmart di solito va con qualsiasi produttore sta dando al gruppo di farmacie il miglior affare in un dato momento. Di conseguenza, una farmacia potrebbe cambiare il generico che offre quando arriva un’offerta più bassa da un altro produttore di generici. Così, anche se il paziente va nella stessa farmacia, può finire con diverse versioni generiche di un farmaco in momenti diversi. Questo può confondere se le bottiglie hanno un aspetto e/o un comportamento diverso. (Ci potrebbe anche essere una differenza nella tolleranza e nel controllo della IOP tra i due.)
Il foglietto illustrativo
Ironicamente, anche se un farmaco generico risulta avere un problema, le regole attuali impediscono ai produttori di avvisare i medici o i pazienti. C’è una regola che richiede ai produttori di farmaci generici di includere una copia esatta del foglietto illustrativo che è incluso con il farmaco innovatore. Mentre questa regola era intesa a riflettere l’idea che i farmaci sono bioequivalenti, l’effetto collaterale non voluto è stato quello di evitare di mettere gli stessi requisiti di diligenza e l’onere di garantire la sicurezza ai produttori di farmaci generici che richiediamo ai produttori di marca.
Di conseguenza, se il produttore generico introduce un farmaco sul mercato e nota alcuni effetti collaterali o eventi avversi che si verificano con il prodotto generico, non gli è permesso di cambiare il foglietto illustrativo per avvisare i medici e i pazienti che potrebbe esserci un problema. Inoltre, questa regola può effettivamente ridurre la motivazione dei produttori di generici a condurre un adeguato monitoraggio dei loro prodotti; dopo tutto, non c’è la minaccia di una causa se si verifica un problema.
Fortunatamente, questo problema è venuto all’attenzione della FDA. Nel novembre 2013, la FDA ha proposto una regola che permetterebbe ai produttori di farmaci generici di aggiornare le loro etichette se ricevono informazioni su potenziali problemi di sicurezza. Un altro problema con i generici è che molti di loro sono prodotti al di fuori degli Stati Uniti, dove il controllo della qualità è stato a volte una vera preoccupazione. I problemi vanno da impurità misteriose trovate nei farmaci, a una corrispondenza imperfetta degli ingredienti, a vere e proprie formulazioni fraudolente che non hanno alcuno scopo benefico (che in alcuni casi possono causare gravi danni ai pazienti).
La realtà è che i generici non sono necessariamente uguali ai farmaci di marca – anche se hanno soddisfatto il requisito di bioequivalenza della FDA. Ciò significa che quando si usano farmaci generici, l’onere di garantire la sicurezza e l’efficacia è su di noi e sui nostri pazienti.
Secondo il New York Times, l’industria farmaceutica indiana fornisce attualmente il 40% dei farmaci da banco e generici da prescrizione consumati negli Stati Uniti. Molte delle sue fabbriche sono di classe mondiale e “virtualmente indistinguibili” dagli impianti di produzione degli Stati Uniti (secondo il Times), producendo farmaci di alta qualità e affidabili. Ma allo stesso tempo, l’Organizzazione Mondiale della Sanità ha stimato che un farmaco su cinque prodotto in India è falso. (Problemi simili sono stati segnalati con farmaci prodotti in altri paesi, compresa la Cina.)
Il nostro gruppo ha fatto uno studio un paio di anni fa confrontando il latanoprost prodotto in India con lo Xalatan. Abbiamo scoperto che la stabilità dei principi attivi non era la stessa nel tempo o quando sono sottoposti a calore. Inoltre, abbiamo trovato contaminanti in tutte le bottiglie importate, tra cui filamenti microscopici simili a spago, e ciò che abbiamo soprannominato “UFO”.”
Il punto è che la supervisione delle pratiche di produzione che avvengono all’estero in aziende non basate negli Stati Uniti, soprattutto le aziende che non hanno farmaci di marca sul mercato, non è semplicemente la stessa.
Alcuni medici possono pensare che tali farmaci importati siano un problema solo quando i pazienti acquistano farmaci fuori dagli Stati Uniti via Internet per risparmiare, ma la realtà è che queste importazioni sono sempre più disponibili qui. Le formulazioni indiane di timololo e travoprost sono attualmente disponibili attraverso i distributori con sede negli Stati Uniti, e altri farmaci come i FANS saranno presto disponibili. Ovviamente, molte aziende fuori dagli Stati Uniti stanno producendo generici di alta qualità; la preoccupazione è che alcune di loro non lo stiano facendo. Questo mette l’onere su medici e pazienti di assicurarsi che un dato generico sia sicuro ed efficace. (Almeno i farmaci disponibili negli Stati Uniti sono passati attraverso il processo di bioequivalenza della FDA; i farmaci che alcuni pazienti acquistano fuori dal paese via Internet potrebbero non averlo fatto, rendendoli ancora più sospetti).
Strategie cliniche
A causa di tutte le variabili che abbiamo discusso, i medici dovrebbero stare attenti a ciò che succede con i pazienti quando passano da un farmaco di marca a un generico, o passano da un generico a un altro. Dobbiamo essere vigili per essere sicuri che il controllo della pressione intraoculare non stia vacillando e che i pazienti non presentino nuovi segni e sintomi di intolleranza al farmaco.
Ecco alcune cose che potete fare per proteggere i vostri pazienti (e il vostro studio):
– Chiedete ai pazienti di portare le gocce. Chiedo ai miei pazienti di farlo indipendentemente dai farmaci che stanno usando, e molti di loro lo fanno. Questo mi dà l’opportunità di registrare quale produttore di generici stanno usando e fare del mio meglio per tenerlo sotto controllo, in modo che se si verifica un problema o qualcosa cambia, posso cercare un possibile collegamento.
– Fai tornare in clinica i pazienti che passano a un nuovo generico prima di quanto altrimenti li faresti tornare. Questo vi permetterà di assicurarvi che non ci siano conseguenze negative. State attenti ai cambiamenti nell’efficacia o ai nuovi segni o sintomi.
– Se vedete sorgere dei problemi quando un paziente passa a un generico, avvertite la FDA. Ricordate che questa situazione mette il peso sul medico per assicurarsi che il farmaco generico sia veramente sicuro ed efficace.
– Se un paziente non fa bene con un generico, fate lo sforzo di convincere l’assicuratore a coprire il farmaco di marca. Mi sono trovato di fronte a pazienti che tolleravano il farmaco di marca ma avevano difficoltà a tollerare un generico a causa di effetti collaterali come arrossamenti o irritazioni. In questi casi, scriviamo alla compagnia di assicurazione e facciamo tutto il possibile per far tornare il paziente alla formulazione di marca.
Per esempio, un farmaco di marca può avere un conservante specifico, mentre la formulazione generica ha un conservante alternativo a cui il paziente è sensibile. Travatan Z è un farmaco di marca prodotto da Alcon che contiene il conservante SofZia invece del cloruro di benzalconio; le versioni generiche contengono BAK perché la loro bioequivalenza era basata sulla vecchia versione di travoprost. Se una farmacia passa un paziente allergico al BAK al farmaco generico, diventa un problema.
Purtroppo, vedendo migliaia di pazienti all’anno nel nostro studio, è davvero difficile assicurarsi di vincere la battaglia per ogni paziente che finisce in questa situazione. Tuttavia, facciamo lo sforzo.
L’onere è su di noi
I generici sono qui per rimanere, e stanno diventando una parte importante del trattamento di tutte le malattie, non solo in oftalmologia. Sono tipicamente sicuri ed efficaci, e possono produrre risparmi sui costi sia per i pazienti che per il sistema sanitario in generale. Non fraintendetemi: sono un grande fan del taglio dei costi. Se possiamo trovare un modo sicuro per tagliare i costi mantenendo un’assistenza eccellente, sono d’accordo. È la seconda parte dell’equazione che dobbiamo tenere d’occhio.
Io stesso uso farmaci generici ogni giorno, e la stragrande maggioranza dei miei pazienti sono sui generici ora. Stanno quasi tutti molto bene, con un buon controllo della IOP e una buona tolleranza ai farmaci. Quindi non sto certo dicendo che dovremmo evitare di usare i generici. Tuttavia, la realtà è che i generici non sono necessariamente uguali ai farmaci di marca – anche se hanno soddisfatto il requisito di bioequivalenza della FDA. Ciò significa che quando si usano farmaci generici, l’onere di garantire la sicurezza e l’efficacia è su di noi e sui nostri pazienti. REVIEW
Il dottor Kahook è The Slater Family Endowed Chair in Ophthalmology e vicepresidente della ricerca clinica e traslazionale presso la University of Colorado School of Medicine di Denver. È consulente di Allergan e Alcon e riceve supporto per la ricerca.