Il diabete mellito è costoso, ma la maggior parte dei costi sono attribuiti alle complicazioni e alle cure ospedaliere.1 Secondo l’American Diabetes Association (ADA), nel 2012 il costo totale stimato per il diabete è stato di 245 miliardi di dollari.1 Si stima che il 43% sia dovuto ai costi ospedalieri e un altro 18% alle prescrizioni per gestire le complicazioni del diabete.1
La maggior parte di queste complicazioni possono essere evitate con un controllo mirato del glucosio. I dati epidemiologici dimostrano che per ogni punto percentuale di diminuzione dell’emoglobina A1c (HbA1c), si verifica una riduzione del rischio del 35% di complicazioni microvascolari.2 La buona notizia è che i tassi di complicazione nel diabete sono stati ridotti,3 ma questo è stato superato dal puro aumento del numero di persone con diabete che progrediscono con complicazioni.
Molte persone con diabete di tipo 2 possono avere una complicazione legata al diabete al momento della diagnosi. Sia nel diabete di tipo 1 che in quello di tipo 2, alcune delle complicazioni, come la retinopatia e la nefropatia, sono silenti. Questo richiede un approccio aggressivo e mirato, perché aspettare i sintomi sarà troppo tardi. Anche la neuropatia diabetica sarà asintomatica fino al 50% delle persone con anomalie misurabili.4
Questo articolo passerà in rassegna le raccomandazioni dell’ADA 2017 Standards of Care per le complicanze microvascolari e le relative dichiarazioni di posizione, ed evidenzierà lo screening preventivo e le perle cliniche per il medico di base che tratta i pazienti con diabete.
- Retinopatia diabetica
- Tabella 1. Stadi della retinopatia con descrizione
- Perle cliniche
- Malattia renale da diabete
- Tabella 2. Seleziona gli studi di riferimento che dimostrano il controllo glicemico con A1c inferiore al 7%
- Tabella 3. GFR stimato con stadio e descrizione
- Tabella 4. Categorie di albuminuria nella CKD
- Figura 1. Frequenza suggerita di valutazione (numero di volte all’anno) per categoria di eGFR e albuminuria
- Tabella 5. Bandiere rosse che suggeriscono una malattia glomerulare non diabetica
- Tabella 6. Aggiustamenti della dose e raccomandazioni per gli agenti che abbassano il glucosio nei pazienti con insufficienza renale
- Classe
- Medicazione
- Perle cliniche
- Neuropatia periferica diabetica
- Tabella 7. Altre cause di neuropatia67
- Tabella 8. Agenti farmacologici comunemente usati per la DPN4,69
- Perle cliniche
- Gastroparesi
- Perle cliniche
- Cheiroartropatia diabetica
- Conclusione
Retinopatia diabetica
La retinopatia diabetica è una comune complicanza microvascolare del diabete di tipo 1 e 2. Si stima che 3,7 milioni di persone nel mondo siano moderatamente o gravemente ipovedenti a causa della retinopatia diabetica, e più di 800.000 persone nel mondo sono cieche a causa della retinopatia diabetica.5 È la causa più frequente di nuova cecità negli adulti tra i 20 e i 74 anni di età.6 Sono state fatte forti correlazioni con il controllo glicemico, il controllo della pressione sanguigna e la durata della malattia. Attraverso uno screening precoce e regolare e il controllo di questi fattori di rischio, la retinopatia diabetica può essere individuata e trattata per prevenire la perdita della vista.
La durata del diabete è il maggior fattore di rischio per la progressione della retinopatia diabetica. Nel diabete di tipo 1, la retinopatia è rara nei primi 3-5 anni o prima della pubertà.7 Nei successivi 20 anni, quasi tutti i pazienti con diabete di tipo 1 svilupperanno la retinopatia diabetica.7 Nei pazienti con diabete di tipo 2, ben il 21% avrà un certo grado di retinopatia al momento della diagnosi.7 L’iperglicemia cronica, la nefropatia, l’ipertensione e la dislipidemia sono altri fattori che aumentano il rischio di o sono associati alla retinopatia diabetica.8 Fino al 50% dei pazienti con albuminuria (indipendentemente dal livello stimato della velocità di filtrazione glomerulare) avrà la retinopatia.9 La tabella 1 descrive i diversi stadi della retinopatia.
Tabella 1. Stadi della retinopatia con descrizione |
|
|
Stadio |
Descrizione |
|
Moderato Non-Retinopatia diabetica non proliferativa |
Microaneurismi presenti |
|
Retinopatia diabetica non proliferativa moderata |
Microaneurismi, emorragie retiniche a punti o a macchie, essudati duri, o macchie di cotone possono essere presenti |
|
Retinopatia diabetica non proliferativa grave |
Emorragie intraretiniche, perline venose, o anomalie microvascolari intraretiniche possono essere presenti |
|
Retinopatia diabetica proliferativa |
Neovascolarizzazione, emorragie vitreali o preretiniche presenti |
Patofisiologia. Anomalie lievi, non proliferative, caratterizzate da un aumento della permeabilità vascolare, possono progredire verso una retinopatia diabetica non proliferativa (NPDR) da moderata a grave.7 La retinopatia diabetica proliferativa è caratterizzata dalla proliferazione di nuovi vasi sanguigni retinici.7 L’edema maculare, che è un ispessimento centrale della retina con essudazione ed edema, può presentarsi in qualsiasi stadio della retinopatia.7 La retinopatia diabetica può essere accelerata dalla gravidanza, dalla pubertà, dalla mancanza di controllo glicemico, dall’ipertensione e dalla chirurgia della cataratta.7
Prevenire la retinopatia diabetica. Il controllo glicemico è fondamentale per la prevenzione della retinopatia diabetica. Nel Diabetes Control and Complications Trial (DCCT), i ricercatori hanno valutato l’effetto di uno stretto controllo glicemico e la progressione da retinopatia nulla o minima al basale a NPDR moderata.10 Per i pazienti nel gruppo di terapia intensiva senza retinopatia al basale, il rischio medio di retinopatia è stato ridotto del 76% in 36 mesi.10 Tra i pazienti del gruppo di terapia intensiva che presentavano già una NPDR da minima a moderata, il rischio di progressione è stato ridotto del 54% rispetto a quelli che utilizzavano il trattamento convenzionale.10 Nello studio originale Action to Control Cardiovascular Risk in Diabetes (ACCORD), i partecipanti con diabete di tipo 2 da 10 anni e malattia cardiovascolare nota sono stati randomizzati alla terapia intensiva o standard per la glicemia, la pressione sanguigna sistolica e la dislipidemia. Quattro anni più tardi, la progressione della retinopatia è stata ridotta in quelli con precedente controllo glicemico intensivo, indipendentemente da simili livelli attuali di HbA1c.11 Simili effetti di eredità non sono stati visti in quei gruppi con controllo intensivo della pressione sanguigna o su fenofibrato per dislipidemia.11
Screening. Poiché l’edema maculare e la retinopatia diabetica proliferativa possono essere asintomatici, lo screening è vitale per la diagnosi precoce e il trattamento. Per i pazienti con diabete di tipo 1, lo screening dovrebbe essere iniziato cinque anni dopo la diagnosi.8 Per quelli con diabete di tipo 2, lo screening dovrebbe essere iniziato alla diagnosi.8 Lo screening dovrebbe essere completato da un oftalmologo o optometrista esperto in retinopatia diabetica. Lo screening dovrebbe essere completato con gli occhi dilatati. Se la retinopatia è già presente, si raccomanda il rinvio ad un oftalmologo.8 La valutazione ripetuta dovrebbe essere fatta ogni anno se la malattia è minima o assente.8
La gravidanza è un periodo ad alto rischio per la retinopatia proliferativa. Nelle donne incinte con preesistente diabete di tipo 1 o 2, gli esami oculistici dovrebbero essere eseguiti prima del concepimento o nel primo trimestre. Gli esami dovrebbero essere ripetuti ogni trimestre e per un anno dopo il parto.8 Per quelle con diabete gestazionale, non sono necessari ulteriori esami oculistici dopo il parto.
La gravidanza in pazienti con preesistente diabete di tipo 1 o 2 può comportare una rapida progressione della retinopatia diabetica. Questo è particolarmente vero se c’è uno scarso controllo glicemico al momento del concepimento.14 Le donne con diabete che sono incinte o che stanno pianificando una gravidanza dovrebbero essere informate sul rischio di sviluppo o progressione della retinopatia diabetica e sulla necessità di controllo glicemico prima del concepimento.8 Tuttavia, un peggioramento precoce della retinopatia può verificarsi con la rapida attuazione di una gestione glicemica intensiva se la retinopatia è già presente.8 Il diabete gestazionale non sembra conferire lo stesso rischio di sviluppare retinopatia diabetica durante la gravidanza.8
Trattamento. Oltre al controllo glicemico, il controllo della pressione sanguigna (< 140 mmHg sistolica) ha anche dimostrato di diminuire la progressione della retinopatia diabetica, ma non vi è alcun beneficio aggiuntivo di uno stretto controllo della pressione sanguigna sistolica < 120 mmHg.12 Fenofibrato anche può rallentare la progressione della retinopatia diabetica, soprattutto con NPDR molto lieve, in pazienti con dislipidemia.13 L’aspirina ha dimostrato di non avere alcun effetto sulla progressione della retinopatia, sullo sviluppo dell’emorragia vitreale o sulla durata dell’emorragia vitreale, e può essere usata in modo sicuro per altre indicazioni mediche senza compromissione oculare.7
Il trattamento dei pazienti con diabete dovrebbe includere raccomandazioni per l’esercizio. Quelli con retinopatia non proliferativa lieve possono iniziare l’attività fisica in modo sicuro. Tuttavia, i pazienti con retinopatia non proliferativa moderata dovrebbero evitare le attività che aumentano notevolmente la pressione sanguigna, come il powerlifting.15 I pazienti con retinopatia non proliferativa o instabile grave dovrebbero evitare qualsiasi attività fisica che sia vigorosa (salti, scossoni), qualsiasi attività a testa bassa, e la ritenzione del respiro.15 In caso di emorragia vitreale, non dovrebbe essere fatto alcun esercizio.15
La diagnosi precoce della retinopatia diabetica è importante perché il trattamento può prevenire o invertire la perdita della vista. Nel Diabetic Retinopathy Study (DRS), i ricercatori hanno scoperto che la chirurgia di fotocoagulazione era un trattamento efficace per la retinopatia diabetica. Lo studio Early Treatment Diabetic Retinopathy e il DRS hanno dimostrato che la fotocoagulazione riduceva il rischio di perdita della vista, con il maggior beneficio nei pazienti che avevano una malattia di base più avanzata.16,17 I dati attuali forniscono la prova che gli agenti intravitreali del fattore di crescita endoteliale (anti-VEGF) sono più efficaci nel trattamento dell’edema maculare rispetto alla monoterapia o alla terapia combinata con la coagulazione laser.8 Inoltre, gli anti-VEGF possono migliorare la vista, mentre la fotocoagulazione previene soltanto un’ulteriore perdita della vista.18,19 Uno svantaggio dell’anti-VEGF è che richiede una terapia intravitreale mensile durante i primi 12 mesi.
Perle cliniche
- Non ci sono segni o sintomi specifici della retinopatia diabetica precoce.
- Lo screening della retinopatia diabetica dovrebbe essere effettuato in pazienti:
– con diabete di tipo 1 cinque anni dopo la diagnosi.
– in pazienti con diabete di tipo 2 alla diagnosi.
- La consulenza e gli esami aumentati dovrebbero essere forniti alle donne diabetiche che progettano di diventare o diventare incinte, perché la retinopatia diabetica può accelerare rapidamente durante la gravidanza.
- Il controllo glicemico stretto e il controllo della pressione sanguigna (< 140 mmHg sistolica) possono prevenire lo sviluppo della retinopatia diabetica.
- Fino al 50% dei pazienti con albuminuria (indipendentemente dal livello di eGFR) avranno retinopatia.9
- Il trattamento con fotocoagulazione può prevenire la progressione della malattia e il trattamento anti-VEGF può invertire la perdita della vista da edema maculare.
Malattia renale da diabete
La malattia renale da diabete (DKD), la terminologia preferita dall’ADA, è la causa principale della malattia renale cronica (CKD) negli Stati Uniti.20,21 La DKD ha effetti significativi a lungo termine sulla qualità della vita dei pazienti con diabete ed è responsabile fino al 40% della malattia renale allo stadio terminale (ESRD).20 Sulla base della Kidney Disease Outcomes Quality Initiative (KDOQI) della National Kidney Foundation e degli ADA 2017 Standards of Care, questa sezione fornirà indicazioni sui livelli target di HbA1c, sulla gestione dei farmaci e sul trattamento terapeutico per i pazienti con DKD.
La KDOQI stratifica il livello target di HbA1c in base al rischio di ipoglicemia e alle comorbidità del paziente. Questa iniziativa si basa su tre pubblicazioni che dimostrano che il controllo glicemico con HbA1c inferiore al 7% previene o riduce la progressione della malattia renale nei pazienti con diabete di tipo 2.22,23,24 Questi studi sono riassunti nella tabella 2. L’ADA raccomanda che nei pazienti a più alto rischio di ipoglicemia, l’obiettivo dell’HbA1c sia superiore al 7%.8 Il KDOQI raccomanda ai pazienti con CKD stadio 4 e 5 che hanno un’aspettativa di vita limitata di mantenere un HbA1c superiore al 7%.25
Tabella 2. Seleziona gli studi di riferimento che dimostrano il controllo glicemico con A1c inferiore al 7% |
|
|
Trial |
Results |
|
Action in Diabetes and Vascular Disease: Preterax and Diamicron Modified Release Controlled Evaluation (ADVANCE) Trial22 |
21% riduzione nuova macroalbuminuria e terapia sostitutiva renale con A1c inferiore al 7% |
|
Veterans Affairs Diabetes Trial (VADT)23 |
37% riduzione della macroalbuminuria e 32% di riduzione della microalbuminuria con A1c inferiore al 7% |
|
Lo studio ACCORD (Action to Control Cardiovascular Risk in Diabetes)24 |
Riduzione del 2% della macroalbuminuria e del 21% della microalbuminuria con A1c inferiore al 7% |
Epidemiologia. Maschi e femmine sono ugualmente colpiti dalla DKD.20 Il picco di incidenza per lo sviluppo della DKD è 15 anni dopo la diagnosi.21 Gli afroamericani hanno da tre a cinque volte più probabilità di sviluppare la nefropatia diabetica rispetto ai caucasici.20 Anche i messicani americani e gli indiani Pima hanno un rischio maggiore di sviluppare la DKD.20
La proteinuria è un fattore predittivo di morbilità cardiovascolare e mortalità per tutte le cause nel diabete.21 La presenza di DKD è un fattore di aumento del rischio di malattia cardiovascolare. I pazienti con DKD affrontano costantemente tassi di mortalità per malattie cardiovascolari più elevati.26 Inoltre, la mortalità per tutte le cause è più alta nei pazienti con DKD.21
Nel diabete di tipo 1, le complicazioni microvascolari come la DKD iniziano a svilupparsi circa 10-20 anni dopo la diagnosi; nel diabete di tipo 2, l’esordio esatto spesso non è noto e quindi giustifica uno screening più precoce.27
Patofisiologia e patogenesi. Si pensa che l’iperglicemia induca tre principali cambiamenti istologici a livello dei glomeruli che portano alla DKD: 1) espansione mesangiale, 2) ispessimento della membrana basale glomerulare e 3) sclerosi glomerulare.28 Sebbene l’esatta patogenesi del perché si verifichi la DKD sia sconosciuta, si pensa che l’iperglicemia causi inizialmente iperfiltrazione e danno renale come risultato di cambiamenti istologici e attivazione di citochine.20 Tipicamente, l’albuminuria può essere il primo segno di DKD.29
Questo è ulteriormente aggravato come risultato di condizioni comorbide di iperlipidemia, arteriosclerosi, ipertensione e obesità, che contribuiscono tutte al danno renale e al successivo declino funzionale. L’obesità centrale porta all’ipertensione attraverso l’iperattivazione del sistema renina-angiotensina-aldosterone e del sistema nervoso simpatico.20 Inoltre, quando la vasculatura renale diventa arteriosclerotica, si verifica una maggiore progressione della nefropatia diabetica. Un’importante caratteristica distintiva della nefropatia diabetica rispetto ad altre forme di CKD è che i glomeruli e i reni di solito sono inizialmente di dimensioni normali o aumentate.20
Classificazione. Sia l’eGFR che la presenza di albuminuria sono usati per classificare la CKD.30,31 L’eGFR si basa su razza, età, sesso, peso e livelli di creatinina nel siero. (Vedi Tabella 3.) Storicamente, il termine microalbuminuria è stato usato per definire i livelli di albumina moderatamente aumentati. La National Kidney Foundation raccomanda ora di usare i termini “lieve”, “moderato” o “gravemente aumentato” per descrivere i livelli di albuminuria in base ai livelli illustrati nella Tabella 4.31 Il rapporto albumina/creatinina è il test iniziale utilizzato per rilevare l’albuminuria.
Tabella 3. GFR stimato con stadio e descrizione |
|||
|
Stadio |
GFR (mL/min per 1.73 m2) |
Descrizione |
|
|
90+ |
Iperfiltrazione glomerulare |
||
|
Funzione renale lievemente ridotta |
|||
|
3A |
Funzione renale moderatamente ridotta |
||
|
3B |
|||
|
Funzione renale gravemente ridotta |
|||
|
< 15 o in dialisi |
Infarto renale all’ultimostadio di insufficienza renale |
||
Tabella 4. Categorie di albuminuria nella CKD |
||
|
Categoria |
Albumina-Creatinina |
Descrizione |
|
A1 |
< 30 |
Normale a leggermente aumentato |
|
A2 |
Moderatamente aumentato |
|
|
A3 |
> 300 |
Severamente aumentato |
I due schemi di classificazione rappresentano il doppio percorso per sviluppare la CKD. Uno è attraverso l’elevazione della creatinina e il peggioramento del GFR. L’altro è attraverso lo sviluppo dell’albuminuria. L’aumento dell’albuminuria è spesso seguito da un declino dell’eGFR;32 tuttavia, questo può essere evitato attraverso l’uso di inibitori dell’enzima di conversione dell’angiotensina (ACE) o bloccanti del recettore dell’angiotensina (ARB) e controllo glicemico. (Vedi Figura 1.)
Figura 1. Frequenza suggerita di valutazione (numero di volte all’anno) per categoria di eGFR e albuminuria
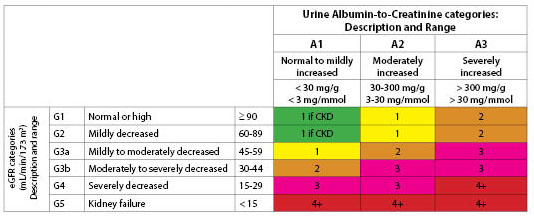
Ristampato con il permesso di Kidney Disease: Improving Global Outcomes (KDIGO).
Sintomi comuni. La maggior parte delle persone non ha sintomi da nefropatia diabetica. Spesso, i pazienti possono avere prove o diagnosi di altre complicazioni microvascolari.20 La DKD precoce è tipicamente asintomatica. Un reperto tardivo della DKD è l’urina schiumosa. Inoltre, se un paziente è gravemente ipoalbuminemico, lui o lei può presentare un edema dei pedali e affaticamento.20 I pazienti con DKD hanno tipicamente ipertensione sistemica. I pazienti con nefropatia diabetica presentano tipicamente anche retinopatia e neuropatia.8
Opzioni diagnostiche. Poiché non ci sono sintomi, lo screening di routine è fondamentale. L’ADA raccomanda uno screening annuale del rapporto albumina urinaria/creatinina.8 Inoltre, almeno annualmente, l’eGFR dovrebbe essere testato nei pazienti con diabete di tipo 1 con durata di cinque anni e tra tutti i pazienti con diabete di tipo 2 o pazienti con ipertensione e diabete in comorbilità.8 Non esiste una chiara raccomandazione per ottenere immagini, come un’ecografia, per la diagnosi di DKD.
Diagnosi differenziale. Alcune bandiere rosse possono suggerire che il diabete non è l’unica causa della CKD. Se una persona ha una CKD avanzata senza evidenza di altre complicazioni microvascolari, questo è un avvertimento. Una proteinuria eccessiva con insorgenza improvvisa (meno di cinque anni dopo l’inizio del diabete) di sedimento urinario con globuli rossi dismorfi e calchi, o un brusco calo del GFR, suggerisce una malattia renale di eziologia non diabetica.20 L’elettroforesi sierica o urinaria può essere effettuata se si teme un mieloma multiplo. L’assenza di albuminuria con un eGFR ridotto e il diabete richiede un’indagine per cause di CKD diverse dalla DKD.21 La tabella 5 elenca le bandiere rosse che suggeriscono una malattia glomerulare non diabetica.
Tabella 5. Bandiere rosse che suggeriscono una malattia glomerulare non diabetica
- Inizio della proteinuria <a 5 anni dall’inizio documentato del diabete di tipo 1 o dall’inizio acuto della malattia renale
- Riduzione acuta dell’eGFR; Nefropatia diabetica
- Sedimento urinario contenente globuli rossi dismorfi o calchi cellulari
- Assenza di altre complicazioni microvascolari come neuropatia o retinopatia
- Segni e/o sintomi di un’altra malattia sistemica
Trattamento. Un segno distintivo della nefropatia del diabete è la gestione del glucosio, la riduzione del sale, la pressione sanguigna e la dislipidemia. Inoltre, i pazienti dovrebbero evitare farmaci e integratori nefrotossici come gli aminoglicosidi e gli antinfiammatori non steroidei. I pazienti dovrebbero essere indirizzati a un nefrologo allo stadio IV della malattia renale o in caso di rapido declino della funzione renale. Altre indicazioni per il rinvio dipendono dalla complessità del caso. I nuovi farmaci orali per il diabete possono aiutare a prevenire la progressione dell’insufficienza renale.
Controllo glicemico. La selezione dei farmaci, il monitoraggio e la farmacologia sono tutti influenzati nei pazienti con nefropatia diabetica. Quando l’eGFR di un paziente diminuisce, alcuni agenti orali richiedono un aggiustamento della dose. L’insulina rimane la terapia centrale per il controllo del glucosio nei pazienti con diabete e CKD avanzata.31 La tabella 6 mostra gli aggiustamenti della dose raccomandati per i farmaci antiglicemici nei pazienti con malattia renale. Nel 2016, sia empagliflozin che canagliflozin hanno dimostrato di ridurre la progressione della CKD e la microalbuminuria.33,34 Empagliflozin ha abbassato i tassi di progressione della nefropatia e ridotto il rischio di eventi cardiovascolari avversi maggiori rispetto al placebo quando è stato aggiunto alla cura standard del diabete di tipo 2 nello studio di riferimento Empagliflozin Cardiovascular Outcome Event Trial in Type 2 Diabetes Mellitus Patients (EMPA-REG).33
Tabella 6. Aggiustamenti della dose e raccomandazioni per gli agenti che abbassano il glucosio nei pazienti con insufficienza renale |
||
|
Glucosio-abbassamento del glucosio |
Adeguamenti del dosaggio nella compromissione renale |
|
Classe |
Medicazione |
|
|
Biguanidi |
Metformina |
eGFR 30 a 45 mL/min/1.73 m2: Non raccomandato per iniziare la terapia. Se dopo l’inizio, valutare i benefici/rischi di continuare la terapia. eGFR < 30 mL/min/1.73 m2: L’uso è controindicato |
|
Sulfoniluree |
Glimepiride |
Moderata compromissione: Iniziare a 1 mg una volta al giorno Malattia grave: L’uso è controindicato |
|
Glipizide |
a rilascio prolungato: Iniziare a 2,5 mg una volta al giorno |
|
|
Gliburide |
eGFR < 60 mL/min/1.73 m2: L’uso non è raccomandato |
|
|
Meglitinidi |
Nateglinide |
No aggiustamento del dosaggio necessario |
|
Repaglinide |
CrCl 20 a 40 mL/min: Iniziare a 0.5 mg con i pasti CrCl < 20 mL/min: Nessuna informazione |
|
|
Thiazolidinediones |
Pioglitazone |
Nessun adeguamento del dosaggio necessario |
|
Rosiglitazone |
Nessun adeguamento del dosaggio necessario |
|
|
α-Inibitori della glucosidasi |
Acarbosio |
SCr > 2.0 mg/dL: L’uso non è raccomandato |
|
Miglitolo |
CrCl < 25 mL/min o SCr >2.0 mg/dL: L’uso non è raccomandato |
|
|
Inibitori DPP-4 |
Alogliptin |
CrCl da 30 a 60 mL/min: 12. 5 mg una volta al giorno .5 mg una volta al giorno CrCl < 30 mL/min: 6,25 mg una volta al giorno ESRD che richiede emodialisi: 6.25 mg una volta al giorno e somministrare senza considerare i tempi di emodialisi |
|
Linagliptin |
Nessun aggiustamento di dosaggio necessario |
|
|
Saxagliptin |
CrCl ≤ 50 mL/min: 2.5 mg una volta al giorno ESRD che richiede emodialisi: 2.5 mg una volta al giorno e somministrare dopo emodialisi |
|
|
Sitagliptin |
CrCl 30-50 mL/min: 50 mg una volta al giorno CrCl < 30 mL/min: 25 mg una volta al giorno ESRD che richiede emodialisi o dialisi peritoneale: 25 mg una volta al giorno e somministrare senza considerare i tempi di emodialisi |
|
|
Vildagliptin |
CrCl < 50 mL/min: 50 mg una volta al giorno |
|
|
Bile acid sequestrants |
Colesevelam |
Non sono necessari aggiustamenti di dosaggio |
|
Dopamina-2 agonisti |
Bromocriptina |
Nessuna informazione |
|
Inibitori SGLT-2 |
Canagliflozin |
eGFR 45 a 60 mL/min/1.73 m2: Non superare i 100 mg una volta al giorno eGFR < 45 mL/min/1.73 m2: Non raccomandato per iniziare la terapia. Se dopo l’inizio, interrompere la terapia per i pazienti con eGFR persistente < 45 mL/minuto/1.73 m2. eGFR < 30 mL/min/1.73 m2/ESRD/Hemodialysis: L’uso è controindicato |
|
Dapagliflozin |
eGFR < 60 mL/min/1.73 m2: Non raccomandato per iniziare la terapia. Se dopo l’inizio, interrompere la terapia per i pazienti con eGFR persistente tra 30 e < 60 mL/min/1.73 m2. eGFR < 30 mL/min/1.73 m2/ESRD/Hemodialysis: L’uso è controindicato |
|
|
Empagliflozin |
eGFR < 45 mL/min/1.73 m2: Non raccomandato per iniziare la terapia. Se dopo l’inizio, interrompere la terapia per i pazienti con eGFR persistente < 45 mL/min/1.73 m2. eGFR < 30 mL/min/1.73 m2. ESRD/ Emodialisi: L’uso è controindicato |
|
|
GLP-1 agonisti del recettore |
Albiglutide |
Nessun adeguamento del dosaggio necessario |
|
Dulaglutide |
Nessun aggiustamento del dosaggio necessario |
|
|
Exenatide |
CrCl 30 a 50 mL/min: Nessuna informazione. Usare con cautela. CrCl < 30 mL/min/ ESRD: L’uso non è raccomandato |
|
|
Liraglutide |
Nessuna informazione |
|
|
Lixisenatide |
eGFR 15 a 29 mL/min/1.73 m2: Nessuna informazione. Monitorare per aumento degli effetti avversi GI che possono portare a disidratazione e peggioramento della funzione renale. eGFR <15 mL/min/1.73 m2/ ESRD: L’uso non è raccomandato |
|
|
Amylin mimetics |
Pramlintide |
CrCl ≥15 mL/min: Nessun aggiustamento del dosaggio necessario ESRD: Nessuna informazione |
|
Insuline |
Analoghi ad azione rapida
Ad azione rapida
Intermedio-ad azione media
Analoghi dell’insulina basale
|
I requisiti dell’insulina possono essere ridotti a causa di cambiamenti nella clearance dell’insulina o nel metabolismo. Monitorare attentamente la glicemia. |
Pressione sanguigna. Il trattamento per la pressione sanguigna dovrebbe iniziare a 140/90 mmHg per i pazienti con diabete e malattia renale diabetica.37 Lo United Kingdom Prospective Diabetes Study (UKPDS) ha trovato una riduzione del 12% del rischio di complicazioni diabetiche con ogni diminuzione di 10 mmHg della pressione sistolica fino a 120 mmHg.38 I farmaci di scelta rimangono gli ACE inibitori o gli ARB per gli individui con ipertensione e diabete, DKD, e CKD. L’ACE inibizione ha dimostrato di ritardare lo sviluppo della DKD se iniziata in pazienti con albuminuria lievemente elevata. La creatinina può salire fino al 30% all’inizio di un ACE inibitore o ARB.39 Considerare la valutazione di altre malattie renali sottostanti se la creatinina sale più di così.
Il KDOQI raccomanda di non dare ACE/ARB a pazienti con diabete di tipo 2 che sono normotesi e normoalbuminurici.40,41,42 Gli ACE-inibitori o gli ARB sono suggeriti per i pazienti diabetici normotesi con microalbuminuria.31,37 Non esiste una dose o una titolazione specifica per questi individui. Il doppio blocco del sistema renina-angiotensina da parte di ACE e ARB non è raccomandato a causa dell’aumentato rischio di iperkaliemia, alterazione della funzione renale e ipotensione.43
Riduzione del sale. Il 2012 Reduction of Endpoints in Non-insulin-dependent diabetes mellitus with the Angiotensin II Antagonist Losartan (RENAAL) Trial e Irbesartan Diabetic Nephropathy Trial (IDNT) hanno dimostrato che le diete a basso contenuto di sodio hanno aumentato gli effetti nefroprotettivi e cardioprotettivi degli ARB nei pazienti con diabete di tipo 2 e nefropatia diabetica.44,45
Dialisi renale e trapianto renale. I pazienti con ESRD dovrebbero essere indirizzati alla nefrologia. Le opzioni per il trattamento includono la dialisi peritoneale o l’emodialisi, il trasporto renale, o l’opzione di interrompere il trattamento e iniziare le cure palliative o l’hospice. Uno studio osservazionale ha scoperto che i pazienti che hanno iniziato la dialisi in età più giovane (< 60 anni) avevano una sopravvivenza più scarsa.46
Riferimento. La Figura 1 include le indicazioni per il rinvio in base al GFR e alla classificazione dell’albuminuria. Considerare altre cause di malattia renale non correlate al diabete, specialmente nei pazienti con diabete di tipo 1 in cui l’insorgenza della retinopatia non precede lo sviluppo della nefropatia.21 I nefrologi possono aiutare a chiarire la diagnosi, controllare l’ipertensione resistente e l’iperkaliemia e preparare i pazienti alla dialisi.8
Si deve anche considerare che lo sviluppo della nefropatia può non essere legato al diabete stesso. Nei pazienti con diabete di tipo 1, l’insorgenza della retinopatia di solito precede lo sviluppo della nefropatia.47 Un individuo che presenta una nefropatia ma nessuna retinopatia dovrebbe essere sottoposto a una valutazione per altre cause. Il rinvio a un nefrologo dovrebbe essere fatto per stabilire la causa della nefropatia quando è incerta o quando ci sono problemi difficili da gestire, legati alla DKD, tra cui l’anemia, l’iperparatiroidismo e l’avanzamento della malattia renale con un eGFR < 30 mL/min/1.73 m2.8 Avere un nefrologo di riferimento quando si sviluppa la fase 4 della CKD (eGFR < 30 mL/min/1.73 m2) è associato a una minore morbilità, una riduzione dei costi sanitari e un ritardo della dialisi.48 Considerare un rinvio allo stadio 3B per preparare i pazienti prima e per consentire alla nefrologia di trattare al massimo dal punto di vista medico.
Perle cliniche
- Lo screening annuale della DKD dovrebbe avvenire attraverso il test dell’albumina urinaria e una misurazione dell’eGFR.
- Il controllo della pressione sanguigna e del glucosio può fornire una prevenzione della progressione della nefropatia. Mantenere la pressione sanguigna < 140/90 mmHg nei pazienti con diabete e CKD. Gli ACE inibitori o gli ARB dovrebbero essere il trattamento di scelta.
- Gli ACE inibitori e gli ARB non dovrebbero essere usati per prevenire la nefropatia se la pressione sanguigna e l’escrezione delle proteine sono normali. Gli ACE inibitori e gli ARB non devono essere usati in combinazione.
- I pazienti con CKD stadio 3-5 hanno un rischio aumentato di ipoglicemia. Si deve usare cautela con gli agenti orali come le sulfoniluree.
- In alcuni pazienti con CKD, è opportuno impostare l’obiettivo HbA1c > 7%, soprattutto quando il rischio di ipoglicemia è grande.
Neuropatia periferica diabetica
Una definizione ampiamente accettata di neuropatia periferica diabetica (DPN) nella pratica clinica è “la presenza di sintomi e/o segni di disfunzione nervosa periferica in persone con diabete dopo l’esclusione di altre cause.”49 La classificazione ADA della polineuropatia simmetrica distale è: 1) principalmente neuropatia a piccole fibre, 2) principalmente neuropatia a grandi fibre, e 3) neuropatia mista a piccole e grandi fibre (più comune).
Patofisiologia e patogenesi. Lo sviluppo e la progressione della DPN derivano dalle complesse relazioni tra i nervi e le cellule circostanti.50 Sia i fattori vascolari che le interazioni metaboliche contribuiscono a tutte le fasi della DPN.51 La comprensione generalmente accettata nel diabete umano che porta allo sviluppo della DPN è la complessa interazione tra l’iperglicemia, la durata del diabete, i danni neuronali legati all’età, i gradi di controllo della pressione sanguigna e dei lipidi nel sangue e il peso.52,53,54,55 L’iperglicemia attiva numerose vie biochimiche che determinano lo stato metabolico di una cellula nervosa e si combina con una perfusione nervosa compromessa, contribuendo alla progressione delle neuropatie. Uno studio di riferimento, il DCCT, sostiene l’importanza dell’iperglicemia nella patogenesi della neuropatia.10,56,57 Un altro meccanismo legato all’iperglicemia che porta alla DPN è lo stress ossidativo e nitrosativo indotto dall’iperglicemia con un aumento della produzione di radicali liberi.58,59
Oltre all’iperglicemia, è stato recentemente suggerito che l’infiammazione di basso grado possa svolgere un ruolo importante nella patogenesi delle neuropatie diabetiche, portando a deficit nelle fibre nervose periferiche e autonome.51,60 La complessa serie di fattori metabolici e vascolari innesca lo squilibrio tra danni e riparazioni nelle fibre nervose, colpendo specificamente le fibre sensoriali distali e contribuendo alla graduale perdita di sensibilità che manifesta i sintomi clinici della polineuropatia diabetica.58,61
Sintomi comuni. Quando ci si informa sui sintomi della DPN sperimentati, prendere nota della localizzazione (molto probabilmente sentita nelle mani e nei piedi), dei fattori precipitanti, delle caratteristiche dei disagi, così come dell’insorgenza e della frequenza delle esacerbazioni notturne, poiché i sintomi sono specifici del paziente.4 Sia le piccole che le grandi fibre sono colpite da una glicemia elevata, e i sintomi sperimentati variano a seconda della classe delle fibre sensoriali colpite. Quando le fibre nervose colpite sono prevalentemente piccole, i sintomi scatenati sono di solito il dolore (appiccicoso, lancinante, pungente, bruciante, doloroso, noioso ed eccessivamente sensibile), le disestesie (sensazioni spiacevoli di bruciore, formicolio, pizzicore e pugnalata) e l’intorpidimento.4
L’intensità del disagio può variare dalla sensazione di piccole sensazioni anormali all’essere disabili dal dolore che può essere esacerbato di notte e disturbare il sonno, che ha dimostrato di essere associato alla depressione a causa di una percezione di una minore qualità della vita.4
D’altra parte, quando le grandi fibre sono colpite in modo predominante, i pazienti potrebbero sentire intorpidimento e formicolio alle estremità, sperimentare un’andatura instabile e perdere l’equilibrio (con conseguente potenziale caduta).4 Alcuni pazienti potrebbero sperimentare il peggioramento dei sintomi quando i loro livelli di glucosio nel sangue diminuiscono a causa dell’intensificazione della gestione terapeutica del diabete. I pazienti potrebbero essere asintomatici ma con vari gradi di perdita sensoriale; un risultato indesiderato di una grave perdita sensoriale dovuta alla neuropatia diabetica può essere una lesione indolore, che porta a un aumento del rischio di ulcerazione del piede o, in casi gravi, di amputazione.62
La forma più comune di neuropatia periferica diabetica è la polineuropatia simmetrica distale con una perdita progressiva di fibre nervose sensoriali.4 Il tipico modello “a calza” bilaterale è creato dai danni che si verificano sulle porzioni più distali dei nervi più lunghi (che vengono colpiti per primi).63,64,65 Con il passare del tempo, un modello “a calza”, che promuove la perdita sensoriale e i sintomi tipici della DNP, risulta dal procedere prossimale dei deficit nervosi.4
Diagnosi clinica. Una diagnosi clinica di DPN può essere fatta sulla base di segni e sintomi neuropatici di un paziente con diabete dopo aver escluso altre cause di neuropatia.66 La neuropatia periferica diabetica asintomatica può verificarsi fino al 50% di coloro che hanno questa complicazione; pertanto, l’attuazione della cura preventiva del piede è essenziale, soprattutto per coloro che sono ad alto rischio di lesioni dovute a piedi insensibili.4 Lo screening annuale per la DPN dovrebbe essere eseguito in tutti i pazienti con diabete tramite puntura di spillo, temperatura, percezione delle vibrazioni (usando un diapason a 128 Hz), sensazione di pressione del monofilamento da 10 g e riflessi tendinei profondi della caviglia; le potenziali ulcere del piede possono essere previste da una perdita della sensazione del monofilamento da 10 g (perdita della sensazione protettiva) e una ridotta percezione delle vibrazioni.63 Gli Standards of Medical Care in Diabetes-2017 dell’ADA continuano a raccomandare un test annuale del monofilamento 10-g allo scopo di identificare i pazienti a rischio di sviluppare ulcerazione e amputazione.8 Inoltre, le linee guida ADA 2017 raccomandano lo screening per la DPN alla diagnosi di diabete di tipo 2 e cinque anni dopo la diagnosi di diabete di tipo 1.8
Nel 2009, il Toronto Consensus Panel on Diabetic Neuropathies ha aggiornato i criteri diagnostici per fornire categorie diagnostiche. Inoltre, diversi strumenti di screening ben validati possono essere inclusi dagli operatori sanitari nel processo diagnostico, tra cui il Michigan Neuropathy Screening Instrument (MNSI), il Toronto Clinical Neuropathy Score e la Utah Neuropathy Scale. La tabella 7 descrive altre cause di neuropatia che dovrebbero essere escluse.
Tabella 7. Altre cause di neuropatia67
- Alcol o altre tossine
- Medicine neurotossiche, specialmente chemioterapia
- Carenza di vitamina B12
- Ipotiroidismo
- Malattie renali
- Malignità (mieloma multiplo, carcinoma broncogeno)
- Virus dell’immunodeficienza umana (HIV)
- Neuropatia demielinizzante infiammatoria cronica, neuropatie ereditarie e vasculiti
Studi diagnostici. Esistono diversi test diagnostici per confermare la presenza della DPN. Gli studi di conduzione nervosa sono stati considerati per anni il test diagnostico gold standard per la DPN a causa delle loro misure oggettive senza le risposte dei pazienti, che portano ad un’alta affidabilità.4 I test sensoriali quantitativi valutano le capacità dei pazienti di rilevare il tocco leggero, le vibrazioni e la discriminazione della temperatura, coinvolgendo un certo livello di soggettività.4 Altri metodi, tra cui la biopsia cutanea e la densità delle fibre nervose intraepidermiche e la microscopia confocale corneale, non sono stati utilizzati di routine nella pratica clinica ma possono essere utilizzati negli studi clinici.4
Opzioni terapeutiche: Trattamento farmacologico. Il trattamento farmacologico della DPN è per il miglioramento dei sintomi, quindi i farmaci utilizzati non sono destinati a prevenire la progressione. La tabella 8 riassume i farmaci delle tre classi più comunemente usate (anticonvulsivanti, antidepressivi e oppioidi) per controllare i sintomi neuropatici. Sebbene diversi agenti siano comunemente usati come approccio iniziale per la gestione della DPN, solo pregabalin e duloxetina sono stati approvati dalla FDA per la gestione di questa condizione; pertanto, uno di questi agenti è raccomandato come scelta iniziale per il dolore neuropatico sintomatico.4 Il gabapentin, sebbene non sia stato approvato dalla FDA per essere usato nella gestione della DPN, è spesso usato come approccio iniziale, che ha un’efficacia comparativa con gli agenti approvati dalla FDA. Gli antidepressivi triciclici (ad esempio, l’amitriptilina) – agenti non approvati dalla FDA per la DPN – sono efficaci nella gestione della DPN, ma devono essere usati con cautela a causa di un rischio maggiore di effetti collaterali.
Tabella 8. Agenti farmacologici comunemente usati per la DPN4,69 |
|||||
|
Agente farmaceutico (intervallo NNT 30-50% di miglioramento*) |
Dose massima giornaliera per DNP (mg/giorno) |
Effetti collaterali comuni |
Regolazioni della dose necessarie? |
Contraindicazioni |
Considerazioni sulla prescrizione |
|
Anticonvulsivanti
|
|||||
|
Pregabalin (3.3-8.3) |
Dizziness Somnolence Weight gain Peripheral edema Blurred vision Constipation |
Renal: Sì Epatico: No |
Ipersensibilità al pregabalin |
Prova forte; approvato dalla FDA; sostanza controllata |
|
|
Gabapentin (3.3-7.2) |
3,600 |
Dizziness Ataxia Somnolence Headache Nausea Diarrhea Weight gain |
Renal: Sì Hepatico: No |
Ipersensibilità al gabapentin |
Moderata evidenza; non approvato dalla FDA |
|
Antidepressivi
|
|||||
|
Amitriptilina (2.1-4.2) |
Sedazione grave; confusione; effetti anticolinergici (stipsi, visione offuscata) |
Renal: No Epatico: No Dosi più basse sono raccomandate per pazienti anziani |
Ipersensibilità all’amitriptilina; co-somministrazione con o entro 14 giorni di MAO; co-somministrazione con cisapride; fase acuta di recupero dopo infarto miocardico |
Moderata evidenza; non approvato dalla FDA; usare con cautela per quelli con una storia di malattia cardiovascolare |
|
|
Duloxetina (3.8-11) |
(Stati Uniti) |
Nausea; sedazione; sonnolenza generalizzata |
Renal: Si Epatico: Evitare l’uso nella compromissione epatica |
Ipersensibilità; co-somministrazione con o entro 14 giorni di MAO; inizio in coloro che stanno ricevendo linezolid o blu di metilene IV |
Moderata evidenza; Approvato dalla FDA; può essere aggiunto a pregabalin o gabapentin |
|
Venlafaxina (5.2-8.4) |
Nausea; sedazione; sonnolenza generalizzata |
Renal: Sì Hepatic: Sì |
Prove deboli; non approvato dalla FDA; può essere aggiunto al gabapentin |
||
|
Opioidi
|
|||||
|
Tramadolo (2.1-6.4) |
Sonnolenza Nausea Vomito Constipazione Capogiri Dizziness Cefalea |
Renal: Yes Hepatic: No |
Ipersensibilità al tramadolo, agli oppioidi o a qualsiasi componente della formulazione; Formulazione ER: depressione respiratoria significativa e asma acuta o grave; Formulazione IR: intossicazione acuta con alcool, ipnotici, narcotici, analgesici ad azione centrale, oppioidi o psicofarmaci |
Potenziale di abuso inferiore (sostanza controllata nella Tabella IV); non raccomandato per l’uso come agente di prima o seconda linea |
|
|
Tapentadolo (N/A) |
a rilascio immediato: Rilascio prolungato: |
Sonnolenza Nausea Vomito Costipazione Dizziness |
Renal: Uso non raccomandato quando Epatico: No |
Ipersensibilità al tapentadolo; depressione respiratoria significativa; asma acuto o grave; ileo paralitico; entro 14 giorni dall’uso di inibitori MAO |
Approvato dalla FDA; sostanza controllata nella Tabella II; non raccomandato per l’uso come agente di prima o seconda linea |
|
Le informazioni si riferiscono ad agenti farmaceutici ottenuti dai rispettivi foglietti illustrativi (indicati dai nomi commerciali) |
|||||
La linea guida dell’American Academy of Neurology (AAN) raccomanda i seguenti agenti topici: capsaicina e isosorbide dinitrato spray (evidenza moderata) e cerotto Lidoderm (evidenza debole).69 Oxcarbazepina, lamotrigina, lacosamide, clonidina, pentossifillina e mexiletina non sono raccomandate dalla linea guida AAN nel trattamento della DPN.69
Inoltre, gli oppioidi sono stati raccomandati da alcuni per l’uso nella DPN refrattaria. Gli oppioidi raccomandati dalla linea guida AAN includono destrometorfano (400 mg/die), morfina solfato (titolata a 120 mg/die), e ossicodone (media 37 mg/die, max 120 mg/die); tuttavia, non ci sono dati sufficienti per suggerire l’uso di un agente rispetto all’altro.69 Gli autori di questo articolo raccomandano di usare gli oppioidi solo nei casi refrattari gravi con un attento monitoraggio dei pazienti che ottengono un vero miglioramento funzionale dagli oppioidi. Gli autori seguono la dichiarazione di posizione del 2016 dei Centers for Disease Control and Prevention secondo cui gli oppioidi hanno un uso limitato a lungo termine nel dolore di tipo non-cancro.70
Una delle sfide nel trattamento farmacologico della DPN è l’inadeguatezza degli studi testa a testa che incorporano i risultati della qualità della vita.4 Un recente studio che ha confrontato una terapia di otto settimane tra pregabalin ad alto dosaggio, duloxetina ad alto dosaggio, o in combinazione, non ha trovato differenze significative nel cambiamento medio del dolore tra la monoterapia e la terapia combinata.71 Sono necessari più studi che confrontino due agenti attivi per fornire indicazioni per migliorare la cura di coloro che soffrono di neuropatia periferica diabetica.
Trattamento non farmacologico. Procedure. La linea guida ANN suggerisce di prendere in considerazione la stimolazione elettrica percutanea del nervo per tre o quattro settimane per il trattamento della DPN.69 Uno studio pilota, a due stili di agopuntura, randomizzato e controllato72 e uno studio randomizzato in singolo cieco, controllato con placebo73 che valuta l’efficacia dell’agopuntura nella DPN hanno entrambi mostrato miglioramenti nelle misure di risultato associate al dolore. Tuttavia, sono necessari ulteriori studi per confermare il ruolo dell’agopuntura nella gestione della DPN.
Acido alfa-lipoico. Alcune prove suggeriscono che l’uso di acido alfa-lipoico antiossidante potrebbe aiutare a ridurre lo stress ossidativo mediato dai radicali liberi e fornire i seguenti benefici: colpire la patogenesi, rallentare lo sviluppo e migliorare i sintomi della DPN.74,75
Prevenzione. È stato dimostrato che le modifiche dello stile di vita, incentrate su una dieta sana e sull’attività fisica, diminuiscono continuamente la prevalenza del diabete e delle sue complicazioni, compresa la neuropatia periferica diabetica.68 È stato dimostrato che un controllo glicemico intensivo contribuisce ad abbassare il rischio di neuropatia diabetica nei pazienti con diabete attraverso il miglioramento della funzione nervosa.61,76,77 Il DCCT ha stabilito il ruolo del controllo glicemico nella prevenzione e nella cessazione della progressione della neuropatia diabetica nel diabete di tipo 1.10,56
Perle cliniche
- Fino al 50% dei pazienti potrebbe avere una neuropatia periferica indolore o asintomatica.
- Si raccomanda ai pazienti con neuropatia di ricevere un’educazione alla cura del piede (autoispezione quotidiana dei piedi) e cure podologiche regolari per pazienti selezionati.
- I pazienti con DPN che mostrano segni di perdita della sensazione protettiva con o senza deformità dovrebbero essere consigliati di seguire un medico ogni tre o sei mesi per misure preventive.64
- Per gestire efficacemente i sintomi della DPN, diventa essenziale un approccio multidisciplinare; questo approccio globale potrebbe includere una terapia farmacologica, psicologica e/o fisica.
- Una nuova dichiarazione di posizione sulla neuropatia diabetica pubblicata dall’ADA raccomanda lo screening della DPN nei pazienti con prediabete che presentano sintomi di neuropatia periferica.4
- Sono necessarie cure specialistiche per le persone con malattia periferica, neuropatia non sensoriale o piede di Charcot.
Gastroparesi
Un’altra forma di neuropatia del diabete è la gastroparesi. Questa condizione è associata a sintomi gastrointestinali superiori tra cui nausea, vomito, sazietà precoce o pienezza postprandiale, dolore addominale e gonfiore, ma in assenza di ostruzione di uscita. Anche se ci sono diverse cause di gastroparesi, è stato stimato che il diabete è responsabile di circa un terzo di tutti i casi.78
Patofisiologia. I meccanismi fisiopatologici proposti per la gastroparesi diabetica includono un alterato controllo glicemico, neuropatia vagale o dei gangli simpatici prevertebrali, anomalie delle cellule interstiziali di Cajal, perdita di ossido nitrico sintasi e, forse, miopatia.79,80
Presentazione clinica. All’inizio di questa condizione, i pazienti sono solitamente asintomatici. Non c’è una relazione lineare tra i sintomi e la gravità della neuropatia. L’ampia varietà di sintomi rende difficile la diagnosi della condizione. Altre presentazioni cliniche includono anoressia, malnutrizione, perdita di peso e ipoglicemia dalla mancata corrispondenza tra l’assorbimento di cibo e insulina. Il dolore in realtà può essere sotto-riportato ma significativo per molte persone. In un consorzio finanziato dal NIH, il 72% dei pazienti con gastroparesi aveva dolore addominale.81 Questo era il sintomo dominante nel 18% di questi pazienti. Il dolore era indotto dal mangiare (72%), era notturno (74%) e interferiva con il sonno (66%) per questi pazienti.81
Quanto è comune la gastroparesi da diabete? L’incidenza cumulativa a 10 anni della gastroparesi è stata stimata al 5,2% nel diabete di tipo 1 e all’1% nel diabete di tipo 2 tra i pazienti della comunità con diabete.82 Altri studi hanno trovato tassi tra il 5-12%.83,84 Tuttavia, i tassi sono molto più alti quando la diagnosi si basa sui sintomi piuttosto che sullo studio di svuotamento gastrico.
La gastroparesi è più comune nel diabete di tipo 1 che nel diabete di tipo 2, ed è più comunemente vista dopo che la persona ha il diabete da più di 10 anni e ha sviluppato le altre complicazioni microvascolari di retinopatia, nefropatia e neuropatia periferica. Se un paziente si presenta con gastroparesi prima del previsto, dovrebbero essere esplorate altre eziologie, più comunemente lesioni del nervo vagale perioperatorio o effetti farmacologici da agenti a base di incretina – agonisti del recettore del peptide-1 glucagon-like (GLP-1RA) e inibitori della dipeptidil-peptidasi 4 (inibitori DPP-4).
Una volta che un paziente sviluppa sintomi da gastroparesi, i sintomi in genere persistono e sono stabili per 12-25 anni. Questo è vero anche se c’è un miglioramento del controllo del glucosio,85 tranne nel caso di un trapianto di pancreas e di rene.86 Sebbene non ci siano chiare prove che la gastroparesi aumenti la mortalità in sé, essa riduce sostanzialmente tutti gli aspetti della qualità della vita.87
Diagnostica. Un certo numero di test può aiutare nella diagnosi. Il gold standard per questa diagnosi è la scintigrafia gastroesofagea. Non è invasiva, verifica la fisiologia e fornisce risultati quantitativi. La gastroparesi può essere diagnosticata se c’è almeno il 35% di ritenzione di un pasto standard a basso contenuto di grassi quattro ore dopo l’ingestione.80
Per fornire i risultati più accurati del test, il protocollo pre-test dovrebbe includere la sospensione di tutti i farmaci che alterano la motilità per almeno due o tre giorni prima del test, compresi procinetici, oppiacei e anticolinergici. Anche gli agenti incretinici, come gli agonisti GLP-1 e gli inibitori DPP-4, dovrebbero essere sospesi, poiché sono noti per ritardare lo svuotamento gastrico. Anche l’iperglicemia ha dimostrato di ritardare lo svuotamento gastrico, e il glucosio dovrebbe essere inferiore a 275 mg/dL prima di iniziare lo studio.79,88
I pazienti dovrebbero astenersi dal fumare e dal consumare alcol nel giorno del test, poiché entrambi possono rallentare lo svuotamento gastroesofageo.89 Inoltre, i GLP-1RA possono aggravare la gastroparesi perché rallentano lo svuotamento gastrico. Inoltre, alcune persone possono avere una gastroparesi subclinica che viene scoperta quando viene iniziato un GLP-1RA.
Trattamento. Il trattamento della gastroparesi dipende in gran parte dalla gravità dei sintomi. I principi generali per il trattamento includono trattamenti di supporto (fluidi, elettroliti, controllo del glucosio e nutrizione), trattamenti medici (procinetici, antiemetici e antidolorifici) e trattamenti invasivi (chirurgia, iniezioni di Botox, stimolazione gastrica o elettrica).79
Il trattamento di supporto di solito viene iniziato in ospedale e si concentra sulla normalizzazione di fluidi, elettroliti e disturbi nutrizionali. Quando si fornisce supporto nutrizionale, l’alimentazione enterale è preferita a quella parenterale, poiché è più fisiologica e può aiutare a mantenere la flora intestinale. Inoltre, i cambiamenti nella dieta possono essere molto utili nella gastroparesi. Le diete a basso contenuto di fibre, grassi e residui sono raccomandate per i pazienti con gastroparesi.85 Le diete ad alto contenuto di fibre possono aumentare i sintomi, poiché richiedono una maggiore digestione.
Medicinali. Procinetici: Negli Stati Uniti la metoclopramide e l’eritromicina sono i farmaci più comunemente usati per trattare la gastroparesi. Tuttavia, la metoclopramide ha una scatola nera di avvertimento a causa del rischio di discinesia tardiva. Lo sviluppo di questa condizione è direttamente collegato alla durata dell’uso di metoclopramide e al numero di dosi prese. Quando si usa questo farmaco, è meglio usarlo solo in pazienti sintomatici e iniziare con la più bassa dose efficace 15 minuti prima dei pasti. Le vacanze farmacologiche a volte possono aiutare a prolungare la durata degli effetti.90
Domperidone è un agonista della dopamina più selettivo che è altrettanto efficace della metoclopramide ma ha meno effetti collaterali sul sistema nervoso centrale.91
Antiemetici: Gli antiemetici possono essere usati per aiutare i sintomi. Tuttavia, il rischio di interazioni farmacologiche è significativo e deve essere monitorato attentamente.
La gestione del dolore può essere una sfida nei pazienti con gastroparesi. Gli antidepressivi triciclici sono spesso usati come terapia di prima linea per il dolore nella gastroparesi. Gli approcci di seconda linea sono il debole agonista del recettore mu-opioide, il tramadolo, che rilascia anche serotonina e inibisce la ricaptazione della noradrenalina, e l’analogo dell’acido gamma-aminobutirrico, il gabapentin. Tuttavia, l’uso di narcotici nella gastroparesi non è raccomandato, poiché può contribuire alla costipazione e al peggioramento dei sintomi.
Trattamenti invasivi: Le iniezioni di botox sono usate comunemente nel trattamento della gastroparesi, ma il loro uso non è supportato da studi clinici.92,93
Il dispositivo di stimolazione elettrica gastrica è stato approvato dalla FDA sotto un’esenzione per dispositivi umanitari nel 2000.94 Il dispositivo di stimolazione elettrica gastrica fornisce una stimolazione elettrica ad alta frequenza e bassa energia allo stomaco. È più utile nella gastroparesi diabetica che in quella idiopatica. Una meta-analisi ha mostrato benefici sostanziali nei sintomi dei pazienti. Il meccanismo esatto del suo beneficio non è ancora noto.95 È stato proposto che la stimolazione elettrica gastrica provochi cambiamenti nei meccanismi centrali che controllano la nausea e il vomito, aumenti la funzione vagale e diminuisca la sensibilità alla distensione.97 I pazienti che rispondono bene in genere rispondono rapidamente. Questo ha portato alcuni a raccomandare una prova con il posizionamento temporaneo degli elettrodi prima dell’applicazione a lungo termine.
Perle cliniche
- La gastroparesi diabetica è più comune nelle persone con diabete di lunga data e in quelle con altre complicazioni microvascolari.
- La diagnosi gold standard per la gastroparesi è la scintigrafia gastroesofagea.
- Nella gastroparesi diabetica si raccomandano diete a basso contenuto di fibre, basso contenuto di grassi e basso contenuto di residui.
- I trattamenti farmacologici e interventistici hanno benefici limitati e significativi rischi a lungo termine.
Cheiroartropatia diabetica
Una delle complicazioni meno conosciute del diabete è la cheiroartropatia. Questa condizione è caratterizzata da una limitata mobilità articolare dovuta all’ispessimento della pelle nelle persone con diabete di lunga data. Probabilmente è stata la prima complicazione identificata dal diabete di tipo 1. I tassi di prevalenza variano ampiamente dall’8-50%.98
Si ritiene che la cheiroartropatia sia causata dalla glicosilazione e dal cross-linking del collagene. Può colpire la pelle e i tendini, e può risultare in una limitata mobilità articolare, più comunemente estensione delle dita, rigidità e dolore. Il classico segno dell’esame fisico per la cheiropatia diabetica è il “segno della preghiera”. In questa condizione, una persona non è in grado di appiattire completamente le mani per “pregare”, lasciando uno spazio tra le dita della mano sinistra e destra. Ci sono prove che coloro che sviluppano la cheiropatia hanno un rischio tre volte maggiore di complicazioni microvascolari.99
La cheiropatia diabetica è tipicamente peggiore in coloro che hanno una glicemia di lunga data o mal controllata. Fortunatamente, molte persone sperimentano il sollievo dei sintomi e una migliore mobilità quando il controllo del glucosio migliora.100
Conclusione
La gestione delle complicazioni del diabete richiede un team multidisciplinare. Lo screening precoce di retinopatia, nefropatia e neuropatia è essenziale, data la natura asintomatica della malattia. Il segno distintivo della gestione del diabete per tutte le complicazioni continua ad essere il controllo glicemico e della pressione sanguigna.
- American Diabetes Association. Costo del diabete. Disponibile presso: http://www.diabetes.org/advocacy/news-events/cost-of-diabetes.html?referrer=https://www.google.com/. Aggiornato il 22 giugno 2015. Accessed Feb. 8, 2017.
- UK Prospective Diabetes Study Group. Controllo intensivo della glicemia con sulfoniluree o insulina rispetto al trattamento convenzionale e rischio di complicazioni in pazienti con diabete di tipo 2. Lancet 1998;352:837-853.
- Gregg EW, Yanfed L, Wang J. Changes in diabetes-related complications in the United States, 1990-2010. N Engl J Med 2014;370:1514-1523.
- Pop-Busui R, Boulton A, Feldman E, et al. Neuropatia da diabete: Una dichiarazione di posizione dell’American Diabetes Association. Diabetes Care 2017;40:136-154.
- Leasher JL, Bourne RR, Flaxman SR, et al. Stime globali sul numero di persone cieche o ipovedenti per retinopatia diabetica: Una meta-analisi dal 1990 al 2010. Diabetes Care 2016;39:1643-1649.
- National Eye Institute. Fatti sulla malattia dell’occhio diabetico. Disponibile presso: https://nei.nih.gov/health/diabetic/retinopathy. Aggiornato settembre 2015. Accessed Feb. 8, 2017.
- Fong, DS, Aiello L, Gardner TW, et al. Retinopatia nel diabete. Diabetes Care 2004;27(Suppl 1):S84-S87.
- American Diabetes Association. Standards of Medical Care in Diabetes-2017. Diabetes Care 2017;40:(Suppl 1):S4-S5.
- Doggen K, Nobels F, Scheen AJ, et al. Cardiovascular risk factors and complications associated with albuminuria and impaired renal function in insulin-treated diabetes. J Diabetes Complications 2013;27:370-375.
- The Diabetes Control and Complications Trial Research Group. L’effetto del trattamento intensivo del diabete sullo sviluppo e la progressione delle complicazioni a lungo termine nel diabete mellito insulino-dipendente. N Engl J Med 1993;329:977-986.
- Action to Control Cardiovascular Risk in Diabetes Follow-On (ACCORDION) Eye Study Group e l’Action to Control Cardiovascular Risk in Diabetes Follow-On (ACCORDION) Study Group. Effetti persistenti del controllo glicemico intensivo sulla retinopatia nel diabete di tipo 2 nell’azione per controllare il rischio cardiovascolare nel diabete (ACCORD) studio follow-on. Diabetes Care 2016;39:1089-1100.
- ACCORD Study Group, ACCORD Eye Study Group, Chew EY, et al. Effetti delle terapie mediche sulla progressione della retinopatia nel diabete di tipo 2. N Engl J Med 2010;363:233-244.
- Chew EY, Davis MD, Danis RP, et al. Gli effetti della gestione medica sulla progressione della retinopatia diabetica in persone con diabete di tipo 2: L’azione per controllare il rischio cardiovascolare nel diabete (ACCORD) Eye Study. Oftalmologia 2014;121:2443-2451.
- Diabetes Control and Complications Trial Research Group. Effetto della gravidanza sulle complicazioni microvascolari nel Diabetes Control and Complications Trial. Diabetes Care 2000;23:1084-1091.
- Colberg SR, Sigal RJ, Yardley JE, et al. Physical activity/exercise and diabetes: Una dichiarazione di posizione dell’American Diabetes Association. Diabetes Care 2016;39:2065-2079.
- The Diabetic Retinopathy Study Research Group. Rapporto preliminare sugli effetti della terapia di fotocoagulazione. Am J Ophthalmol 1976;81:383-396.
- Early Treatment Diabetic Retinopathy Study Research Group. Fotocoagulazione per l’edema maculare diabetico: Early Treatment Diabetic Retinopathy Study report number 1. Arch Ophthalmol 1985;103:1796-1806.
- Nguyen QD, Brown DM, Marcus DM, et al. Ranibizumab per edema maculare diabetico: Risultati di 2 studi randomizzati di fase III: RISE e RIDE. Ophthalmology 2012;119:789-801.
- Wong TY, Cheung CMG, Larsen M, et al. Diabetic retinopathy. Nat Rev Disease Prim doi:10.1038/nrdp.2016.12; pubblicato online il 17 marzo 2016.
- Batuman V, Soman AS, Schmidt RJ, Soman SS. Nefropatia da diabete. Medscape Disponibile presso: http://emedicine.medscape.com/article/238946-overview. Aggiornato il 30 settembre 2016. Accessed Feb. 12, 2017.
- Tuttle KR, Bakris GL, Bilous RW, et al. Diabetic kidney disease: Un rapporto da una conferenza di consenso ADA. Diabetes Care 2014;37:2864-2883. https://doi.org/10.2337/dc14-1296
- Patel A, MacMahon S, Chalmers J, et al. Controllo intensivo della glicemia ed esiti vascolari in pazienti con diabete di tipo 2. N Engl J Med 2008;358:2560-2572.
- Duckworth W, Abraira C, Moritz T, et al. Controllo del glucosio e complicazioni vascolari nei veterani con diabete di tipo 2. N Engl J Med 2009;360:129-139.
- Ismail-Beigi F, Craven T, Banerji MA, et al. Effetto del trattamento intensivo di iperglicemia sugli esiti microvascolari nel diabete di tipo 2: Un’analisi dello studio randomizzato ACCORD. Lancet 2010;376:419-430.
- National Kidney Foundation. KDOQI linea guida di pratica clinica per il diabete e CKD: aggiornamento 2012. Am J Kidney Dis 2012;60:850-886.
- Fox CS, Matsushita K, Woodward M, et al. Chronic Kidney Disease Prognosis Consortium. Associazioni di misure di malattia renale con la mortalità e la malattia renale allo stadio finale in individui con e senza diabete: Una meta-analisi. Lancet 2012;380:1662-1673.
- Hahr AJ, Molitch ME. Gestione del diabete mellito in pazienti con malattia renale cronica. Clin Diabetes Endocrinol 2015. doi: 10.1186/s40842-015-0001-9.
- Alsaad KO, Herzenberg AM. Distinguere la nefropatia diabetica da altri casi di glomerulosclerosi: Un aggiornamento. J Clin Pathol 2007;60:18-26.
- Narva AS, Bilous RW. Valutazione di laboratorio della malattia renale diabetica. Diabetes Spectr 2015;28:162-166.
- Levey AS, Stevens LA, Schmid CH, et al. A new equation to estimate glomerular filtration rate. Ann Intern Med 2009;150:604-612.
- National Kidney Foundation. Linee guida di pratica clinica KDOQI per la malattia renale cronica: Valutazione, classificazione e stratificazione. Am J Kidney Dis 2002;39(2 Suppl 1):S1-S266.
- de Boer IH, Rue TC, Cleary PA, et al. Long-term renal outcomes of patients with type 1 diabetes mellitus and microalbuminuria: Un’analisi del Diabetes Control and Complications Trial/Epidemiology of Diabetes Interventions and Complications cohort. Arch Intern Med 2011;171:412-420.
- Wanner C, Inzucchi SE, Lachin JM, et al. Empagliflozin and progression of kidney disease in type 2 diabetes. N Engl J Med 2016;375:323-334.
- Heerspink HJL, Desai M, Jardine M, et al. Canagliflozin rallenta la progressione del declino della funzione renale indipendentemente dagli effetti glicemici. J Am Soc Nephrol 2016;28:1-8.
- Lexi-Drugs. Lexicomp. Wolters Kluwer Health, Inc. Riverwoods, IL. Disponibile presso: http://online.lexi.com. Accessed Oct. 31, 2016.
- Micromedex Solutions. Truven Health Analytics, Inc. Ann Arbor, MI. Disponibile a: http://www.micromedexsolutions.com. Accessed Oct. 31, 2016.
- James PA, Oparil S, Carter BL, et al. 2014 evidence-based guideline for the management of high blood pressure in adults. JAMA 2014;311:507-520.
- King P, Peacock I, Donnelly R. The United Kingdom Prospective Diabetes Study (UKPDS): Implicazioni cliniche e terapeutiche per il diabete di tipo 2. Br J Clin Pharmacol 1999;48:643-648.
- Jackevicius CA, Wong J, Aroustamian I, et al. Rates and predictors of ACE inhibitor discontinuation subsequent to elevated serum creatinine: Uno studio di coorte retrospettivo. BMJ Open 2014;4:e005181.
- Mauer M, Zinman B, Gardiner R, et al. Renal and retinal effects of enalapril and losartan in type 1 diabetes. N Engl J Med 2009;361:40-51.
- Bilous R, Chaturvedi N, Sjølie AK, et al. Effetto di candesartan su microalbuminuria e tasso di escrezione di albumina nel diabete: Tre studi randomizzati. Ann Intern Med 2009;151:11-20.
- Haller H, Ito S, Izzo JL Jr, et al. Olmesartan per il ritardo o la prevenzione della microalbuminuria nel diabete di tipo 2. N Engl J Med 2011;364:907-917.
- Makani H, Bangalore S, Desouza KA, et al. Efficacia e sicurezza del doppio blocco del sistema renina-angiotensina: Meta-analisi di studi randomizzati. BMJ 2013;346:f360.
- Miao Y, Ottenbros SA, Laverman GD, et al. Effetto di una riduzione dell’acido urico sugli esiti renali durante il trattamento con losartan: Un’analisi post-hoc della riduzione degli endpoint nel diabete mellito non insulino-dipendente con l’Angiotensina II Antagonista Losartan Trial. Hypertension 2011;58:2-7.
- Lewis EJ, Hunsicker LG, Clarke WR, et al. Renoprotective effect of the angiotensin-receptor antagonist irbesartan in patients with nephropathy due to type 2 diabetes. N Eng J Med 2001;354:851-860.
- Adler A, Casula A, Steenkamp R, et al. Associazione tra glicemia e mortalità nei soggetti diabetici in terapia sostitutiva renale nel Regno Unito. Diabetes Care 2014;37:1304-1311.
- Sharma SG, Bomback AS, Radhakrishnan J, et al. Lo spettro moderno di risultati biopsia renale in pazienti con diabete. Clin J Am Soc Nephrol 2013;8:1718-1724.
- Smart NA, Dieberg G, Ladhani M, Titus T. Riferimento precoce ai servizi specialistici di nefrologia per prevenire la progressione alla malattia renale allo stadio finale. Cochrane Database Syst Rev 2014;6:CD007333.
- Boulton AJM, Gries FA, Jervell JA. Linee guida per la diagnosi e la gestione ambulatoriale neuropatia periferica diabetica. Diabet Med 1998;15:508-514.
- O’Brien PD, Hinder LM, Sakowski SA, Feldman EL. Lo stress ER nella neuropatia periferica diabetica: Un nuovo bersaglio terapeutico. Antioxid Redox Signal 2014;21:621-633.
- Cameron NE, Cotter MA. Meccanismi pro-infiammatori nella neuropatia diabetica: Focus sul percorso del fattore nucleare kappa B. Curr Drug Targets 2008;9:60-67.
- Tesfaye S, Chaturvedi N, Eaton SE, et al. Fattori di rischio vascolare e neuropatia diabetica. N Engl J Med 2005;352:341-350.
- Wiggin TD, Sullivan KA, Pop-Busui R, et al. trigliceridi elevati correlati alla progressione della neuropatia diabetica. Diabete 2009;58:1634-1640.
- Stella P, Ellis D, Maser RE, Orchard TJ. Neuropatia autonomica cardiovascolare (rapporto di espirazione e ispirazione) nel diabete di tipo 1. Incidenza e predittori. J Diabetes Complications 2000;14:1-6.
- Witten DR, Tesfaye S, Chaturvedi N, et al. Risk factors for cardiac autonomic neuropathy in type 1 diabetes mellitus. Diabetologia 2005;48:164-171.
- Diabetes Control and Complication Trial (DCCT) Research Group. Effetto del trattamento intensivo del diabete sulla conduzione nervosa nel Diabetes Control and Complications Trial. Ann Neurol 1995;38:869-880.
- Diabetes Control and Complication Trial (DCCT) Research Group. L’effetto della terapia intensiva del diabete sulle misure della funzione del sistema nervoso autonomo nel Diabetes Control and Complications Trial (DCCT). Diabetologia 1998;41:416-423.
- Edwards JL, Vincent AM, Cheng HT, Feldman EL. Neuropatia diabetica: Meccanismi di gestione. Pharmacol Ther 2008;120:1-34.
- Vincent AM, Callaghan BC, Smith AL, Feldman EL. Neuropatia diabetica: Meccanismi cellulari un obiettivo terapeutico. Nat Rev Neurol 2011;7:573-583.
- Kellogg AP, Wiggin T, Larkin D, et al. Effetti protettivi dell’inattivazione del gene della cicloossigenasi-2 contro la disfunzione nervosa periferica e la perdita di fibre nervose intraepidermiche nel diabete sperimentale. Diabete 2007;56:2997-3005.
- Callaghan BC, Cheng HT, Stabili CL, et al. Neuropatia diabetica: Manifestazioni cliniche e trattamenti attuali. Lancet Neurol 2012;11:521-534.
- Boulton AJM, Kirsner RS, Vileikyte L. Pratica clinica: Ulcere neuropatiche del piede diabetico. N Eng J Med 2004;351:48-55.
- Boulton AJM, Vinik AI, Arezzo JC, et al. Diabetic neuropathies: Una dichiarazione dell’American Diabetes Association. Diabetes Care 2005;28:956-962.
- Boulton AJM, Armstrong DG, Albert SF, et al. Comprehensive foot examination and risk assessment: Un rapporto della task force del foot care interest group dell’American Diabetes Association, con l’approvazione dell’American Association of Clinical Endocrinologists. Diabetes Care 2008;31:1679-1685.
- Tesfaye S, Boulton AJ, Dyck PJ, et al. Neuropatie diabetiche: Aggiornamento su definizioni, criteri diagnostici, stima della gravità e trattamenti. Diabetes Care 2010;33:2285-2293.
- Dyke PJ, Albers JW, Andersen H, et al. Polineuropatie diabetiche: Aggiornamento sulla definizione di ricerca, criteri diagnostici e stima della gravità. Diabetes Metab Res Rev 2011;27:620-628.
- Freeman R. Non tutta la neuropatia è il diabete è di eziologia diabetica: Diagnosi differenziale della neuropatia diabetica. Curr Diabe Rep 2009;9:423-431.
- Balducci S, Iacobellis G, Parisi L, et al. Exercise training può modificare la storia naturale della neuropatia periferica diabetica. J Diabetes Complications 2006;20:216-223.
- Bril V, England J, Franklin GM, et al. Evidence-based guideline: Trattamento della neuropatia diabetica dolorosa. Rapporto dell’Accademia americana di neurologia, dell’Associazione americana di medicina neuromuscolare ed elettrodiagnostica e dell’Accademia americana di medicina fisica e riabilitazione. Neurology 2011;76:1758-1765.
- Dowell D, Haegerich TM, Chou R. CDC Guideline for prescribing opioids for chronic pain – United States 2016. MMWR Recomm Rep 2016;65:1-49.
- Tesfaye S, Wilhelm S, Lledo A, et al. Duloxetina e pregabalin: monoterapia ad alto dosaggio o la loro combinazione? Lo “studio COMBO-DN” – uno studio multinazionale, randomizzato, in doppio cieco, a gruppi paralleli in pazienti con dolore neuropatico periferico diabetico. Pain 2013;154:2616-2625.
- Ahn AC, Bennani T, Freeman R, et al. Due stili di agopuntura per il trattamento della neuropatia diabetica dolorosa – uno studio pilota di controllo randomizzato. Acupunct Med 2007;25:11-17.
- Garrow A, Xing M, Vere J, et al. Ruolo dell’agopuntura nella gestione della neuropatia diabetica dolorosa (DPN): Un RCT pilota. Acupunct Med 2014;32:242-249.
- Ziegler D, Nowak H, Kempler P, et al. Trattamento della polineuropatia diabetica sintomatica con l’antiossidante acido alfa-lipoico: Una meta-analisi. Diabet Med 2004;21:114-121.
- Ziegler D, Low PA, Litchy WJ, et al. Efficacia e sicurezza del trattamento antiossidante con acido alfa-lipoico oltre 4 anni nella polineuropatia diabetica: The NATHAN 1 trial. Diabetes Care 2011;34:2054-2060.
- Kuwabara S, Ogawara K, Harrori T, et al. Gli effetti acuti del controllo glicemico sulla eccitabilità assonale in nervi diabetici umani. Intern Med 2002;41:360-365.
- Peltier A, Goutman SA, Callaghan BC. Neuropatia diabetica dolorosa. BMJ 2014;348:g1799.
- Soykan I, Sivri B, Sarosiek I, et al. Demografia, caratteristiche cliniche, profili psicologici e di abuso, trattamento e follow-up a lungo termine dei pazienti con gastroparesi. Dig Dis Sci 1998;43:2398-2404.
- Camilleri M, Bharucha AE, Farrugia G. Epidemiologia, meccanismi e gestione della gastroparesi diabetica. Clin Gastroenterol Hepatol 2011;9:5-12.
- Shin AS, Camilleri M. Valutazione diagnostica della gastroparesi diabetica. Diabetes 2013;62:2667-2673.
- Hasler WL, Wilson L, Parkman HP, Lee L. Importanza del dolore addominale come sintomo nella gastroparesi: Relazione con fattori clinici, gravità della malattia, qualità della vita, ritenzione gastrica e uso di farmaci. Gastroenterology 2010;138. doi: 10.1016/S0016-5085(10)62131-2.
- Choung RS, Locke GR 3rd, Schleck CD, et al. Rischio di gastroparesi in soggetti con diabete tipo 1 e 2 nella popolazione generale. Am J Gastroenterol 2012;107:82-88.
- Maleki D, Locke GR III, Camilleri M, et al. Sintomi del tratto gastrointestinale tra le persone con diabete mellito nella comunità. Arch Intern Med 2000;160:2808-2816.
- Bytzer P, Talley NJ, Leemon M, et al. Prevalenza dei sintomi gastrointestinali associati al diabete mellito: Un sondaggio basato sulla popolazione di 15.000 adulti. Arch Intern Med 2001;161:1989-1996.
- Jones KL, Russo A, Berry MK, et al. A longitudinal study of gastric emptying and upper gastrointestinal symptoms in patients with diabetes mellitus. Am J Med 2002;113:449-455.
- Gaber AO, Hathaway DK, Abell T, et al. Una migliore funzione autonoma e gastrica nel trapianto pancreas-rene vs rene-unico contribuisce alla qualità della vita. Transplant Proc 1994;26:515-516.
- Punkkinen J, Färkkilä M, Mätzke S, et al. Sintomi addominali superiori in pazienti con diabete di tipo 1: Non correlato alla compromissione dello svuotamento gastrico causato dalla neuropatia autonomica. Diabet Med 2008;25:570-577.
- Schvarcz E, Palmer M, Aman J, et al. iperglicemia fisiologica rallenta lo svuotamento gastrico in soggetti normali e pazienti con diabete mellito insulino-dipendente. Gastroenterologia 1997;113:60-66.
- Miller G, Palmer KR, Smith B, et al. Il fumo ritarda lo svuotamento gastrico dei solidi. Gut 1989;30:50-53.
- Rao AS, Camilleri M. Articolo di revisione: Metoclopramide e discinesia tardiva. Aliment Pharmacol Ther 2010;31:11-19.
- Patterson D, Abell T, Rothstein R, et al. A double-blind multicenter comparison of domperidone and metoclopramide in the treatment of diabetic patients with symptoms of gastroparesis. Am J Gastroenterol 1999;94:1230-1234.
- Arts J, Holvoet L, Caenepeel P, et al. Studio clinico: Uno studio crossover randomizzato-controllato di iniezione intrapilorica di tossina botulinica nella gastroparesi. Aliment Pharmacol Ther 2007;26:1251-1258.
- Friedenberg FK, Palit A, Parkman HP, et al. Tossina botulinica A per il trattamento del ritardo dello svuotamento gastrico. Am J Gastroenterol 2008;103:416-423.
- Humanitarian Device Exemption for Enterra Device. Fed Reg 2000;65:78495-78496.
- O’Grady G, Egbuji JU, Du P, et al. Stimolazione elettrica gastrica ad alta frequenza per il trattamento della gastroparesi: Una meta-analisi. World J Surg 2009;33:1693-1701.
- Reddymasu SC, Sarosiek I, McCallum RW. Gastroparesi grave: Terapia medica o stimolazione elettrica gastrica. Clin Gastroenterol Hepatol 2010;8:117-124.
- McCallum RW, Dusing RW, Sarosiek I, et al. Meccanismi di miglioramento sintomatico dopo stimolazione elettrica gastrica in pazienti gastroparetici. Neurogastroenterol Motil 2010;22:161-167.
- Douloumpakas I, Pyrpasopoulou A, Triantafyllou A, et al. Prevalenza di disturbi muscoloscheletrici in pazienti con diabete mellito di tipo 2: Uno studio pilota. Hippokratia 2007;11:216-218.
- Rosenbloom AL, Silverstein JH, Lezotte DC. La mobilità articolare limitata nel diabete mellito infantile indica un aumento del rischio di malattia microvascolare. N Engl J Med 1981;305;191-194.
- Lister DM, Graham-Brown RAC, Burden AC. Risoluzione della cheiroartropatia diabetica. Br Med J 1986;293:1537.