La capacità di drenare completamente la cavità toracica, rompere le locazioni di liquido pleurico, visualizzare completamente tutti gli aspetti dello spazio pleurico ed evitare la morbilità di una toracotomia ha reso la toracoscopia interessante nella gestione dell’empiema e dell’emotorace.
Selezione del paziente
La capacità di drenare completamente la cavità toracica, rompere le locazioni di liquido pleurico, visualizzare completamente tutti gli aspetti dello spazio pleurico ed evitare la morbilità di una toracotomia ha reso la toracoscopia interessante nella gestione dell’empiema e dell’emotorace.
Tabella 1: Criteri di laboratorio per il drenaggio dell’empiema
Un’effusione che occupa più del 50% dell’emitorace o che è localizzata;
Una colorazione di Gram positiva o una coltura del liquido pleurico;
Un liquido pleurico purulento che ha un pH inferiore a 7.20 o un glucosio inferiore a 60,
Un livello di acido lattico deidrogenasi superiore a tre volte il limite superiore normale per il siero.
I pazienti che hanno dimostrato di avere un versamento pleurico infetto tramite toracentesi e che soddisfano i criteri di laboratorio per l’intervento sono candidati alla decorticazione toracoscopica.
Quando l’empiema è in fase essudativa o fibrinopurulenta ed è presente da circa 3 settimane di durata o meno, l’intervento toracoscopico ha solitamente successo (Video 1, Video 2 sotto). Quando l’empiema è presente da più di 3 settimane (fase organizzativa), la capacità di eseguire una decorticazione adeguata può essere più difficile a causa delle aderenze più dense e della presenza di una buccia viscerale polmonare aderente. I pazienti con un empiema essudativo o fibrinopurulento possono quasi sempre essere affrontati con la toracoscopia; la TAC non è utile nel prevedere i pazienti che richiederanno la toracotomia. La conversione alla toracotomia aperta viene eseguita quando necessario e non dovrebbe essere considerata un fallimento della toracoscopia, ma piuttosto un esercizio di giudizio chirurgico maturo. La toracoscopia è anche indicata quando la natura del processo pleurico non è diagnosticata, in quanto ciò consente una biopsia pleurica diretta che probabilmente farà la diagnosi evitando la morbilità di una toracotomia. Altre indicazioni per la decorticazione toracoscopica includono l’emotorace e il debridement mediastinico in pazienti con mediastinite discendente.
Toracotomia precedente, pleurodesi di talco precedente ed empiema precedente sono controindicazioni relative alla toracoscopia. L’incapacità di tollerare la ventilazione polmonare singola e la presenza di un fibrotorace sono controindicazioni alla decorticazione toracoscopica. I pazienti che sviluppano un empiema in seguito a perforazione esofagea non devono essere gestiti per via toracoscopica ma per toracotomia.
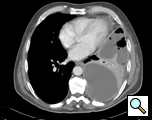
Figura 1: TAC che mostra un empiema
La TAC del torace fornisce informazioni sulla posizione, sul grado di localizzazione, sull’estensione dell’empiema e sul parenchima polmonare sottostante (Figura 1). Non è insolito che un organismo non venga identificato nella coltura del liquido pleurico e quindi una copertura antibiotica ad ampio spettro dovrebbe essere istituita quando viene fatta la diagnosi di empiema. Questo può essere modificato se i dati della coltura identificano un organismo. Gli antibiotici sono continuati per il periodo perioperatorio.
Si deve fare una valutazione dello stato nutrizionale del paziente e si inizia l’alimentazione supplementare se necessario. La broncoscopia deve essere eseguita prima della decorticazione per escludere l’ostruzione endobronchiale nella porzione di polmone che è intrappolata dall’empiema.
Passi operativi
L’anestesia generale viene istituita e l’isolamento del polmone viene realizzato utilizzando un tubo endotracheale a doppio lume o un tubo a lume singolo con un bloccante bronchiale. Questo permette l’espansione e il collasso del polmone come necessario durante la decorticazione. Il monitoraggio intra-operatorio comprende una linea di pressione arteriosa, un accesso endovenoso di grande diametro, un catetere Foley e la pulsossimetria. Il paziente è posizionato come per una toracotomia posterolaterale.

Figura 3. Radiografia toracica postoperatoria dopo decorticazione VATS, con tubi di drenaggio pleurico sinistro in posizione.

Figura 2b: Uso di un divaricatore per tenere aperta la porta di lavoro.
La porta della telecamera è posta nel 7° o 6° spazio intercostale nella linea della spina iliaca superiore anteriore o appena anteriore a questa. La decorticazione VATS e/o l’evacuazione dell’emotorace possono essere eseguite attraverso 2 o 3 porte. La porta di lavoro dovrebbe essere posizionata sopra il 5° spazio intercostale tra la linea ascellare media e anteriore. (Figura 2a) L’incisione intercostale deve consentire l’inserimento di 3 dita. Si usa un Weitlaner per ritrarre i tessuti molli (Figura 2b). Una terza porta può essere posta posteriormente, posizionata per permettere l’accesso alla parte anteriore della cavità pleurica.
Una volta che il torace è entrato, un’aspirazione Yankauer è usata per drenare il torace dal versamento o dal sangue (Video 3, Video 4 sotto) e insieme a un dito usato per rompere le loculazioni semplici (Video 5 sotto). La TAC preoperatoria aiuta a guidare questo drenaggio iniziale “cieco” e crea uno spazio pleurico di lavoro per gli strumenti toracoscopici. I depositi fibrinosi gelatinosi e i coaguli di sangue vengono rimossi con una pinza ad anello ricurva (Video 6, Video 7 sotto). La buccia pleurica viscerale può essere sbrigliata usando una pinza ad anello, una curette (Video 8 sotto) e un dissettore di arachidi come in una decorticazione aperta.
Una volta creato uno spazio pleurico, la rimozione del materiale fibrinoso viene eseguita sulla parte laterale della cavità pleurica partendo dall’apice del polmone e procedendo verso il diaframma o viceversa. La ventosa e la pinza ad anello sono usate insieme per rimuovere il materiale fibrinoso dalla cavità pleurica e la curette, la nocciolina e la pinza ad anello sono usate per sezionare la crosta del polmone. All’aspetto inferiore della cavità pleurica è utile identificare e separare il lobo inferiore del polmone dal diaframma (Video 9 sotto). Questo piano si sviluppa posteriormente e anteriormente permettendo al polmone di riempire il solco costodiaframmatico una volta che la decorticazione è completa. Successivamente, l’aspetto posteriore dello spazio pleurico viene sbrigliato e il polmone sottostante viene decorticato. L’esposizione è facilitata dal rotolamento anteriore del paziente. Infine, si sbriglia l’aspetto anteriore dello spazio pleurico e si libera il polmone da dove è aderente al mediastino. Questa esposizione è migliorata facendo rotolare il paziente posteriormente. A sinistra si deve fare attenzione a proteggere il nervo frenico.
La ventilazione intermittente del polmone è usata per valutare la completezza della decorticazione mentre la dissezione procede. Se non viene fatto un progresso adeguato o c’è un’espansione inadeguata del polmone per riempire il torace, allora dovrebbe essere eseguita la conversione alla decorticazione aperta. Si deve prestare particolare attenzione all’emostasi (Video 10, Video 11 sotto) sia sulla pleura parietale che su quella viscerale.
Una volta ottenuto un adeguato debridement, si esegue l’irrigazione e si visualizza l’espansione polmonare per garantire che la cavità pleurica sia riempita dal polmone (Video 12 sotto). I tubi toracici possono essere posizionati anteriormente e posteriormente per il drenaggio dell’aria e dei liquidi. Se c’è un piccolo spazio sopra il diaframma, un tubo ad angolo retto viene posizionato in questa posizione per assicurare il drenaggio e consentire una graduale espansione polmonare.
I tubi toracici vengono mantenuti in aspirazione per assicurarsi che ci sia una completa espansione polmonare e un adeguato drenaggio dello spazio pleurico (Figura 3). Quando il drenaggio è inferiore a 200cc/24 ore, i tubi possono essere rimossi. Per i pazienti con empiema, gli antibiotici per via endovenosa vengono continuati durante il decorso postoperatorio e per altri 14 giorni di antibiotici orali una volta che il paziente viene dimesso. Per i pazienti con emotorace, gli antibiotici vengono continuati nel postoperatorio per 48 ore.
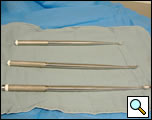
Figura 5. Curette lunghe da usare nella decorticazione VATS.

Figura 4b: Forcipe ad anello curvo aperto.
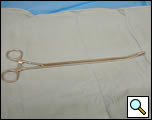
Figura 4a. Forcipe ad anello curvo chiuso (pannello sinistro) e aperto (pannello destro).
Carta delle preferenze
- 30 gradi Toracoscopio
- Morsetto ad anello curvo toracoscopico (Figure 4a, 4b)
- Succhiatore Yankauer
- Dissettore di arachidi
- Curette lunghe (Figura 5)
Consigli & Insidie
- Utilizzare una ventosa / dito / bastoncino di spugna tonsillare per creare “alla cieca” uno spazio di lavoro nella cavità pleurica.
- Controllare che il polmone si espanda fino a riempire adeguatamente il torace prima di lasciare la sala operatoria.
- Se non si è sicuri della progressione dell’operazione, del sanguinamento, delle dimensioni della perdita d’aria e della riespansione polmonare, procedere alla decorticazione aperta.
Risultati
La decorticazione toracoscopica è ormai collaudata nella gestione dell’empiema e il tempo trascorso dall’origine dell’empiema e l’intervento chirurgico è probabilmente più predittivo della capacità di eseguire l’operazione con successo. La TAC non è utile in questo senso, ma aiuta nel posizionamento della porta e nella direzione della decorticazione all’interno del torace. I principi della decorticazione aperta dovrebbero essere seguiti mentre si utilizza la tecnologia toracoscopica. Tutte le aree di materiale fibrinoso devono essere drenate e il polmone sottostante deve essere liberato da una buccia pleurica restrittiva per consentire una completa espansione. Le percentuali di successo sono elevate e la durata del tubo toracico, la durata della degenza, il dolore postoperatorio e il recupero sono migliori rispetto alla toracotomia. I tassi di mortalità sono bassi, così come i tassi di recidiva e le complicazioni. Le conversioni alla toracotomia aperta sono più frequenti che dopo altre procedure toracoscopiche, ma questo dovrebbe essere considerato un esercizio di sano giudizio chirurgico piuttosto che un fallimento della tecnica.
La decorticazione toracoscopica estende la versatilità del chirurgo toracico nella sua gestione delle infezioni dello spazio pleurico e può essere utilizzata per la diagnosi e il trattamento delle stesse con risultati eccellenti.
Video 1
Video 2
Video 3
Video 4
Video 5
Video 6
Video 7
Video 8
Video 9
Video 10
Video 11
Video 12
- Luce RW. Versamenti parapneumonici ed empiema. Proc Am Thorac Soc 2006;3:75-80.
- Cassina PC et al. Toracoscopia video-assistita nel trattamento dell’empiema pleurico: gestione basata sullo stadio e risultati. J Thorac Cardiovasc Surg 1999;117:234-8.
- Lardinois D et al. Il rinvio tardivo e gli organismi gram-negativi aumentano il tasso di conversione della toracotomia nei pazienti sottoposti a chirurgia toracoscopica video-assistita per empiema. Ann Thorac Surg 2005;79:1851-6.
- Roberts JR. Chirurgia mininvasiva nel trattamento dell’empiema: processo decisionale intraoperatorio. Ann Thorac Surg 2003;76:225-30.
- Navsaria PH, Vogel RJ, Nicol AJ. Evacuazione toracoscopica dell’emotorace post-traumatico trattenuto. Ann Thorac Surg 2004;78:282-6.
- Shimizu K, et al. Drenaggio mediastinoscopico video-assistito di successo della mediastinite necrotizzante discendente. Ann Thorac Surg 2006;81:2279-81.
- Hope WW, Bolton WD, Stephenson JE. L’utilità e la tempistica dell’intervento chirurgico per l’empiema parapneumonico nell’era della toracoscopia video-assistita. Am Surg 2005;71:512-4.
- Luh SP, et al. Chirurgia toracoscopica video-assistita nel trattamento di versamenti parapneumonici complicati o empiemi: risultato di 234 pazienti. Chest 2005;127:1427-32.
- Wurnig PN, et al. Chirurgia toracica video-assistita per empiema pleurico. Ann Thorac Surg 2006;81:309-13.