La mia ipotesi qui è che tu abbia già la formula empirica dell’acido tartarico, e che tu debba trovare la sua formula molecolare usando la sua massa molare.
Assumendo che il punto di partenza qui sia la formula empirica dell’acido tartarico appare così
#”C”_2 “H”_3 “O”_3 -># formula empirica
Ora, la formula empirica di un composto ti dice il più piccolo rapporto di numeri interi che esiste tra gli atomi dei suoi elementi costituenti.
In questo caso, sai che la formula molecolare, che ti dice il numero esatto di atomi che compongono una molecola di detto composto, conterrà
#color(black)(“2 atomi di C” color(red)(” per ogni “) {(“3 atomi di H”),(“3 atomi di O”) :}#
In sostanza, stai cercando un multiplo della formula empirica.
Si dice che l’acido tartarico ha una massa molare di #”150 g mol”^(-1)#. Il tuo obiettivo qui sarà quello di determinare la massa molare della sua formula empirica, quindi utilizzare questo valore per determinare la formula molecolare del composto.
In questo caso, si avrà
#2 xx “12.011 g mol”^(-1) ” “color(blue)(+)#
#3 xx “1.00794 g mol”^(-1)#
#3 xx “15.9994 g mol”^(-1)#
#color(white)(aaaaaaaaaaaaaaaaaa)/color(white)(aaaaaaaaaaaaaaaaa)#
#”75.044 g mol”^(-1) -> #la massa molare della formula empirica
Quindi, se la formula empirica ha una massa molare di #”75.044 g mol”^(-1)#, e la massa molare dell’acido tartarico è #”150 g mol”^(-1)#, ne segue che dovrete moltiplicare la formula empirica per
#(150 color(red)(cancel(color(black)(“g mol”^(-1)))))/(75.044color(red)(cancel(color(black)(“g mol”^(-1))))) = 1,999 ~~ color(red)(2)#
per ottenere la formula molecolare. Questo significa che la formula molecolare dell’acido tartarico sarà
#(“C”_2 “H”_3 “O”_3)_color(red)(2) implica color(green)(|bar(ul(color(white)(a/a) “C”_4 “H”_6 “O”_6color(white)(a/a)|))#
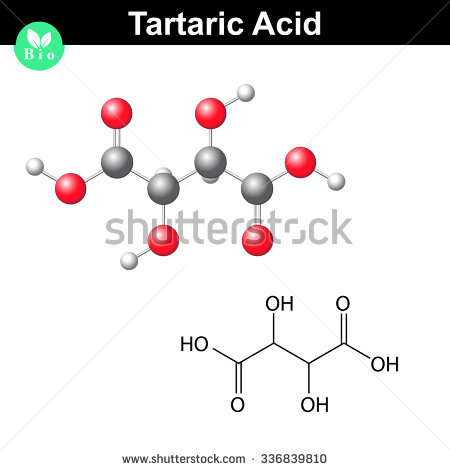
Ecco come appare una molecola di acido tartarico