Volvaaniset (galvaaniset) kennot
Galvaanisen kennon perusperiaatteiden havainnollistamiseksi tarkastellaan metallisen sinkin reaktiota kupari-ionin (Cu2+) kanssa kuparimetallin ja Zn2+-ionin muodostamiseksi. Tasapainotettu kemiallinen yhtälö on seuraava:
\
Voidaan saada tämä reaktio tapahtumaan asettamalla sinkkitanko kupari(II)sulfaatin vesiliuokseen. Reaktion edetessä sinkkitanko liukenee ja muodostuu metallisen kuparin massaa. Nämä muutokset tapahtuvat spontaanisti, mutta kaikki vapautuva energia on pikemminkin lämmön muodossa kuin muodossa, jota voidaan käyttää työn tekemiseen.
Tämä sama reaktio voidaan toteuttaa kuvassa \(\PageIndex{3a}\) esitetyn galvaanisen kennon avulla. Kennon kokoamiseksi kupariliuska asetetaan dekantterilasiin, joka sisältää 1 M Cu2+ -ioniliuosta, ja sinkkiliuska asetetaan toiseen dekantterilasiin, joka sisältää 1 M Zn2+ -ioniliuosta. Nämä kaksi elektrodina toimivaa metalliliuskaa on yhdistetty toisiinsa langalla, ja lokerot on yhdistetty toisiinsa suolasillalla, joka on molempiin liuoksiin työnnetty U-muotoinen putki, joka sisältää väkevää nestemäistä tai geelimäistä elektrolyyttiä. Suolasillan ionit valitaan siten, että ne eivät häiritse sähkökemiallista reaktiota hapettumalla tai pelkistymällä itse tai muodostamalla saostumia tai komplekseja; yleisesti käytettyjä kationeja ja anioneja ovat Na+ tai K+ ja NO3- tai SO42-. (Suolasillassa olevien ionien ei tarvitse olla samoja kuin redox-parin ionien kummassakaan osastossa). Kun virtapiiri suljetaan, tapahtuu spontaani reaktio: sinkkimetalli hapettuu Zn2+ -ioneiksi sinkkielektrodilla (anodi) ja Cu2+ -ionit pelkistyvät Cu-metalliksi kuparielektrodilla (katodi). Reaktion edetessä sinkkiliuska liukenee ja Zn2+ -ionien pitoisuus Zn2+ -liuoksessa kasvaa; samanaikaisesti kupariliuska kasvattaa massaa ja Cu2+ -ionien pitoisuus Cu2+ -liuoksessa pienenee (kuva \(\PageIndex{3b}\)). Olemme siis toteuttaneet saman reaktion kuin yhden dekantterilasin avulla, mutta tällä kertaa hapettava ja pelkistävä puolireaktio on erotettu toisistaan fyysisesti. Anodilla vapautuvat elektronit virtaavat johtimen läpi tuottaen sähkövirran. Galvaaniset kennot siis muuttavat kemiallisen energian sähköenergiaksi, jota voidaan käyttää työn tekemiseen.
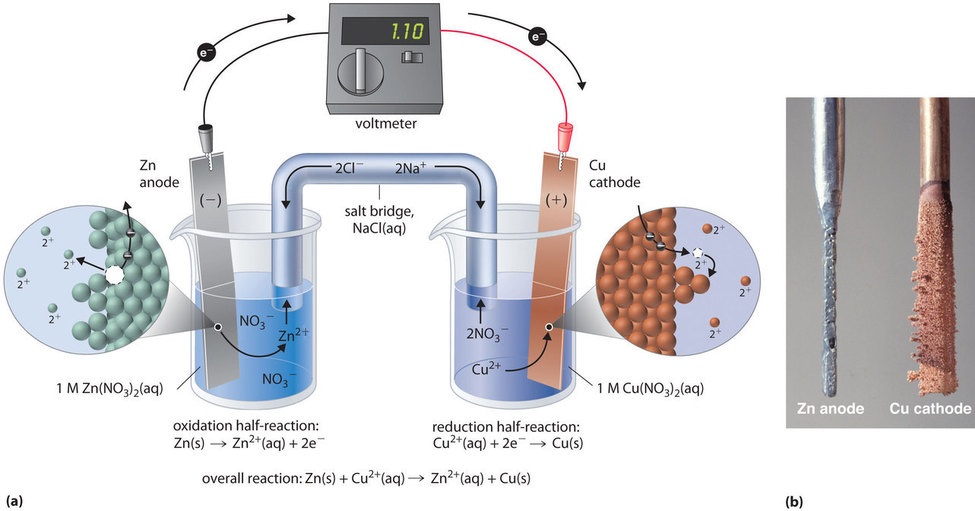
Suolasillan elektrolyytti palvelee kahta tarkoitusta: se täydentää virtapiiriä kuljettamalla sähkövarausta ja ylläpitää sähköistä neutraaliutta kummassakin liuoksessa sallimalla ionien kulkeutumisen liuosten välillä. Suolasillan suolan identiteetillä ei ole merkitystä, kunhan komponentti-ionit eivät reagoi tai käy läpi redox-reaktiota kennon käyttöolosuhteissa. Ilman tällaista yhteyttä Zn2+ -liuoksen positiivinen kokonaisvaraus kasvaisi, kun sinkkimetalli liukenee, ja Cu2+ -liuoksen positiivinen kokonaisvaraus pienenisi. Suolasillan avulla varaukset voidaan neutraloida virtaamalla anioneja Zn2+ -liuokseen ja kationeja Cu2+ -liuokseen. Ilman suolasiltaa tai muuta vastaavaa yhteyttä reaktio loppuisi nopeasti, koska sähköistä neutraaliutta ei pystyttäisi ylläpitämään.
Voltometrillä voidaan mitata sähköisen potentiaalin ero kahden osaston välillä. Anodin ja katodin johdot yhdistävän kytkimen avaaminen estää virran kulun, joten kemiallista reaktiota ei tapahdu. Kun kytkin on kiinni, ulkoinen virtapiiri on kuitenkin suljettu, ja sähkövirta voi virrata anodilta katodille. Kennon potentiaali (\(E_{cell}\)), joka mitataan voltteina, on kahden puolireaktion välinen sähköpotentiaaliero, ja se liittyy energiaan, joka tarvitaan varautuneen hiukkasen siirtämiseen sähkökentässä. Kuvaamassamme kennossa volttimittari näyttää 1,10 V:n potentiaalia (kuva \(\PageIndex{3a}\)). Koska hapetuspuolireaktion elektronit vapautuvat anodilla, galvaanisen kennon anodi on negatiivisesti varautunut. Katodi, joka vetää elektroneja puoleensa, on positiivisesti varautunut.
Eivät kaikki elektrodit käy läpi kemiallista muutosta redox-reaktion aikana. Elektrodi voidaan valmistaa inertistä, hyvin johtavasta metallista, kuten platinasta, jotta se ei reagoi redox-prosessin aikana, jolloin se ei esiinny sähkökemiallisessa kokonaisreaktiossa. Tätä ilmiötä havainnollistetaan esimerkissä \(\PageIndex{1}\).
Galvaaninen (voltainen) kenno muuntaa spontaanissa kemiallisessa reaktiossa vapautuvan energian sähköenergiaksi. Elektrolyyttinen kenno kuluttaa ulkoisesta lähteestä saatavaa sähköenergiaa ei-spontaanin kemiallisen reaktion käynnistämiseksi.
Esimerkki \(\PageIndex{1}\)
Kemisti on rakentanut kahdesta dekantterilasista koostuvan galvaanisen kennon. Toinen dekantterilasi sisältää tinalevyn, joka on upotettu vesipitoiseen rikkihappoon, ja toinen sisältää platinaelektrodin, joka on upotettu vesipitoiseen typpihappoon. Nämä kaksi liuosta on yhdistetty toisiinsa suolasillalla, ja elektrodit on yhdistetty toisiinsa langalla. Virta alkaa kulkea, ja platinaelektrodiin ilmestyy kaasukuplia. Tapahtuvaa spontaania redox-reaktiota kuvataan seuraavalla tasapainotetulla kemiallisella yhtälöllä:
\
Kirjoita tälle galvaaniselle kennolle,
- kirjoita puolireaktio, joka tapahtuu kummallakin elektrodilla.
- merkitse, kumpi elektrodi on katodi ja kumpi on anodi.
- ilmoita, kumpi elektrodi on positiivinen elektrodi ja kumpi negatiivinen elektrodi.
Annetaan: galvaaninen kenno ja redox-reaktio
Kysytään: puolireaktiot, anodin ja katodin identiteetti ja elektrodin määrittäminen positiiviseksi tai negatiiviseksi
Strategia:
- Tunnistetaan hapettumis- ja pelkistymispuolireaktiopuolireaktio. Tunnista sitten anodi ja katodi kullakin elektrodilla tapahtuvasta puolireaktiosta.
- Luokittele elektronivirran suunnan perusteella kukin elektrodi joko positiiviseksi tai negatiiviseksi.
Liuos
A Pelkistymis-puolireaktiossa nitraatti pelkistyy typpioksidiksi. (Typpioksidi reagoi sitten ilman hapen kanssa muodostaen NO2:ta, jolla on sille ominainen punaruskea väri). Hapetuspuolireaktiossa metallinen tina hapettuu. Systeemissä tapahtuvia todellisia reaktioita vastaavat puolireaktiot ovat seuraavat:
reduktio: \
hapettuminen: \
Tällöin nitraatti pelkistyy NO:ksi, kun taas tinaelektrodi hapettuu Sn2+:ksi.
Koska pelkistysreaktio tapahtuu Pt-elektrodilla, se on katodi. Sitä vastoin hapettumisreaktio tapahtuu tinaelektrodilla, joten se on anodi.
B Elektronit virtaavat tinaelektrodilta langan läpi platinaelektrodille, jossa ne siirtyvät nitraattiin. Sähköpiirin täydentää suolasilta, joka sallii kationien diffuusion kohti katodia ja anionien diffuusion kohti anodia. Koska elektronit virtaavat tinaelektrodista, sen on oltava sähköisesti negatiivinen. Sitä vastoin elektronit virtaavat kohti Pt-elektrodia, joten tämän elektrodin on oltava sähköisesti positiivinen.
Harjoitus \(\PageIndex{1}\)
Harkitaan yksinkertaista galvaanista kennoa, joka koostuu kahdesta suolasillalla yhdistetystä dekantterilasista. Toinen dekantterilasi sisältää \(\ce{MnO_4^{-}}\) liuosta laimeassa rikkihapossa ja siinä on Pt-elektrodi. Toinen dekantterilasi sisältää \(\ce{Sn^{2+}}\) liuosta laimeassa rikkihapossa, ja siinä on myös Pt-elektrodi. Kun nämä kaksi elektrodia yhdistetään johdolla, virtaa virtaa ja tapahtuu spontaani reaktio, jota kuvaa seuraava tasapainotettu kemiallinen yhtälö:
\\
Kirjoita tälle galvaaniselle kennolle,
- kirjoita kummallakin elektrodilla tapahtuva puolireaktio.
- merkitse, kumpi elektrodi on katodi ja kumpi anodi.
- merkitse, kumpi elektrodi on positiivinen ja kumpi negatiivinen.
Vastaa a
\ \ce{Sn^{2+}(aq)} &→ \ce{Sn^{4+}(aq) + 2e^{-}} \end{align*}\]
Vastaus b
Permanganaattiliuoksessa oleva Pt-elektrodi on katodi; tinaliuoksessa oleva elektrodi on anodi.
Vastaus c
Katodi (elektrodi juomalasissa, joka sisältää permanganaattiliuoksen) on positiivinen ja anodi (elektrodi juomalasissa, joka sisältää tinaliuoksen) on negatiivinen.