Diabetes mellitus on kallis, mutta suurin osa kustannuksista aiheutuu komplikaatioista ja sairaalahoidosta.1 American Diabetes Associationin (ADA) mukaan vuonna 2012 diabeteksen arvioidut kokonaiskustannukset olivat 245 miljardia dollaria.1 Arviolta 43 % aiheutui sairaalahoidon sairaalakuluista ja toiset 18 % diabeteksen komplikaatioiden hoitoon tarkoitetuista lääkemääräyksistä.1
Vähemmistö näistä komplikaatioista voidaan ehkäistä kohdennetulla glukoosinhallinnalla. Epidemiologiset tiedot osoittavat, että jokaista hemoglobiini A1c:n (HbA1c) prosenttiyksikön laskua kohden mikrovaskulaaristen komplikaatioiden riski pienenee 35 prosenttia.2 Hyvä uutinen on, että diabeteksen komplikaatioluvut ovat pienentyneet,3 mutta tämän on ohittanut komplikaatioita sairastavien diabeetikoiden määrän lisääntyminen.
Monilla tyypin 2 diabetesta sairastavilla voi olla diabetekseen liittyvä komplikaatio diagnoosin toteamishetkellä. Sekä tyypin 1 että tyypin 2 diabeteksessa osa komplikaatioista, kuten retinopatia ja nefropatia, on hiljaisia. Tämä edellyttää aggressiivista kohdennettua lähestymistapaa, koska oireiden odottaminen on liian myöhäistä. Jopa diabeettinen neuropatia on oireeton jopa 50 prosentilla ihmisistä, joilla on mitattavissa olevia poikkeavuuksia.4
Tässä artikkelissa käydään läpi ADA:n vuoden 2017 hoitostandardien suositukset mikrovaskulaaristen komplikaatioiden osalta ja asiaankuuluvat kannanotot sekä tuodaan esiin ennaltaehkäisevää seulontaa ja kliinisiä helmiä diabetesta sairastavia potilaita hoitavalle perusterveydenhuoltolääkärille.
- Diabeettinen retinopatia
- Taulukko 1. Diabeettinen retinopatia. Retinopatian vaiheet kuvauksineen
- Kliiniset helmet
- Diabetes munuaissairaus
- Taulukko 2. Select Landmark Studies Demonstrating Glycemic Control with A1c below 7%
- Taulukko 3. Albuminuria. Arvioitu GFR vaiheen ja kuvauksen mukaan
- TAULUKKO 4. Albuminurian luokat CKD:ssä
- Kuva 1. Ehdotettu arviointitiheys (määrä kertoja vuodessa) eGFR- ja albumiiniuria-luokittain
- Taulukko 5. Diabeettisen glomerulaarisairauden syy. Punaiset liput, jotka viittaavat muuhun kuin diabeettiseen glomerulaaritautiin
- Taulukko 6. Glukoosia alentavien aineiden annossäädöt ja suositukset munuaisten vajaatoimintapotilailla
- luokka
- Lääkitys
- Kliiniset helmet
- Diabeettinen perifeerinen neuropatia
- Taulukko 7. Neuropatian syyt. Muut neuropatian syyt67
- Taulukko 8. DPN:n hoito. Yleisesti käytetyt farmakologiset aineet DPN:n hoidossa4,69
- Kliiniset helmet
- Gastropareesi
- Kliiniset helmet
- Diabeettinen cheiroartropatia
- Johtopäätös
Diabeettinen retinopatia
Diabeettinen retinopatia on tyypin 1 ja tyypin 2 diabeteksen tavallinen mikrovaskulaarinen komplikaatio. Arviolta 3,7 miljoonaa ihmistä maailmassa on diabeettisen retinopatian vuoksi kohtalaisesti tai vaikeasti näkövammaisia, ja yli 800 000 ihmistä maailmassa on sokeutunut diabeettisen retinopatian vuoksi.5 Diabeettinen retinopatia on yleisin uuden sokeutumisen syy 20-74-vuotiailla aikuisilla.6 Diabeettisen retinopatian on todettu korreloivan vahvasti sokeripitoisuuden hallinnan, verenpaineen hallinnan ja sairauden keston kanssa. Varhaisella, säännöllisellä seulonnalla ja näiden riskitekijöiden kontrolloinnilla diabeettinen retinopatia voidaan havaita ja hoitaa näön heikkenemisen ehkäisemiseksi.
Diabeteksen kesto on suurin diabeettisen retinopatian etenemisen riskitekijä. Tyypin 1 diabeteksessa retinopatia on harvinaista ensimmäisten 3-5 vuoden aikana tai ennen murrosikää.7 Seuraavien 20 vuoden aikana lähes kaikille tyypin 1 diabetesta sairastaville potilaille kehittyy diabeettinen retinopatia.7 Tyypin 2 diabetesta sairastavilla potilailla jopa 21 %:lla on diagnoosin tekohetkellä jonkinasteinen retinopatia.7 Krooninen hyperglykemia, nefropatia, verenpainetauti ja dyslipidemia ovat muita tekijöitä, jotka lisäävät diabeettisen retinopatian riskiä tai ovat yhteydessä diabeettiseen retinopatiaan.8 Jopa 50 %:lla potilaista, joilla on albuminuria (arvioituun glomerulussuodatusnopeuden tasoon katsomatta), esiintyy retinopatiaa.9 Taulukossa 1 on kuvattu verkkokalvon retinopatian eri vaiheet.
Taulukko 1. Diabeettinen retinopatia. Retinopatian vaiheet kuvauksineen |
|
|
Vaihe |
Kuvaus |
|
Lievä Non-Proliferatiivinen diabeettinen retinopatia |
Mikroaneurysmoja esiintyy |
|
Keskivaikea ei-proliferatiivinen diabeettinen retinopatia |
Mikroaneurysmoja, Verkkokalvon piste- tai täpläverenvuodot, kovat eksudaatit, tai vanupilkkuja voi esiintyä |
|
Vaikea ei-proliferatiivinen diabeettinen retinopatia |
Verkkokalvon sisäisiä verenvuotoja, laskimoiden helmiä, tai verkkokalvon sisäisiä mikrovaskulaarisia poikkeavuuksia voi esiintyä |
|
Proliferatiivinen diabeettinen retinopatia |
Neovaskularisaatio, lasiaisen tai silmän verkkokalvoa edeltävien verisuonten verenvuotoja voi esiintyä |
Patofysiologia. Lievät, ei-proliferatiiviset poikkeavuudet, joille on ominaista lisääntynyt verisuonten läpäisevyys, voivat edetä keskivaikeaksi tai vaikeaksi ei-proliferatiiviseksi diabeettiseksi retinopatiaksi (nonproliferative diabetic retinopathy, NPDR).7 Proliferatiiviselle diabeettiselle retinopatialle on ominaista uusien verkkokalvon verisuonten lisääntyminen.7 Makulaturvotusta, joka on verkkokalvon keskeistä paksuuntumista, johon liittyy eksudaatiota ja turvotusta, voi esiintyä missä tahansa retinopatian vaiheessa.7 Diabeettista retinopatiaa voivat kiihdyttää raskaus, murrosikä, glykeemisen kontrollin puute, verenpainetauti ja kaihileikkaus.7
Diabeettisen retinopatian ehkäiseminen. Glykeeminen kontrolli on avainasemassa diabeettisen retinopatian ehkäisyssä. Diabetes Control and Complications Trial (DCCT) -tutkimuksessa tutkijat arvioivat tiukan glykeemisen kontrollin vaikutusta ja etenemistä siitä, että lähtötilanteessa ei ollut retinopatiaa tai retinopatia oli minimaalinen, kohtalaiseksi NPDR:ksi.10 Intensiivisen hoidon ryhmään kuuluvilla potilailla, joilla ei ollut retinopatiaa lähtötilanteessa, retinopatian keskimääräinen riski pieneni 76 % 36 kuukauden aikana.10 Tehohoitoryhmän potilailla, joilla oli jo vähäistä tai kohtalaista NPDR:ää, etenemisriski pieneni 54 prosenttia tavanomaista hoitoa saaneisiin verrattuna.10 Alkuperäisessä Action to Control Cardiovascular Risk in Diabetes (ACCORD) -tutkimuksessa osallistujat, joilla oli ollut tyypin 2 diabetes jo 10 vuotta ja joilla oli tiedossa oleva sydän- ja verisuonitauti, satunnaistettiin intensiiviseen tai tavanomaiseen hoitoon glykemian, systolisen verenpaineen ja dyslipidemian osalta. Neljä vuotta myöhemmin retinopatian eteneminen väheni niillä, joilla oli aiemmin intensiivinen glykemiaohjaus, riippumatta samankaltaisista nykyisistä HbA1c-tasoista.11 Vastaavia perinnöllisyysvaikutuksia ei havaittu niissä ryhmissä, joilla oli intensiivinen verenpaineen ohjaus tai jotka saivat fenofibraattia dyslipidemian hoitoon.11
Seulonta. Koska makulaturvotus ja proliferatiivinen diabeettinen retinopatia voivat olla oireettomia, seulonta on elintärkeää varhaisen toteamisen ja hoidon kannalta. Tyypin 1 diabetesta sairastavien potilaiden seulonta olisi aloitettava viiden vuoden kuluttua diagnoosista.8 Tyypin 2 diabetesta sairastavien potilaiden seulonta olisi aloitettava diagnoosin yhteydessä.8 Seulonta olisi suoritettava diabeettiseen retinopatiaan perehtyneen silmälääkärin tai optikon toimesta. Seulonta olisi suoritettava silmät laajentuneina. Jos retinopatiaa on jo olemassa, suositellaan lähetteen antamista silmälääkärille.8 Uusinta-arviointi olisi tehtävä vuosittain, jos tautia on todettu minimaalisesti tai sitä ei ole todettu.8
Raskaus on proliferatiivisen retinopatian riskialtista aikaa. Raskaana oleville naisille, joilla on ennestään tyypin 1 tai tyypin 2 diabetes, silmätutkimukset olisi tehtävä ennen hedelmöittymistä tai ensimmäisen raskauskolmanneksen aikana. Tutkimukset on toistettava jokaisella raskauskolmanneksella ja vuoden ajan synnytyksen jälkeen.8 Raskausdiabetesta sairastaville ei tarvita ylimääräisiä silmätutkimuksia synnytyksen jälkeen.
Raskaus voi johtaa diabeettisen retinopatian nopeaan etenemiseen potilailla, joilla on ennestään tyypin 1 tai tyypin 2 diabetes. Tämä pätee erityisesti, jos glykeeminen kontrolli on huono hedelmöityshetkellä.14 Raskaana oleville tai raskautta suunnitteleville diabetesta sairastaville naisille on kerrottava diabeettisen retinopatian kehittymisen tai etenemisen riskistä ja glykeemisen kontrollin tarpeesta ennen hedelmöityshetkeä.8 Retinopatian varhainen paheneminen voi kuitenkin tapahtua intensiivisen glykeemisen hoidon nopealla toteuttamisella, jos retinopatiaa on jo olemassa.8 Raskausdiabetes ei näytä aiheuttavan samanlaista riskiä sairastua diabeettiseen retinopatiaan raskauden aikana.8
Hoito. Glykeemisen kontrollin lisäksi myös verenpaineen kontrollin (< 140 mmHg systolinen) on osoitettu vähentävän diabeettisen retinopatian etenemistä, mutta systolisen verenpaineen < 120 mmHg tiukasta valvonnasta ei ole lisähyötyä.12 Fenofibraatti voi myös hidastaa diabeettisen retinopatian etenemistä, erityisesti hyvin lievässä NPDR:ssä, potilailla, joilla on dyslipidemia.13 Aspiriinilla ei osoitettu olevan vaikutusta retinopatian etenemiseen, lasiaisverenvuodon kehittymiseen tai lasiaisverenvuodon kestoon, ja sitä voidaan käyttää turvallisesti muissa lääketieteellisissä indikaatioissa ilman, että se vaarantaa silmän toimintaa.7
Diabetesta sairastavien potilaiden hoitoon tulisi sisältyä liikuntasuosituksia. Ne, joilla on lievä ei-proliferatiivinen retinopatia, voivat aloittaa liikunnan turvallisesti. Potilaiden, joilla on keskivaikea nonproliferatiivinen retinopatia, tulisi kuitenkin välttää toimintoja, jotka nostavat huomattavasti verenpainetta, kuten voimanostoa.15 Potilaiden, joilla on vaikea nonproliferatiivinen tai epästabiili retinopatia, tulisi välttää kaikenlaista voimakasta liikuntaa (hyppimistä, tärähdyksiä), kaikkia pää alaspäin suuntautuvia toimintoja ja hengityksen pidättelyä.15 Lasiaisverenvuodon sattuessa liikuntaa ei tulisi harrastaa.15
Diabeettisen retinopatian varhainen havaitseminen on tärkeätä siksi, että hoidon avulla voidaan ehkäistä tai peruuttaa näön menetys. Diabeettista retinopatiaa koskevassa tutkimuksessa (Diabetic Retinopathy Study, DRS) tutkijat havaitsivat, että fotokoagulaatiokirurgia oli tehokas diabeettisen retinopatian hoito. Varhaisen hoidon diabeettista retinopatiaa koskevassa tutkimuksessa ja DRS:ssä osoitettiin, että fotokoagulaatio vähensi näön heikkenemisen riskiä, ja suurin hyöty oli potilailla, joilla oli pidemmälle edennyt perussairaus.16,17 Nykyiset tiedot antavat näyttöä siitä, että intravitreaaliset verisuonten endoteelin kasvutekijän vastaiset (anti-VEGF) aineet ovat tehokkaampia makulaturvotuksen hoidossa kuin monoterapia tai yhdistelmähoito laserkoagulaatiohoitoa käyttäen.8 Lisäksi anti-VEGF-tabletit voivat parantaa näönkuntoa, kun taas fotokoagulaatiohoito vain ehkäisee näön heikkenemistä entisestään18,19. Yksi anti-VEGF:n haittapuoli on se, että se vaatii kuukausittaista intravitreaalista hoitoa ensimmäisten 12 kuukauden aikana.
Kliiniset helmet
- Vaikaisen diabeettisen retinopatian varhaisvaiheen merkkejä tai oireita ei ole.
- Diabeettisen retinopatian seulontaa tulisi tehdä potilailla:
– joilla on diabeteksen diagnoosin toteamisen jälkeiset viisi vuotta tyypin 1 diabeteksen sairastamisen jälkeen.
- Neuvontaa ja lisääntyneitä tutkimuksia tulisi tarjota diabeetikoille, jotka suunnittelevat raskautta tai tulevat raskaaksi, koska diabeettinen retinopatia voi kiihtyä nopeasti raskauden aikana.
- Tiheällä glykeemisen kontrollilla ja verenpaineen kontrolloinnilla (< 140 mmHg:n systolinen arvo) voidaan ehkäistä diabeettisen retinopatian kehittymistä.
- Jopa 50 %:lla potilaista, joilla on albuminuria (eGFR:n tasosta riippumatta), on verkkokalvon verkkokalvon verkkokalvon verkkokalvon verkkokalvon verkkokalvon verkkokalvon verkkokalvon verkkokalvon verkkokalvon verkkokalvon verkkokalvon verkkokalvon verkkokalvon verkkokalvon verkkokalvon.
- Fotokoagulaatiohoito voi estää taudin etenemisen, ja anti-VEGF-hoito voi kääntää makulaturvotuksen aiheuttaman näön menetyksen.
Diabetes munuaissairaus
Diabetes munuaissairaus (DKD), ADA:n suosima terminologia, on johtava kroonisen munuaissairauden (CKD, Chronical Kidney Disease) aiheuttaja Yhdysvalloissa.20,21,21 DKD:llä on merkittäviä pitkäaikaisia vaikutuksia diabetesta sairastavien potilaiden elämänlaatuun, ja se aiheuttaa jopa 40 prosenttia loppuvaiheen munuaistaudeista (ESRD).20 Kansallisen munuaissäätiön Kidney Disease Outcomes Quality Initiative (KDOQI) -aloitteen ja ADA:n vuoden 2017 hoitostandardien perusteella tässä osiossa annetaan ohjeita DKD-potilaiden HbA1c:n tavoitetasoista, lääkehoidosta ja terapeuttisesta hoidosta.
KDOQI:ssä HbA1c:n tavoitetasot kerrostetaan potilaan hypoglykemian ja liitännäissairauksien riskin mukaan. Tämä aloite perustuu kolmeen julkaisuun, jotka osoittavat, että glykeeminen kontrolli, jossa HbA1c on alle 7 %, ehkäisee tai vähentää munuaissairauden etenemistä tyypin 2 diabetesta sairastavilla potilailla.22,23,24 Näistä tutkimuksista on yhteenveto taulukossa 2. ADA suosittelee, että potilailla, joilla on suurempi hypoglykemian riski, tavoitehbA1c-arvo tulisi nostaa yli 7 %:n.8 KDOQI suosittelee, että potilaat, joilla on CKD:n 4. ja 5. vaihe ja joiden elinajanodote on rajallinen, ylläpitävät yli 7 %:n HbA1c-arvoa.25
|
|
|
Trial |
Results |
|
Action in Diabetes and Vascular Disease: Preterax and Diamicron Modified Release Controlled Evaluation (ADVANCE) Trial22 |
21 %:n vähennys uudessa makroalbuminuriassa ja munuaisten korvaushoidossa, kun A1c on alle 7 % |
|
Veterans Affairs Diabetes Trial (VADT)23 |
37 %:n vähennys makroalbuminuriassa ja 32 %:n vähennys mikroalbuminuriassa, kun A1c on alle 7 % |
|
Action to Control Cardiovascular Risk in Diabetes (ACCORD) -tutkimus24 |
2 %:n vähennys makroalbuminuriassa ja 21 %:n vähennys mikroalbuminuriassa, kun A1c oli alle 7 % |
Epidemiologia. Diabeettiseen nefropatiaan sairastuvat yhtä usein miehet ja naiset.20 Diabeettisen nefropatian ilmaantuvuuden huippu on 15 vuotta diagnoosin jälkeen.21 Afroamerikkalaiset sairastuvat diabeettiseen nefropatiaan kolme-viisi kertaa todennäköisemmin kuin valkoihoiset.20 Myös meksikolaisamerikkalaisilla ja Pima-intiaaneilla on suurempi riski sairastua diabeettiseen nefropatiaan.20
Proteinuria ennustaa diabeteksen yhteydessä esiintyvää kardiovaskulaarista sairastavuutta ja kaikkien syiden aiheuttamaa mortaliteettiä.21diabetekseen sairastuneen proteiinipitoisuuden esiintyminen lisää kardiovaskulaarisen taudin riskiä. Potilailla, joilla on DKD, on jatkuvasti korkeampi sydän- ja verisuonitautikuolleisuus.26 Lisäksi kokonaiskuolleisuus on korkeampi potilailla, joilla on DKD.21
Tyypin 1 diabeteksessa mikrovaskulaariset komplikaatiot, kuten DKD, alkavat kehittyä noin 10-20 vuotta diagnoosin toteamisen jälkeen; tyypin 2 diabeteksessa diabeteksen tarkkaa alkamisajankohtaa ei useinkaan tiedetä, ja näin ollen se vaatii varhaisempaa seulontaa.27
patofysiologia ja patogeneesi. Hyperglykemian ajatellaan aiheuttavan glomeruluksissa kolme merkittävää histologista muutosta, jotka johtavat DKD:hen: 1) mesangiaalinen laajeneminen, 2) glomerulaarisen tyvikalvon paksuuntuminen ja 3) glomerulaarinen skleroosi.28 Vaikka tarkkaa patogeneesiä siitä, miksi DKD:tä esiintyy, ei tunneta, ajatellaan, että hyperglykemia aiheuttaa aluksi hyperfiltraation ja munuaisvaurion histologisten muutosten ja sytokiinien aktivaation tuloksena.20 Tyypillisesti albuminuria voi olla ensimmäinen merkki DKD:stä.29
Tämä pahenee entisestään liitännäissairauksien, kuten hyperlipidemian, valtimonkovettumataudin, verenpainetaudin ja liikalihavuuden seurauksena, jotka kaikki edistävät munuaisvauriota ja sitä seuraavaa toiminnan heikkenemistä. Keskeinen liikalihavuus johtaa verenpainetautiin reniini-angiotensiini-aldosteronijärjestelmän ja sympaattisen hermoston hyperaktivoitumisen kautta.20 Kun munuaisten verisuonisto muuttuu arterioskleroottiseksi, diabeettisen nefropatian eteneminen lisääntyy. Diabeettisen nefropatian tärkeä erottava piirre muihin CKD:n muotoihin verrattuna on se, että glomerulukset ja munuaiset ovat aluksi yleensä normaalit tai suurentuneet.20
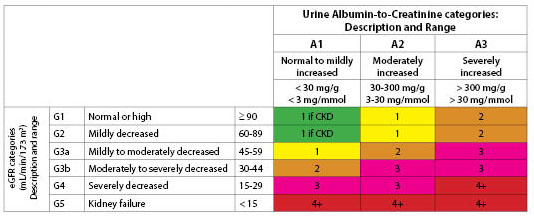
Luokitus. Sekä eGFR:ää että albuminurian esiintymistä käytetään CKD:n luokittelussa.30,31 eGFR perustuu rotuun, ikään, sukupuoleen, painoon ja seerumin kreatiniiniarvoihin. (Ks. taulukko 3.) Historiallisesti termiä mikroalbuminuria käytettiin määrittelemään kohtalaisen suurentuneita albumiinipitoisuuksia. National Kidney Foundation suosittelee nyt käyttämään termejä ”lievä”, ”kohtalainen” tai ”vakavasti lisääntynyt” kuvaamaan albuminuria-arvoja taulukossa 4 kuvattujen tasojen perusteella.31 Albumiinin ja kreatiniinin suhde on ensimmäinen testi, jota käytetään albuminurian havaitsemiseen.
Taulukko 3. Albuminuria. Arvioitu GFR vaiheen ja kuvauksen mukaan |
||||
|
Vaihe |
GFR (ml/min per 1.73 m2) |
Kuvaus |
||
|
90+ |
Glomerulaarinen hyperfiltraatio |
|||
|
Lievästi alentunut munuaisten toiminta |
||||
|
3A |
Moderately reduced renal function |
|||
|
3B |
||||
|
Vakavasti alentunut munuaistoiminta |
||||
|
< 15 tai dialyysihoidossa |
Lopet-vaiheen munuaisten vajaatoiminta |
|||
TAULUKKO 4. Albuminurian luokat CKD:ssä |
||
|
Kategoria |
Albumin-to-Kreatiniinitaso |
Kuvaus |
|
A1 |
< 30 |
Normaali tai lievästi lisääntynyt |
|
A2 |
Moderately suurentunut |
|
|
A3 |
> 300 |
Voimakkaasti suurentunut |
Kaksi luokituskaaviota edustavat kaksitahoista polkua, jonka kautta CKD kehittyy. Toinen kulkee kreatiniinin kohoamisen ja GFR:n heikkenemisen kautta. Toinen on albuminurian kehittymisen kautta. Albuminurian lisääntymistä seuraa usein eGFR:n heikkeneminen;32 tämä voidaan kuitenkin estää käyttämällä angiotensiinikonvertaasientsyymin (ACE) estäjiä tai angiotensiinireseptorin salpaajia (ARB) ja glykeemisen kontrollin avulla. (Ks. kuva 1.)
Kuva 1. Ehdotettu arviointitiheys (määrä kertoja vuodessa) eGFR- ja albumiiniuria-luokittain
Painettu luvalla julkaisusta Kidney Disease: Improving Global Outcomes (KDIGO).
Yleisoireet. Useimmilla ihmisillä ei ole diabeettisesta nefropatiasta johtuvia oireita. Usein potilailla voi olla viitteitä tai diagnoosi muista mikrovaskulaarisista komplikaatioista.20 Varhainen DKD on tyypillisesti oireeton. DKD:n myöhäinen löydös on vaahtoava virtsa. Jos potilaalla on lisäksi vaikea hypoalbuminemia, hänellä voi esiintyä jalkaödeemaa ja väsymystä.20 DKD-potilailla on tyypillisesti systeeminen hypertensio. Diabeettista nefropatiaa sairastavilla potilailla esiintyy tyypillisesti myös retinopatiaa ja neuropatiaa.8
Diagnostiset vaihtoehdot. Koska oireita ei ole, rutiiniseulonta on ratkaisevan tärkeää. ADA suosittelee virtsan albumiinin ja kreatiniinin suhteen vuosittaista seulontaa.8 Lisäksi eGFR olisi testattava vähintään vuosittain potilailta, joilla tyypin 1 diabetes on kestänyt viisi vuotta, ja kaikilta potilailta, joilla on tyypin 2 diabetes, tai potilailta, joilla on liitännäissairautena verenpainetauti ja diabetes.8 Selkeää suositusta kuvantamistutkimusten, kuten ultraäänitutkimuksen, hankkimisesta DKD:n diagnosoimiseksi ei ole.
Differentiaalinen diagnoosi. Jotkin punaiset liput voivat viitata siihen, että diabetes ei ole CKD:n ainoa syy. Jos henkilöllä on pitkälle edennyt CKD ilman näyttöä muista mikrovaskulaarisista komplikaatioista, tämä on varoitus. Avoin proteinuria, johon liittyy äkillisesti (alle viisi vuotta diabeteksen alkamisesta) alkanut virtsan laskeuma, jossa on dysmorfisia punasoluja ja kipsisoluja, tai GFR:n äkillinen lasku viittaavat muuhun kuin diabeettiseen etiologiaan perustuvaan munuaissairauteen.20 Seerumin tai virtsan elektroforeesi voidaan tehdä, jos on huoli multippelistä myeloomasta. Albuminurian puuttuminen alentuneen eGFR:n ja diabeteksen yhteydessä edellyttää tutkimuksia muiden CKD:n syiden kuin DKD:n varalta.21 Taulukossa 5 on lueteltu punaisia lippuja, jotka viittaavat muuhun kuin diabeettiseen glomerulaarisairauteen.
Taulukko 5. Diabeettisen glomerulaarisairauden syy. Punaiset liput, jotka viittaavat muuhun kuin diabeettiseen glomerulaaritautiin
- Proteinurian alkaminen < 5 vuotta tyypin 1 diabeteksen dokumentoidusta puhkeamisesta tai munuaissairauden akuutista puhkeamisesta
- EGFR:n akuutti lasku; diabeettinen nefropatia
- Virtsaneritys, joka sisältää dysmorfisia punasoluja tai soluvalmisteita
- Muiden mikrovaskulaaristen komplikaatioiden, kuten neuropatian tai retinopatian, puuttuminen
- Muun systeemisen sairauden merkit ja/tai oireet
Hoito. Diabeteksen nefropatian tunnusomaista on glukoosin, suolan vähentämisen, verenpaineen ja dyslipidemian hoito. Lisäksi potilaiden tulisi välttää nefrotoksisia lääkkeitä ja lisäravinteita, kuten aminoglykosideja ja ei-steroidisia tulehduskipulääkkeitä. Potilaat on ohjattava nefrologin vastaanotolle, kun munuaissairaus on vaiheessa IV tai jos munuaistoiminta heikkenee nopeasti. Muut lähetteen indikaatiot riippuvat tapauksen monimutkaisuudesta. Diabeteksen uudemmat suun kautta otettavat lääkkeet voivat ehkäistä munuaisten vajaatoiminnan etenemistä.
Glykemiallinen kontrolli. Lääkkeiden valintaan, seurantaan ja farmakologiaan vaikuttavat kaikki diabeettista nefropatiaa sairastavilla potilailla. Kun potilaan eGFR laskee, jotkin suun kautta otettavat lääkkeet vaativat annoksen säätämistä. Insuliini on edelleen keskeinen glukoosinhallintalääke diabetesta ja pitkälle edennyttä CKD:tä sairastavilla potilailla.31 Taulukossa 6 esitetään suositellut annossäädöt antiglykeemisten lääkkeiden annoksille munuaistautipotilailla. Vuonna 2016 sekä empagliflotsiinin että kanagliflotsiinin osoitettiin vähentävän CKD:n etenemistä ja mikroalbuminuriaa.33,34 Empagliflotsiini alensi nefropatian etenemistä ja pienensi suurten sydän- ja verisuonitautitapahtumien riskiä lumelääkkeeseen verrattuna, kun se lisättiin tavanomaiseen tyypin 2 diabeteksen hoitoon merkittävässä Empagliflozin Cardiovascular Outcome Event Trial in Type 2 Diabetes Mellitus Patients (EMPA-REG) -tulostutkimuksessa.33
Taulukko 6. Glukoosia alentavien aineiden annossäädöt ja suositukset munuaisten vajaatoimintapotilailla |
||
|
Glukoosia-Alentavat lääkkeet |
annostuksen mukauttaminen munuaisten vajaatoiminnassa |
|
luokka |
Lääkitys |
|
|
Biguanidit |
Metformiini |
eGFR 30-45 ml/min/1.73 m2: Ei suositella hoidon aloittamista. Jos aloituksen jälkeen, arvioi hoidon jatkamisen hyödyt/riskit. eGFR < 30 ml/min/1,73 m2: Käyttö on vasta-aiheista |
|
Sulfonyyliureat |
Glimepiridi |
Lievä tai kohtalainen vajaatoiminta: Aloitetaan 1 mg kerran vuorokaudessa Vaikea vajaatoiminta: Käyttö on vasta-aiheista |
|
Glipitsidi |
Pidentynyt vapautuminen: Aloitetaan annoksella 2,5 mg kerran vuorokaudessa |
|
|
Glyburidi |
eGFR < 60 ml/min/1,73 m2: Käyttöä ei suositella |
|
|
Meglitinidit |
Nateglinidi |
Ei. annoksen säätäminen tarpeen |
|
Repaglinidi |
CrCl 20-40 ml/min: Aloitetaan 0.5 mg aterioiden yhteydessä CrCl < 20 ml/min: Ei tietoja |
|
|
Tiatsolidiinidionit |
Pioglitatsoni |
Ei annostuksen säätämistä. tarpeen |
|
Rosiglitatsoni |
Ei annostusta tarvitse muuttaa |
|
|
α-Glukosidaasin estäjät |
Akarboosi |
SCr > 2.0 mg/dl: Käyttöä ei suositella |
|
Miglitoli |
CrCl < 25 ml/min tai SCr >2.0 mg/dl: Käyttöä ei suositella |
|
|
DPP-4:n estäjät |
Alogliptiini |
CrCl 30-60 ml/min: 12.5 mg kerran vuorokaudessa CrCl < 30 ml/min: 6,25 mg kerran vuorokaudessa ESRD, joka vaatii hemodialyysiä: 6.25 mg kerran vuorokaudessa ja annetaan hemodialyysin ajoituksesta riippumatta |
|
Linagliptiini |
Ei annostuksen mukauttamista tarvita |
|
|
Saksagliptiini |
CrCl ≤ 50 ml/min: 2.5 mg kerran vuorokaudessa ESRD, joka edellyttää hemodialyysiä: 2.5 mg kerran vuorokaudessa ja annetaan hemodialyysin jälkeen |
|
|
Sitagliptiini |
CrCl 30…50 ml/min: 50 mg kerran vuorokaudessa CrCl < 30 ml/min: 25 mg kerran vuorokaudessa ESRD, joka edellyttää hemodialyysiä tai peritoneaalidialyysiä: 25 mg kerran vuorokaudessa ja annetaan hemodialyysin ajoituksesta riippumatta |
|
|
Vildagliptiini |
CrCl < 50 ml/min: 50 mg kerran vuorokaudessa |
|
|
Sappihapposekvestrantit |
Kolesevelaami |
Ei tarvita annostuksen säätöjä |
|
Dopamiinin-2 -agonistit |
Bromokriptiini |
Ei tietoja |
|
SGLT-2:n estäjät |
Kanagliflotsiini |
eGFR 45-60 ml/min/1.73 m2: Ei saa ylittää 100 mg kerran vuorokaudessa eGFR < 45 ml/min/1,73 m2: Ei suositella hoidon aloittamista. Jos aloituksen jälkeen, lopeta hoito potilailta, joiden eGFR on pysyvästi < 45 ml/minuutti/1,73 m2. eGFR < 30 ml/min/1,73 m2/ESRD/Hemodialyysi: Käyttö on vasta-aiheista |
|
Dapagliflotsiini |
eGFR < 60 ml/min/1,73 m2: Ei suositella hoidon aloittamista. Jos aloituksen jälkeen, lopeta hoito potilailta, joiden eGFR on pysyvästi välillä 30 ja < 60 ml/min/1,73 m2. eGFR < 30 ml/min/1,73 m2/ESRD/Hemodialyysi: Käyttö on vasta-aiheista |
|
|
Empagliflotsiini |
eGFR < 45 ml/min/1,73 m2: Ei suositella hoidon aloittamista. Jos aloituksen jälkeen, lopeta hoito potilailta, joiden eGFR on pysyvästi < 45 ml/min/1,73 m2. eGFR < 30 ml/min/1,73 m2. ESRD/ Hemodialyysi: Käyttö on vasta-aiheista |
|
|
GLP.1-reseptoriagonistit |
Albiglutidi |
Ei annostusta tarvitse säätää |
|
Dulaglutidi |
Ei tarvita annoksen säätöä |
|
|
Exenatidi |
CrCl 30-50 ml/min: Ei tietoja. Käytä varoen. CrCl < 30 ml/min/ESRD: Käyttöä ei suositella |
|
|
Liraglutidi |
Ei tietoa |
|
|
Liksisenatidi |
eGFR 15-29 ml/min/1.73 m2: Ei tietoja. Seurattava lisääntyneiden ruoansulatuskanavan haittavaikutusten varalta, jotka voivat johtaa nestehukkaan ja munuaistoiminnan heikkenemiseen. eGFR <15 ml/min/1.73 m2/ ESRD: Käyttöä ei suositella |
|
|
Amyliinimimeetit |
Pramlintidi |
CrCl ≥15 ml/min: Annostuksen mukauttaminen ei ole tarpeen ESRD: Ei tietoa |
|
Insuliinit |
Rapid-vaikuttavat analogit
Lyhytvaikutteinen
Intermediate-vaikuttava
Basaaliset insuliinianalogit
|
Insuliinin tarve voi pienentyä insuliinin puhdistuman tai aineenvaihdunnan muutosten vuoksi. Seuraa verensokeria tarkasti. |
Verenpainetta. Verenpaineen hoito tulisi aloittaa diabetesta ja diabeettista munuaissairautta sairastavien potilaiden kohdalla 140/90 mmHg.37 Yhdistyneen kuningaskunnan prospektiivisessa diabetestutkimuksessa (United Kingdom Prospective Diabetes Study, UKPDS) havaittiin, että diabeettisten komplikaatioiden riski pieneni 12 % jokaista 10 mmHg:n systolisen paineen laskua kohti, kunnes paine oli 120 mmHg.38 Valintalääkkeinä ovat edelleen ACE:n estäjät tai ARB-lääkkeet henkilöille, joilla on verenpainetauti ja diabetes, diabeettinen munuaissairaus ja CKD. ACE:n eston on osoitettu viivästyttävän DKD:n kehittymistä, kun se aloitetaan potilailla, joilla on lievästi kohonnut albuminuria. Kreatiniini voi nousta jopa 30 % ACE:n estäjän tai ARB:n aloituksen yhteydessä.39 Harkitse muiden munuaisten perussairauksien arviointia, jos kreatiniini nousee tätä enemmän.
KDOQI suosittelee, ettei ACE:tä/ARB:tä annettaisi tyypin 2 diabetesta sairastaville potilaille, jotka ovat normotensiivisiä ja joilla on normoalbuminuria.40,41,42 ACE:n estäjiä tai ARB:itä suositellaan diabetesta sairastaville potilaille, jotka ovat normotensiivisiä ja joilla on mikroalbuminuria.31,37 Näille henkilöille ei ole olemassa erityistä annosta tai titrausta. Reniini-angiotensiinijärjestelmän kaksoissalpausta sekä ACE:llä että ARB:llä ei suositella, koska hyperkalemian, heikentyneen munuaistoiminnan ja hypotension riski kasvaa.43
Suolan vähentäminen. Vuonna 2012 tehdyt tutkimukset Reduction of Endpoints in Non-insulin-dependent diabetes mellitus with the Angiotensin II Antagonist Losartan (RENAAL) Trial ja Irbesartan Diabetic Nephropathy Trial (IDNT) osoittivat, että vähän natriumia sisältävä ruokavalio lisäsi ARB:n nefroprotektiivista ja kardioprotektiivista vaikutusta potilailla, joilla oli tyypin 2 diabetes ja diabeettinen nefropatia.44,45
Munuaisdialyysi- ja munuaissiirtopotilaat. Potilaat, joilla on ESRD, on ohjattava nefrologiaan. Hoitovaihtoehtoja ovat peritoneaalidialyysi tai hemodialyysi, munuaissiirto tai mahdollisuus lopettaa hoito ja aloittaa palliatiivinen hoito tai saattohoito. Eräässä havainnointitutkimuksessa todettiin, että potilailla, jotka aloittivat dialyysin nuorempina (< 60-vuotiaina), oli huonompi eloonjäämisikä.46
Siirto. Kuviossa 1 on esitetty GFR- ja albuminurialuokitukseen perustuvat lähetteen indikaatiot. Harkitse muita diabetekseen liittymättömiä munuaissairauden syitä, erityisesti tyypin 1 diabetesta sairastavilla potilailla, joilla retinopatian puhkeaminen ei ole edeltänyt nefropatian kehittymistä.21 Nefrologit voivat auttaa diagnoosin selvittämisessä, resistentin verenpainetaudin ja hyperkalemian hallitsemisessa sekä potilaiden valmistelemisessa dialyysihoitoa varten.8
On myös otettava huomioon se, että nefropatian kehittyminen ei välttämättä liity itse diabetekseen. Tyypin 1 diabetesta sairastavilla potilailla retinopatian puhkeaminen edeltää yleensä nefropatian kehittymistä.47 Henkilön, jolla esiintyy nefropatiaa mutta ei retinopatiaa, tulisi käydä arvioimassa muut syyt. Nefrologin puoleen tulisi kääntyä nefropatian syyn selvittämiseksi silloin, kun se on epävarmaa tai kun on vaikeasti hoidettavia DKD:hen liittyviä ongelmia, mukaan lukien anemia, hyperparatyreoosi ja etenevä munuaissairaus, kun eGFR < 30 ml/min/1,73 m2.8 Nefrologin konsultaatiokäynti vaiheen 4 CKD:n kehittyessä (eGFR < 30 ml/min/1,73 m2) on yhteydessä vähentyneeseen sairastuvuuteen, pienentyneisiin terveydenhuoltokustannuksiin ja dialyysin myöhästymiseen.48 Harkitse lähetteen antamista vaiheessa 3B, jotta potilaat voidaan valmistella aikaisemmin ja jotta nefrologi voi antaa heille maksimaalisen lääketieteellisen hoidon.
Kliiniset helmet
- DKD:n vuosittainen seulonta DKD:n varalta tulisi tapahtua virtsan albumiinikokeella ja eGFR:n mittauksella.
- Verpaineen ja glukoosin kontrolloinnilla voidaan ennaltaehkäistä nefropatian etenemistä. Pidä verenpaine < 140/90 mmHg diabetesta ja CKD:tä sairastavilla potilailla. ACE:n estäjien tai ARB-lääkkeiden tulisi olla ensisijainen hoito.
- ACE:n estäjiä ja ARB-lääkkeitä ei tulisi käyttää nefropatian ehkäisyyn, jos verenpaine ja proteiinin eritys ovat normaalit. ACE:n estäjiä ja ARB-lääkkeitä ei pidä käyttää yhdessä.
- Potilailla, joilla on CKD:n vaiheet 3-5, on suurentunut hypoglykemian riski. Varovaisuutta on noudatettava suun kautta otettavien lääkkeiden, kuten sulfonyyliureoiden, kanssa.
- Joskus CKD-potilaille on aiheellista asettaa HbA1c-tavoitteeksi > 7 %, erityisesti silloin, kun hypoglykemian riski on suuri.
Diabeettinen perifeerinen neuropatia
Kliinisessä käytännössä laajalti hyväksytty diabeettisen perifeerisen neuropatian (DPN) määritelmä on ”perifeerisen hermoston toimintahäiriön oireiden ja/tai merkkien esiintyminen diabetesta sairastavilla henkilöillä sen jälkeen, kun muut syyt on suljettu pois”.”49 ADA:n distaalisen symmetrisen polyneuropatian luokitus on: 1) ensisijaisesti pienisäikeinen neuropatia, 2) ensisijaisesti suurisäikeinen neuropatia ja 3) sekamuotoinen pien- ja suurisäikeinen neuropatia (yleisin).
Patofysiologia ja patogeneesi. DPN:n kehittyminen ja eteneminen johtuvat hermojen ja niitä ympäröivien solujen monimutkaisista suhteista.50 Sekä verisuonitekijät että metaboliset vuorovaikutukset vaikuttavat DPN:n kaikkiin vaiheisiin.51 Yleisesti hyväksytty käsitys ihmisen diabeteksessa, joka johtaa DPN:n kehittymiseen, on monimutkainen vuorovaikutus hyperglykemian, diabeteksen keston, ikään liittyvien hermovaurioiden, verenpaineen ja veren rasva-arvojen hallinnan asteiden sekä painon välillä.52,53,54,55 Hyperglykemia aktivoi lukuisia biokemiallisia reittejä, jotka määrittävät hermosolun aineenvaihduntatilaa, ja se yhdistyy heikentyneeseen hermon perfuusioon, mikä edistää neuropaattien etenemistä. Merkkitutkimus, DCCT, tukee hyperglykemian merkitystä neuropatian patogeneesissä.10,56,57 Toinen hyperglykemiaan liittyvä mekanismi, joka johtaa DPN:ään, on hyperglykemian aiheuttama oksidatiivinen ja nitrosatiivinen stressi, johon liittyy vapaiden radikaalien tuotannon lisääntyminen58,59.
Hyperglykemian lisäksi matala-asteisella tulehduksella on viime aikoina ehdotettu olevan mahdollisesti tärkeä rooli diabeettisten neuropatioiden patogeneesissä, mikä johtaa perifeeristen ja autonomisten hermosäikeiden vajaatoimintaan.51,60 Monimutkainen joukko metabolisia ja vaskulaarisia tekijöitä laukaisee epätasapainon hermosäikeiden vaurioiden ja korjausten välillä, mikä vaikuttaa erityisesti distaalisiin sensorisiin kuituihin ja edistää tuntoaistin asteittaista häviämistä, joka ilmenee diabeettisen polyneuropatian kliinisinä oireina.58,61
Yleisimmät oireet. Kun tiedustelet koettuja DPN-oireita, merkitse muistiin niiden sijainti (todennäköisimmin tuntuvat käsissä ja jaloissa), alkutekijät, epämukavuuden ominaisuudet sekä yöllisen pahenemisvaiheen alkaminen ja esiintymistiheys, sillä oireet ovat potilaskohtaisia.4 Kohonnut verensokeri vaikuttaa sekä pieniin että suuriin kuituihin, ja koetut oireet vaihtelevat sen mukaan, mihin sensoristen kuitujen luokkaan ne vaikuttavat. Kun vaurioituneet hermosäikeet ovat pääasiassa pieniä, oireet ovat yleensä kipua (pistävää, pistelevää, pistävää, polttavaa, särkevää, ikävää ja yliherkkää), dysestesioita (epämiellyttäviä polttavia, pisteleviä, kutisevia, pistäviä ja pistäviä tuntemuksia) ja puutumista4.
Epämukavuuden voimakkuus voi vaihdella vähäisistä epänormaalien tuntemusten tuntemuksista siihen, että kipu, joka voi pahentua öisin ja häiritä unta, tekee toimintakyvyttömäksi, minkä on osoitettu olevan yhteydessä masennukseen, joka johtuu siitä, että elämänlaatu koetaan heikentyneeksi.4
Toisaalta, kun kyseessä ovat pääasiassa suuret kuidut, potilaat saattavat tuntea tunnottomuutta ja pistelyä raajoissaan, kokea epävakaata kävelyä ja menettää tasapainonsa (mikä johtaa mahdollisiin kaatumisiin).4 Joillakin potilailla oireet saattavat pahentua, kun heidän verensokeriarvonsa laskevat diabeteksen hoidon tehostamisen vuoksi. Potilaat saattavat olla oireettomia, mutta heillä voi olla eriasteisia tuntoaistin menetyksiä; diabeettisen neuropatian aiheuttaman vaikean tuntoaistin menetyksen ei-toivottu seuraus voi olla kivuton vamma, joka johtaa lisääntyneeseen jalkahaavan tai vakavissa tapauksissa amputaation riskiin.62
Diabeettisen perifeerisen neuropatian yleisin muoto on distaalinen symmetrinen polyneuropatia, johon liittyy etenevä tuntohermosäikeiden katoaminen.4 Tyypillinen molemminpuolinen ”sukkakuvio” syntyy vaurioista, jotka esiintyvät pisimpien (ensin vaurioituvien) hermojen distaalisimmissa osissa.63,64,65 Ajan edetessä hermovajeiden proksimaalisesta etenemisestä syntyy ”sukkahanskakuvio”, joka edistää tuntoaistin heikkenemistä ja tyypillisiä DNP:lle tyypillisiä oireita.4
Kliininen diagnoosi. DPN:n kliininen diagnoosi voidaan tehdä diabetesta sairastavan potilaan neuropaattisten merkkien ja oireiden perusteella sen jälkeen, kun muut neuropatian syyt on suljettu pois.66 Oireetonta diabeettista perifeeristä neuropatiaa voi esiintyä jopa 50 %:lla niistä, jotka sairastavat tätä komplikaatiota; siksi ennaltaehkäisevän jalkojenhoidon toteuttaminen on olennaista erityisesti niille, joilla on suuri riski saada vammoja tuntemattomien jalkojen vuoksi.4 Kaikille diabetesta sairastaville potilaille olisi tehtävä vuosittainen DPN:n seulonta pistokokeen, lämpötilan, värähtelytuntemuksen (128 Hz:n virityshaarukalla), 10 g:n monofilamenttisen paineen tuntemuksen ja nilkan syvien jännerefleksien avulla. 10 g:n monofilamenttisen paineen tuntemuksen häviäminen (suojaavan aistimuksen häviäminen) ja heikentynyt värähtelytuntemus ennustavat mahdollisia jalka- ja jalkahaavoja.63 ADA:n Standards of Medical Care in Diabetes-2017 -ohjeissa suositellaan edelleen vuosittaista 10 g:n monofilamenttitestiä haavauman ja amputaation riskipotilaiden tunnistamiseksi.8 Lisäksi ADA:n vuoden 2017 ohjeissa suositellaan DPN:n seulontaa tyypin 2 diabeteksen diagnoosin yhteydessä ja viisi vuotta tyypin 1 diabeteksen diagnoosin jälkeen.8
Vuonna 2009 Toronton konsensuspaneeli (Toronto Consensus Panel on Diabetic Neuropathies) päivitti taudinmäärityskriteerejä diagnoosiluokkien määrittämiseksi. Lisäksi terveydenhuollon tarjoajat voivat käyttää diagnosointiprosessissa useita hyvin validoituja seulontavälineitä, kuten Michiganin neuropatian seulontavälinettä (MNSI), Toronton kliinisen neuropatian pistemäärää (Toronto Clinical Neuropathy Score) ja Utahin neuropatia-asteikkoa (Utah Neuropathy Scale). Taulukossa 7 kuvataan muita neuropatian syitä, jotka tulisi sulkea pois.
Taulukko 7. Neuropatian syyt. Muut neuropatian syyt67
- Alkoholi tai muut toksiinit
- Neurotoksiset lääkkeet, erityisesti solunsalpaajahoito
- B12-vitamiinin puute
- Kilpirauhasen vajaatoiminta
- Renaalinen sairaus
- Maligniteetit (multippeli myelooma, bronkogeeninen karsinooma)
- Human immunodeficiency virus (HIV)
- Krooninen tulehduksellinen demyelinoiva neuropatia, perinnölliset neuropatiat ja vaskuliitti
Diagnostiikka. DPN:n esiintymisen vahvistamiseksi on olemassa useita diagnostisia testejä. Hermojohtumistutkimuksia on jo vuosia pidetty DPN:n kultaisena diagnostisena testinä, koska ne ovat objektiivisia mittauksia ilman potilaiden reaktioita, mikä johtaa suureen luotettavuuteen.4 Kvantitatiivinen sensorinen testaus arvioi potilaiden kykyä havaita kevyttä kosketusta, värähtelyä ja lämpötilan erottelukykyä, ja siihen liittyy tiettyä subjektiivisuutta.4 Muita menetelmiä, mukaan lukien ihobiopsia ja intraepidermaalinen hermosäikeiden tiheys ja sarveiskalvon konfokaalinen mikroskooppitutkimus, ei ole käytetty rutiineina kliinisessä käytännössä, mutta niitä voidaan käyttää kliinisissä tutkimuksissa.4
Hoitovaihtoehdot: Farmakologinen hoito. DPN:n farmakologinen hoito tähtää oireiden parantamiseen, joten käytettävien lääkkeiden tarkoituksena ei ole estää etenemistä. Taulukkoon 8 on koottu yhteenveto kolmen yleisimmin käytetyn luokan (kouristuslääkkeet, masennuslääkkeet ja opioidit) lääkkeistä neuropaattisten oireiden hallitsemiseksi. Vaikka useita aineita käytetään yleisesti DPN:n hoidon alkuvaiheessa, vain pregabaliini ja duloksetiini ovat saaneet FDA:n hyväksynnän tämän sairauden hoitoon, joten jompaakumpaa näistä aineista suositellaan oireisen neuropaattisen kivun alkuvaiheen valinnaksi.4 Gabapentiinia käytetään usein alkuvaiheessa, vaikka sitä ei olekaan hyväksytty FDA:n käyttöön DPN:n hoidossa, ja sen teho on vertailukelpoinen FDA:n hyväksymien aineiden kanssa. Trisykliset masennuslääkkeet (esim. amitriptyliini) – jotka eivät ole FDA:n hyväksymiä DPN-lääkkeitä – ovat tehokkaita DPN:n hoidossa, mutta niitä on käytettävä varoen suuremman haittavaikutusriskin vuoksi.
Taulukko 8. DPN:n hoito. Yleisesti käytetyt farmakologiset aineet DPN:n hoidossa4,69 |
|||||
|
Farmaseuttinen aine (NNT-väli 30-…50 % paraneminen*) |
DNP:n enimmäisvuorokausiannos (mg/vrk) |
Yleisimmät haittavaikutukset |
Tarvitaanko annoksen säätämistä? |
Vasta-aiheet |
Reseptin määräämiseen liittyviä näkökohtia |
|
Kouristuslääkkeet
|
|||||
|
Pregabaliini (3.3-8.3) |
Huimaus Somnolenssi Painonnousu Perifeerinen ödeema Näön hämärtyminen Ummetus |
Renaalinen: Kyllä Hepaattinen: Ei |
Yliherkkyys pregabaliinille |
Vahva näyttö; FDA:n hyväksymä; valvottava aine |
|
|
Gabapentiini |
3,600 |
Huimaus Ataxia Somnolenssi Päänsärky Pahoinvointi Nausea Ripuli Painon nousu |
Renaalinen: Hepaattinen: Ei |
Yliherkkyys gabapentiinille |
kohtalainen näyttö; ei FDA:n hyväksyntää |
|
Antidepressantit
|
|||||
|
Amitriptyliini (2.1-4.2) |
vaikea sedaatio; hämmennys; antikolinergiset vaikutukset (ummetus, näön hämärtyminen) |
Renal: Hepaattinen: Ei Pienempiä annoksia suositellaan iäkkäille potilaille |
Yliherkkyys amitriptyliinille; yhteiskäyttö MAO:n kanssa tai 14 vuorokauden kuluessa; yhteiskäyttö sisapridin kanssa; akuutti toipumisvaihe sydäninfarktin jälkeen |
kohtalainen näyttö; ei FDA:n hyväksyntää; käyttö varoen henkilöille, joilla on aiemmin ollut sydän- ja verisuonitauti |
|
|
Duloksetiini |
|||||
|
(3.8-11) |
(USA) |
Pahoinvointi; sedation; generalisoitunut uneliaisuus |
Renaalinen: Kyllä Maksa: Vältä käyttöä maksan vajaatoiminnassa |
Yliherkkyys; samanaikainen käyttö MAO:iden kanssa tai 14 vuorokauden kuluessa; aloittaminen niille, jotka saavat linetsolidia tai IV-metyleenisinistä |
Moderate evidence; FDA:n hyväksymä; voidaan lisätä pregabaliiniin tai gabapentiiniin |
|
Venlafaksiini (5.2-8.4) |
Nausea; sedation; yleinen uneliaisuus |
Renaalinen: Kyllä Hepaattinen: Kyllä |
heikko näyttö; ei FDA:n hyväksyntää; voidaan lisätä gabapentiiniin |
||
|
Opioidit
|
|||||
|
Tramadoli (2.1-6.4) |
Somnolenssi Pahoinvointi Yökkäys Suolimahalvaus Kevytpäänsärky Huimaus Särky päänsäryssä |
Renaalinen: Hepaattinen: Ei |
Yliherkkyys tramadolille, opioideille tai jollekin valmisteen ainesosalle; ER-valmiste: Merkittävä hengityslama ja akuutti tai vaikea astma; IR-valmiste: Akuutti myrkytys alkoholilla, hypnoosilääkkeillä, narkoottisilla lääkkeillä, keskushermostoon vaikuttavilla kipulääkkeillä, opioideilla tai psykotrooppisilla lääkkeillä |
Vähäisempi väärinkäyttöpotentiaali (luettelon IV valvottava aine); ei suositella käytettäväksi ensimmäisen tai toisen linjan lääkkeenä |
|
|
Tapentadoli (N/A) |
Välivalmiste: Pitkittynyt vapautuminen: |
Somnolence Nausea Yksentely Sisäinen ummetus Huimaus |
Renaal: Käyttöä ei suositella, kun Hepaattinen: Ei |
Yliherkkyys tapentadolille; merkittävä hengityslama; akuutti tai vaikea astma; paralyyttinen ileus; 14 vrk:n kuluessa MAO:n estäjien käytöstä |
FDA:n hyväksymä; luettelossa II oleva valvottava aine; ei suositella käytettäväksi ensimmäisen tai toisen linjan lääkkeenä |
|
Tiedot koskevat lääkeaineita, jotka on saatu vastaavista pakkausselosteista (viitataan kauppanimillä) |
|||||
Ammattilaisen neurologian akatemian (American Academy of Neurology, AAN) ohjeessa suositellaan seuraavia paikallisia aineita: kapsaisiini- ja isosorbididinitraattisuihke (kohtalainen näyttö) ja Lidoderm-laastari (heikko näyttö).69 Okskarbatsepiinia, lamotrigiinia, lakosamidia, klonidiinia, pentoksifylliiniä ja meksiletiinia ei suositella AAN:n ohjeessa DPN:n hoidossa.69
Lisäksi jotkut ovat suositelleet opioidien käyttöä tulenkestävässä DPN:ssä. AAN:n ohjeen suosittelemia opioideja ovat dekstrometorfaani (400 mg/vrk), morfiinisulfaatti (titrattuna 120 mg:aan/vrk) ja oksikodoni (keskimäärin 37 mg/vrk, maksimissaan 120 mg/vrk); ei kuitenkaan ole olemassa riittäviä tietoja, joiden perusteella voitaisiin suositella yhden aineen käyttämistä toisten sijaan.69 Tämän artikkelin kirjoittajat suosittelevat opioidien käyttämistä vain vaikeissa refraktorisissa tapauksissa ja niiden potilaiden tarkkaa tarkkailua, jotka saavuttavat todellista toimintakyvyn paranemista opioideilla. Kirjoittajat noudattavat Centers for Disease Control and Preventionin vuonna 2016 antamaa kannanottoa, jonka mukaan opioidien pitkäaikaiskäyttö ei-syöpätyyppisissä kiputiloissa on rajallista.70
Yksi DPN:n farmakologisen hoidon haasteista on se, että elämänlaatutulokset sisältäviä head-to-head-tutkimuksia ei ole riittävästi.4 Tuoreessa tutkimuksessa, jossa verrattiin kahdeksan viikkoa kestänyttä hoitoa korkea-annoksisen pregabaliinin, korkea-annoksisen duloksetiinin tai yhdistelmähoidon välillä, ei havaittu merkittäviä eroja keskimääräisessä kivun muutoksessa monoterapian ja yhdistelmähoidon välillä.71 Tarvitaan lisää tutkimuksia, joissa verrataan kahta vaikuttavaa ainetta keskenään, jotta saadaan tietoa diabeettisesta perifeerisestä neuropatiasta kärsivien hoidon parantamisesta.
Ei-farmakologinen hoito. Toimenpiteet. ANN-ohjeessa ehdotetaan harkittavaksi perkutaanista sähköistä hermostimulaatiota kolmen tai neljän viikon ajan DPN:n hoidossa.69 Kahden tyylilajin pilottitutkimus akupunktiosta satunnaistetussa, kontrolloidussa tutkimuksessa72 ja plasebokontrolloidussa satunnaistetussa yksisokkotutkimuksessa73 , jossa arvioitiin akupunktion tehokkuutta DPN:n hoidossa, molemmissa havaittiin parannuksia kipuun liittyvissä lopputulosmittareissa. Tarvitaan kuitenkin lisätutkimuksia akupunktion roolin vahvistamiseksi DPN:n hoidossa.
Alfa-lipoiinihappo. Joidenkin todisteiden mukaan antioksidanttisen alfa-lipoiinihapon käyttö saattaisi auttaa vähentämään vapaiden radikaalien välittämää oksidatiivista stressiä ja tarjota seuraavia hyötyjä: DPN:n patogeneesiin kohdistaminen, kehittymisen hidastaminen ja oireiden parantaminen.74,75
Preventio. Elämäntapamuutosten, joissa keskitytään terveelliseen ruokavalioon ja liikuntaan, on jatkuvasti osoitettu vähentävän diabeteksen ja sen komplikaatioiden, mukaan lukien diabeettisen perifeerisen neuropatian, esiintyvyyttä.68 Intensiivisen glykeemisen kontrollin on osoitettu auttavan vähentämään diabeettisen neuropatian riskiä diabetesta sairastavilla potilailla parantamalla hermotoimintaa.61,76,77 DCCT-tutkimuksessa todettiin, että glykeemisen kontrollin merkitys on tärkeä, kun pyritään ehkäisemään ja pysäyttämään tyypin 1 diabeteksen yhteydessä esiintyvää diabeettisen neuropatian etenemistä.10,56
Kliiniset helmet
- Jopa 50 %:lla potilaista saattaa olla kivuton tai oireeton perifeerinen neuropatia.
- Potilaille, joilla on neuropatia, suositellaan jalkojenhoitokoulutusta (jalkojen päivittäistä omatoimista tarkastusta) ja valikoiduille potilaille säännöllistä jalkahoitoa.
- Potilaita, joilla on DPN ja joilla on merkkejä suojaavan tuntoaistin menettämisestä muodonmuutoksen kanssa tai ilman sitä, tulisi neuvoa käymään lääkärin vastaanotolla kolmen tai kuuden kuukauden välein ennaltaehkäiseviä toimenpiteitä varten.64.
- DPN:n oireiden tehokkaan hallinnan kannalta moniammatillinen lähestymistapa on olennaisen tärkeä; tähän kokonaisvaltaiseen lähestymistapaan voi sisältyä farmakologista, psykologista ja/tai fysioterapiaa.
- ADA:n julkaisemassa uudessa diabeettista neuropatiaa koskevassa kannanotossa suositellaan DPN:n seulontaa potilailla, joilla on diabetesta edeltävä diabeteksen alkuvaiheessa ja joilla on perifeerisen neuropatian oireita.4
- Erikoissairaanhoitoa tarvitsevat henkilöt, joilla on perifeerinen sairaus, ei-sensorinen neuropatia tai Charcot’n jalka.
Gastropareesi
Toinen diabeteksen neuropatian muoto on gastropareesi. Tähän tilaan liittyy ylemmän ruoansulatuskanavan oireita, kuten pahoinvointia, oksentelua, varhaista kylläisyyttä tai aterianjälkeistä kylläisyyttä, vatsakipua ja turvotusta, mutta ilman ulostuloväylän tukosta. Vaikka gastroareesin syitä on useita, on arvioitu, että diabetes aiheuttaa noin kolmanneksen kaikista tapauksista.78
Patofysiologia. Diabeettisen gastroareesin ehdotettuja patofysiologisia mekanismeja ovat heikentynyt glykeeminen kontrolli, vagus- tai prevertebraalisten sympaattisten ganglioiden neuropatia, Cajalin interstitiaalisten solujen poikkeavuudet, typpioksidisyntaasin menetys ja mahdollisesti myopatia.79,80
Kliininen esitys. Tämän tilan alkuvaiheessa potilaat ovat yleensä oireettomia. Oireiden ja neuropatian vaikeusasteen välillä ei ole lineaarista yhteyttä. Oireiden laaja kirjo vaikeuttaa tilan diagnosointia. Muita kliinisiä oireita ovat anoreksia, aliravitsemus, laihtuminen ja hypoglykemia, joka johtuu ruuan ja insuliinin imeytymisen yhteensopimattomuudesta. Kipu saattaa itse asiassa olla aliraportoitua mutta monille ihmisille merkittävää. NIH:n rahoittamassa konsortiossa 72 prosentilla gastropareesipotilaista oli vatsakipua.81 Se oli hallitseva oire 18 prosentilla näistä potilaista. Kipua aiheutti syöminen (72 %), se oli yöllistä (74 %) ja häiritsi unta (66 %) näillä potilailla.81
Miten yleistä on diabeteksen aiheuttama gastropareesi? Kymmenen vuoden kumulatiivisen gastroareesin esiintyvyyden on arvioitu olevan 5,2 % tyypin 1 diabeteksessa ja 1 % tyypin 2 diabeteksessa yhteisön diabetespotilaiden keskuudessa.82 Muissa tutkimuksissa lukujen on todettu olevan 5-12 %.83,84 Lukumäärät ovat kuitenkin paljon korkeammat, kun diagnoosi perustuu oireisiin eikä mahalaukun tyhjennystutkimukseen.
Gastroareesi on yleisempi tyypin 1 diabeteksessa kuin tyypin 2 diabeteksessa, ja se ilmenee tavallisimmin sen jälkeen, kun henkilö on sairastanut diabetesta yli 10 vuotta ja hänelle on kehittynyt muita mikrovaskulaarisia komplikaatioita, kuten retinopatiaa, nefropatiaa ja perifeeristä neuropatiaa. Jos potilas sairastuu gastroareesiin odotettua aikaisemmin, on selvitettävä muut etiologiset syyt, yleisimmin perioperatiivinen vagushermovaurio tai inkretiinipohjaisten lääkkeiden – glukagonin kaltaisten peptidi-1-reseptoriagonistien (GLP-1RA) ja dipeptidyylipeptidaasi 4:n estäjien (DPP-4:n estäjät) – aiheuttamat farmakologiset vaikutukset.
Kun potilas saa gastroareesin aiheuttamat oireet, oireet tyypillisesti jatkuvat ja pysyvät vakaana 12-25 vuoden ajan. Tämä pätee, vaikka glukoosinhallinta paranisi,85 paitsi haiman- ja munuaisensiirron yhteydessä.86 Vaikka ei ole selvää näyttöä siitä, että gastropareesi itsessään lisäisi kuolleisuutta, se heikentää huomattavasti kaikkia elämänlaadun osa-alueita.87
Diagnostiikka. Useat testit voivat auttaa diagnoosin tekemisessä. Kultainen standardi tässä diagnoosissa on gastroesofageaalinen skintigrafia. Se on noninvasiivinen, testaa fysiologiaa ja antaa kvantitatiivisia tuloksia. Gastropareesi voidaan diagnosoida, jos vähintään 35 prosenttia tavanomaisesta vähärasvaisesta ateriasta pidättyy neljä tuntia ruokailun jälkeen.80
Tarkimpien testitulosten saamiseksi testiä edeltävään protokollaan on sisällyttävä kaikkien motiliteettia muuttavien lääkkeiden, mukaan lukien prokineettien, opiaattien ja antikolinergisten lääkkeiden, lopettaminen vähintään kahdesta kolmeen vuorokautta ennen testiä. Inkretiinilääkkeet, kuten GLP-1-agonistit ja DPP-4-estäjät, on myös lopetettava, koska niiden tiedetään hidastavan mahalaukun tyhjenemistä. Hyperglykemian on myös osoitettu viivästyttävän mahalaukun tyhjenemistä, ja glukoosin tulisi olla alle 275 mg/dl ennen tutkimuksen aloittamista.79,88
Potilaiden tulisi pidättäytyä tupakoinnista ja alkoholin nauttimisesta testipäivänä, sillä kumpikin voi hidastaa gastroesofageaalista tyhjenemistä.89 Lisäksi GLP-1RA-lääkkeet voivat pahentaa gastropareesia, koska ne hidastavat mahalaukun tyhjenemistä. Lisäksi joillakin ihmisillä voi olla subkliininen gastroareesi, joka paljastuu, kun GLP-1RA-hoito aloitetaan.
Hoito. Gastroareesin hoito riippuu pitkälti oireiden vaikeusasteesta. Hoidon yleisiin periaatteisiin kuuluvat tukihoidot (nesteiden, elektrolyyttien, glukoosin säätely ja ravitsemus), lääkehoidot (prokinetiikka, antiemeettiset lääkkeet ja kivunlievitys) sekä invasiiviset hoidot (leikkaus, Botox-injektiot, mahalaukun tahdistus tai sähköstimulaatio).79
Tukihoito aloitetaan tavallisesti sairaalassa, ja siinä keskitytään neste-, elektrolyytti- ja ravitsemushäiriöiden normalisointiin. Kun annetaan ravitsemuksellista tukea, enteraalista ruokintaa suositaan parenteraalisen ruokinnan sijaan, koska se on fysiologisempaa ja voi auttaa ylläpitämään suolistoflooraa. Lisäksi ruokavaliomuutokset voivat olla erittäin hyödyllisiä gastropareesissa. Vähäkuituista, vähärasvaista ja vähäjätteistä ruokavaliota suositellaan potilaille, joilla on gastropareesi.85 Runsaasti kuituja sisältävä ruokavalio voi lisätä oireita, koska se vaatii enemmän ruoansulatusta.
Lääkkeet. Prokinetiikka: Yhdysvalloissa metoklopramidi ja erytromysiini ovat yleisimmin käytettyjä lääkkeitä gastroareesin hoidossa. Metoklopramidilla on kuitenkin musta laatikko -varoitus tardiivisen dyskinesian riskin vuoksi. Tämän tilan kehittyminen on suoraan yhteydessä metoklopramidin käytön kestoon ja otettujen annosten määrään. Tätä lääkettä käytettäessä on parasta käyttää sitä vain oireileville potilaille ja aloittaa pienimmällä tehokkaalla annoksella 15 minuuttia ennen ateriaa. Lääkkeiden lomat voivat joskus auttaa pidentämään vaikutusten kestoa.90
Domperidoni on selektiivisempi dopamiiniagonisti, joka on yhtä tehokas kuin metoklopramidi, mutta jolla on vähemmän keskushermostoon kohdistuvia haittavaikutuksia.91
Antiemeetikko: Antiemeettisiä lääkkeitä voidaan käyttää helpottamaan oireita. Lääkkeiden yhteisvaikutusten riski on kuitenkin merkittävä, ja sitä on seurattava huolellisesti.
Kivunhoito voi olla haaste gastroareesia sairastaville potilaille. Trisyklisiä masennuslääkkeitä käytetään usein gastroareesin kivun ensilinjan hoitona. Toisen linjan lähestymistapoja ovat heikko mu-opioidireseptoriagonisti tramadoli, joka vapauttaa myös serotoniinia ja estää noradrenaliinin takaisinottoa, ja gamma-aminovoihappoanalogi gabapentiini. Narkoottisten lääkkeiden käyttöä gastropareesissa ei kuitenkaan suositella, koska se voi edistää ummetusta ja pahentaa oireita.
Invasiiviset hoidot: Botox-injektioita käytetään yleisesti gastroareesin hoidossa, mutta niiden käyttöä ei ole tuettu kliinisissä tutkimuksissa.92,93
Mahalaukun sähköstimulaatiolaite sai FDA:n hyväksynnän humanitaarisen laitepoikkeusluvan nojalla vuonna 2000.94 Mahalaukun sähköstimulaatiolaite antaa korkeataajuista, matalaenergistä sähköstimulaatiota mahalaukkuun. Siitä on enemmän apua diabeettisessa gastroareesissa kuin idiopaattisessa gastroareesissa. Meta-analyysi osoitti, että potilaiden oireet paranevat huomattavasti. Sen hyödyn tarkkaa mekanismia ei vieläkään tunneta.95 On ehdotettu, että mahalaukun sähköinen stimulaatio aiheuttaa muutoksia pahoinvointia ja oksentelua kontrolloivissa keskusmekanismeissa, lisää vagustoimintaa ja vähentää herkkyyttä paisumiselle.97 Potilaat, jotka reagoivat hyvin, reagoivat yleensä nopeasti. Tämä on saanut jotkut suosittelemaan ensin kokeilua väliaikaisella elektrodien sijoittamisella ennen pitkäaikaista käyttöönottoa.
Kliiniset helmet
- Diabeettinen gastroareesi on yleisempi henkilöillä, joilla on pitkäaikainen diabetes ja joilla on muita mikrovaskulaarisia komplikaatioita.
- Gastroareesin kultainen standardi-diagnostiikka on gastroesofageaalinen skintigrafia.
- Diabeettisessa gastroareesissa suositellaan vähäkuituista, vähärasvaista ja vähärasvaista ruokavaliota.
- Farmakologisilla ja toimenpidehoidoilla on rajallinen hyöty ja merkittävä pitkäaikaisriski.
Diabeettinen cheiroartropatia
Yksi diabeteksen vähemmän tunnetuista komplikaatioista on cheiroartropatia. Tälle tilalle on ominaista nivelten rajoittunut liikkuvuus, joka johtuu ihon paksuuntumisesta pitkään sairastaneilla diabeetikoilla. Se oli todennäköisesti ensimmäinen tyypin 1 diabeteksesta tunnistettu komplikaatio. Esiintyvyys vaihtelee suuresti 8-50 prosentin välillä.98
Cheiroartropatian uskotaan johtuvan kollageenin glykosylaatiosta ja ristisilloittumisesta. Se voi vaikuttaa ihoon ja jänteisiin, ja se voi johtaa nivelten rajoittuneeseen liikkuvuuteen, yleisimmin sormien ojentumiseen, jäykkyyteen ja kipuun. Diabeettisen keiropatian klassinen fyysisen tutkimuksen merkki on ”rukousmerkki”. Tässä tilassa henkilö ei pysty täysin litistämään käsiään ”rukoilemaan”, jolloin vasemman ja oikean käden sormien väliin jää rako. On näyttöä siitä, että cheiropatiaa sairastavilla on kolminkertainen riski saada mikrovaskulaarisia komplikaatioita.99
Diabeettinen cheiropatia on tyypillisesti pahempi niillä, joilla on pitkäaikainen tai huonosti hallittu glykemia. Onneksi monet kokevat oireiden lievittyvän ja liikuntakyvyn paranevan, kun glukoosinhallinta paranee.100
Johtopäätös
Diabeteksen komplikaatioiden hoito edellyttää moniammatillista tiimiä. Retinopatian, nefropatian ja neuropatian varhainen seulonta on olennaista, koska tauti on oireeton. Diabeteksen hoidon tunnusmerkki kaikkien komplikaatioiden osalta on edelleen glykeemisen ja verenpaineen hallinta.
- American Diabetes Association. Diabeteksen kustannukset. Saatavilla osoitteessa: http://www.diabetes.org/advocacy/news-events/cost-of-diabetes.html?referrer=https://www.google.com/. Päivitetty 22. kesäkuuta 2015. Accessed Feb. 8, 2017.
- UK Prospective Diabetes Study Group. Intensiivinen verensokerin hallinta sulfonyyliureoilla tai insuliinilla verrattuna tavanomaiseen hoitoon ja komplikaatioriski tyypin 2 diabetesta sairastavilla potilailla. Lancet 1998;352:837-853.
- Gregg EW, Yanfed L, Wang J. Changes in diabetes-related complications in the United States, 1990-2010. N Engl J Med 2014;370:1514-1523.
- Pop-Busui R, Boulton A, Feldman E, et al. Diabetes neuropathy: A position statement by the American Diabetes Association. Diabetes Care 2017;40:136-154.
- Leasher JL, Bourne RR, Flaxman SR, et al. Global estimates on the number of people blind or visually impaired by diabetic retinopathy: Meta-analyysi vuosilta 1990-2010. Diabetes Care 2016;39:1643-1649.
- National Eye Institute. Faktoja diabeettisesta silmäsairaudesta. Saatavilla osoitteessa: https://nei.nih.gov/health/diabetic/retinopathy. Päivitetty syyskuussa 2015. Accessed Feb. 8, 2017.
- Fong, DS, Aiello L, Gardner TW, et al. Retinopathy in diabetes. Diabetes Care 2004;27(Suppl 1):S84-S87.
- American Diabetes Association. Lääketieteellisen hoidon standardit diabeteksessa-2017. Diabetes Care 2017;40:(Suppl 1):S4-S5.
- Doggen K, Nobels F, Scheen AJ, ym. Kardiovaskulaariset riskitekijät ja komplikaatiot, jotka liittyvät albuminuriaan ja heikentyneeseen munuaisten toimintaan insuliinihoidetussa diabeteksessa. J Diabetes Complications 2013;27:370-375.
- The Diabetes Control and Complications Trial Research Group. Diabeteksen tehohoidon vaikutus pitkäaikaiskomplikaatioiden kehittymiseen ja etenemiseen insuliiniriippuvaisessa diabetes mellituksessa. N Engl J Med 1993;329:977-986.
- Action to Control Cardiovascular Risk in Diabetes Follow-On (ACCORDION) Eye Study Group ja Action to Control Cardiovascular Risk in Diabetes Follow-On (ACCORDION) Study Group. Intensiivisen glykeemisen kontrollin pysyvät vaikutukset tyypin 2 diabeteksen retinopatiaan Action to Control Cardiovascular Risk in Diabetes (ACCORDORD) follow-on -tutkimuksessa. Diabetes Care 2016;39:1089-1100.
- ACCORD Study Group, ACCORD Eye Study Group, Chew EY, et al. Effects of medical therapies on retinopathy progression in type 2 diabetes. N Engl J Med 2010;363:233-244.
- Chew EY, Davis MD, Danis RP, et al. The effects of medical management on the progression of diabetic retinopathy in persons with type 2 diabetes: The Action to Control Cardiovascular Risk in Diabetes (ACCORD) Eye Study. Ophthalmology 2014;121:2443-2451.
- Diabetes Control and Complications Trial Research Group. Raskauden vaikutus mikrovaskulaarisiin komplikaatioihin Diabetes Control and Complications Trial -tutkimuksessa. Diabetes Care 2000;23:1084-1091.
- Colberg SR, Sigal RJ, Yardley JE, et al. Physical activity/exercise and diabetes: A position statement of the American Diabetes Association. Diabetes Care 2016;39:2065-2079.
- The Diabetic Retinopathy Study Research Group. Alustava raportti fotokoagulaatiohoidon vaikutuksista. Am J Ophthalmol 1976;81:383-396.
- Early Treatment Diabetic Retinopathy Study Research Group. Diabeettisen makulaturvotuksen fotokoagulaatio: Early Treatment Diabetic Retinopathy Study raportti numero 1. Arch Ophthalmol 1985;103:1796-1806.
- Nguyen QD, Brown DM, Marcus DM, et al. Ranibizumab for diabetic macular edema: Results from 2 phase III randomized trials: RISE ja RIDE. Ophthalmology 2012;119:789-801.
- Wong TY, Cheung CMG, Larsen M, et al. Diabeettinen retinopatia. Nat Rev Disease Prim doi:10.1038/nrdp.2016.12; julkaistu verkossa 17.3.2016.
- Batuman V, Soman AS, Schmidt RJ, Soman SS. Diabetes nefropatia. Medscape Saatavilla osoitteessa: http://emedicine.medscape.com/article/238946-overview. Päivitetty 30. syyskuuta 2016. Accessed Feb. 12, 2017.
- Tuttle KR, Bakris GL, Bilous RW, et al. Diabeettinen munuaissairaus: ADA:n konsensuskonferenssin raportti. Diabetes Care 2014;37:2864-2883. https://doi.org/10.2337/dc14-1296
- Patel A, MacMahon S, Chalmers J, et al. Intensive blood glucose control and vascular outcomes in patients with type 2 diabetes. N Engl J Med 2008;358:2560-2572.
- Duckworth W, Abraira C, Moritz T, et al. Glukoosinhallinta ja verisuonikomplikaatiot tyypin 2 diabetesta sairastavilla veteraaneilla. N Engl J Med 2009;360:129-139.
- Ismail-Beigi F, Craven T, Banerji MA, ym. Hyperglykemian intensiivisen hoidon vaikutus tyypin 2 diabeteksen mikrovaskulaarisiin tuloksiin: ACCORD-tutkimuksen satunnaistetun tutkimuksen analyysi. Lancet 2010;376:419-430.
- National Kidney Foundation. KDOQI clinical practice guideline for diabetes and CKD: 2012 update. Am J Kidney Dis 2012;60:850-886.
- Fox CS, Matsushita K, Woodward M, et al. Chronic Kidney Disease Prognosis Consortium. Associations of kidney disease measures with mortality and end-stage renal disease in individuals with and without diabetes: A meta-analysis. Lancet 2012;380:1662-1673.
- Hahr AJ, Molitch ME. Diabetes mellituksen hoito kroonista munuaissairautta sairastavilla potilailla. Clin Diabetes Endocrinol 2015. doi: 10.1186/s40842-015-0001-9.
- Alsaad KO, Herzenberg AM. Diabeettisen nefropatian erottaminen muista glomeruloskleroosin tapauksista: An update. J Clin Pathol 2007;60:18-26.
- Narva AS, Bilous RW. Diabeettisen munuaistaudin laboratorioarviointi. Diabetes Spectr 2015;28:162-166.
- Levey AS, Stevens LA, Schmid CH, et al. A new equation to estimate glomerular filtration rate. Ann Intern Med 2009;150:604-612.
- National Kidney Foundation. KDOQI:n kliiniset ohjeet kroonista munuaistautia varten: Evaluation, classification, and stratification. Am J Kidney Dis 2002;39(2 Suppl 1):S1-S266.
- de Boer IH, Rue TC, Cleary PA, et al. Long-term renal outcomes of patients with type 1 diabetes mellitus and microalbuminuria: An analysis of the Diabetes Control and Complications Trial/Epidemiology of Diabetes Interventions and Complications cohort. Arch Intern Med 2011;171:412-420.
- Wanner C, Inzucchi SE, Lachin JM, et al. Empagliflotsiini ja munuaistaudin eteneminen tyypin 2 diabeteksessa. N Engl J Med 2016;375:323-334.
- Heerspink HJL, Desai M, Jardine M, et al. Canagliflotsiini hidastaa munuaistoiminnan heikkenemisen etenemistä glykeemisistä vaikutuksista riippumatta. J Am Soc Nephrol 2016;28:1-8.
- Lexi-Drugs. Lexicomp. Wolters Kluwer Health, Inc. Riverwoods, IL. Saatavilla osoitteessa: http://online.lexi.com. Viitattu 31.10.2016.
- Micromedex Solutions. Truven Health Analytics, Inc. Ann Arbor, MI. Saatavilla osoitteessa: http://www.micromedexsolutions.com. Accessed Oct. 31, 2016.
- James PA, Oparil S, Carter BL, et al. 2014 evidence-based guideline for the management of high blood pressure in adults. JAMA 2014;311:507-520.
- King P, Peacock I, Donnelly R. The United Kingdom Prospective Diabetes Study (UKPDS): Kliiniset ja terapeuttiset vaikutukset tyypin 2 diabetekseen. Br J Clin Pharmacol 1999;48:643-648.
- Jackevicius CA, Wong J, Aroustamian I, et al. Rates and predictors of ACE inhibitor discontinuation subsequent to elevated serum creatinine: A retrospective cohort study. BMJ Open 2014;4:e005181.
- Mauer M, Zinman B, Gardiner R, et al. Renal and retinal effects of enalapril and losartan in type 1 diabetes. N Engl J Med 2009;361:40-51.
- Bilous R, Chaturvedi N, Sjølie AK, et al. Kandesartaanin vaikutus mikroalbuminuriaan ja albumiinin erittymisnopeuteen diabeteksessa: Kolme satunnaistettua tutkimusta. Ann Intern Med 2009;151:11-20.
- Haller H, Ito S, Izzo JL Jr, et al. Olmesartan for the delay or prevention of microalbuminuria in type 2 diabetes. N Engl J Med 2011;364:907-917.
- Makani H, Bangalore S, Desouza KA, ym. reniini-angiotensiinijärjestelmän kaksoiseston teho ja turvallisuus: Satunnaistettujen tutkimusten meta-analyysi. BMJ 2013;346:f360.
- Miao Y, Ottenbros SA, Laverman GD, et al. Virtsahapon vähentämisen vaikutus munuaistuloksiin losartaanihoidon aikana: A post-hoc analysis of the reduction of the endpoints in non-insulin-dependent diabetes mellitus with the Angiotensin II Antagonist Losartan Trial. Hypertension 2011;58:2-7.
- Lewis EJ, Hunsicker LG, Clarke WR, ym. angiotensiinireseptoriantagonistin irbesartaanin renoprotektiivinen vaikutus potilailla, joilla on tyypin 2 diabeteksesta johtuva nefropatia. N Eng J Med 2001;354:851-860.
- Adler A, Casula A, Steenkamp R, ym. glykemian ja kuolleisuuden välinen yhteys munuaisten korvaushoitoa saavilla diabeetikoilla Isossa-Britanniassa Diabetes Care 2014;37:1304-1311.
- Sharma SG, Bomback AS, Radhakrishnan J, ym. diabetesta sairastavilla potilailla todettujen munuaisbiopsialöydösten nykyaikainen kirjo. Clin J Am Soc Nephrol 2013;8:1718-1724.
- Smart NA, Dieberg G, Ladhani M, Titus T. Early referral to specialist nephrology services for preventing the progression to end-stage kidney disease. Cochrane Database Syst Rev 2014;6:CD007333.
- Boulton AJM, Gries FA, Jervell JA. Guidelines for the diagnosis and outpatient management diabetic peripheral neuropathy. Diabet Med 1998;15:508-514.
- O’Brien PD, Hinder LM, Sakowski SA, Feldman EL. ER-stressi diabeettisessa perifeerisessä neuropatiassa: Uusi terapeuttinen kohde. Antioxid Redox Signal 2014;21:621-633.
- Cameron NE, Cotter MA. Pro-inflammatoriset mekanismit diabeettisessa neuropatiassa: Focus on the nuclear factor kappa B pathway. Curr Drug Targets 2008;9:60-67.
- Tesfaye S, Chaturvedi N, Eaton SE, et al. Vascular risk factors and diabetic neuropathy. N Engl J Med 2005;352:341-350.
- Wiggin TD, Sullivan KA, Pop-Busui R, et al. Elevated triglycerides correlated with progression of diabetic neuropathy. Diabetes 2009;58:1634-1640.
- Stella P, Ellis D, Maser RE, Orchard TJ. Kardiovaskulaarinen autonominen neuropatia (ekspiraation ja inspiraation suhde) tyypin 1 diabeteksessa. Esiintyvyys ja ennustetekijät. J Diabetes Complications 2000;14:1-6.
- Witten DR, Tesfaye S, Chaturvedi N, et al. Risk factors for cardiac autonomic neuropathy in type 1 diabetes mellitus. Diabetologia 2005;48:164-171.
- Diabetes Control and Complication Trial (DCCT) Research Group. Diabeteksen intensiivisen hoidon vaikutus hermojohtumiseen Diabetes Control and Complications Trial -tutkimuksessa. Ann Neurol 1995;38:869-880.
- Diabetes Control and Complication Trial (DCCT) Research Group. Intensiivisen diabeteshoidon vaikutus autonomisen hermoston toiminnan mittareihin Diabetes Control and Complications Trial (DCCT) -tutkimuksessa. Diabetologia 1998;41:416-423.
- Edwards JL, Vincent AM, Cheng HT, Feldman EL. Diabeettinen neuropatia: Mechanisms to management. Pharmacol Ther 2008;120:1-34.
- Vincent AM, Callaghan BC, Smith AL, Feldman EL. Diabeettinen neuropatia: Cellular mechanisms a therapeutic target. Nat Rev Neurol 2011;7:573-583.
- Kellogg AP, Wiggin T, Larkin D, et al. Suojaavat vaikutukset syklo-oksygenaasi-2 -geenin inaktivoinnilla perifeeristen hermojen toimintahäiriöitä ja epidermaalisten hermosäikeiden menetystä vastaan kokeellisessa diabeteksessa. Diabetes 2007;56:2997-3005.
- Callaghan BC, Cheng HT, Stables CL, et al. Diabeettinen neuropatia: Clinical manifestations and current treatments. Lancet Neurol 2012;11:521-534.
- Boulton AJM, Kirsner RS, Vileikyte L. Kliininen käytäntö: Neuropaattiset diabeettiset jalkahaavat. N Eng J Med 2004;351:48-55.
- Boulton AJM, Vinik AI, Arezzo JC, et al. Diabetic neuropathies: A statement by the American Diabetes Association. Diabetes Care 2005;28:956-962.
- Boulton AJM, Armstrong DG, Albert SF, et al. Comprehensive foot examination and risk assessment: A report of the task force of the foot care interest group of the American Diabetes Association, with endorsement by the American Association of Clinical Endocrinologists. Diabetes Care 2008;31:1679-1685.
- Tesfaye S, Boulton AJ, Dyck PJ, et al. Diabetic neuropathies: Update on definitions, diagnostic criteria, estimation of severity, and treatments. Diabetes Care 2010;33:2285-2293.
- Dyke PJ, Albers JW, Andersen H, et al. Diabeettiset polyneuropatiat: Update on research definition, diagnostic criteria and estimation of severity. Diabetes Metab Res Rev 2011;27:620-628.
- Freeman R. Not all neuropathy is diabetes is of diabetic etiology: Diabeettisen neuropatian erotusdiagnostiikka. Curr Diabe Rep 2009;9:423-431.
- Balducci S, Iacobellis G, Parisi L, et al. Exercise training can modify the natural history of diabetic peripheral neuropathy. J Diabetes Complications 2006;20:216-223.
- Bril V, England J, Franklin GM, et al. Evidence-based guideline: Treatment of painful diabetic neuropathy. Report of the American Academy of Neurology, the American Association of Neuromuscular and Electrodiagnostic Medicine, and the American Academy of Physical Medicine and Rehabilitation. Neurology 2011;76:1758-1765.
- Dowell D, Haegerich TM, Chou R. CDC Guideline for prescribing opioids for chronic pain – United States 2016. MMWR Recomm Rep 2016;65:1-49.
- Tesfaye S, Wilhelm S, Lledo A, ym Duloxetine and pregabalin: High-dose monotherapy or their combination? ”COMBO-DN-tutkimus” – monikansallinen, satunnaistettu, kaksoissokkoutettu, rinnakkaisryhmätutkimus diabeettista perifeeristä neuropaattista kipua sairastavilla potilailla. Pain 2013;154:2616-2625.
- Ahn AC, Bennani T, Freeman R, et al. Two styles of acupuncture for treating painful diabetic neuropathy – a pilot randomized control trial. Acupunct Med 2007;25:11-17.
- Garrow A, Xing M, Vere J, et al. Akupunktion rooli diabeettisen kivuliaan neuropatian (DPN) hoidossa: A pilot RCT. Acupunct Med 2014;32:242-249.
- Ziegler D, Nowak H, Kempler P, et al. Treatment of symptomatic diabetic polyneuropathy with the antioxidant alpha-lipoic acid: A meta-analysis. Diabet Med 2004;21:114-121.
- Ziegler D, Low PA, Litchy WJ, et al. Efficacy and safety of antioxidant treatment with alpha-lipoic acid over 4 years in diabetic polyneuropathy: The NATHAN 1 trial. Diabetes Care 2011;34:2054-2060.
- Kuwabara S, Ogawara K, Harrori T, et al. The acute effects of glycemic control on axonal excitability in human diabetic nerves. Intern Med 2002;41:360-365.
- Peltier A, Goutman SA, Callaghan BC. Kivulias diabeettinen neuropatia. BMJ 2014;348:g1799.
- Soykan I, Sivri B, Sarosiek I, et al. Demografia, kliiniset ominaisuudet, psykologiset ja väärinkäyttöprofiilit, hoito ja pitkäaikaisseuranta potilailla, joilla on gastropareesi. Dig Dis Sci 1998;43:2398-2404.
- Camilleri M, Bharucha AE, Farrugia G. Diabeettisen gastroareesin epidemiologia, mekanismit ja hoito. Clin Gastroenterol Hepatol 2011;9:5-12.
- Shin AS, Camilleri M. Diagnostic assessment of diabetic gastroparesis. Diabetes 2013;62:2667-2673.
- Hasler WL, Wilson L, Parkman HP, Lee L. Vatsakivun merkitys gastropareesin oireena: Suhde kliinisiin tekijöihin, taudin vaikeusasteeseen, elämänlaatuun, mahalaukun pidätyskykyyn ja lääkkeiden käyttöön. Gastroenterology 2010;138. doi: 10.1016/S0016-5085(10)62131-2.
- Choung RS, Locke GR 3rd, Schleck CD, et al. Risk of gastroparesis in subjects with type 1 and 2 diabetes in the general population. Am J Gastroenterol 2012;107:82-88.
- Maleki D, Locke GR III, Camilleri M, et al. Gastrointestinal tract symptoms among persons with diabetes mellitus in the community. Arch Intern Med 2000;160:2808-2816.
- Bytzer P, Talley NJ, Leemon M, et al. Prevalence of gastrointestinal symptoms associated with diabetes mellitus: A population-based survey of 15,000 adults. Arch Intern Med 2001;161:1989-1996.
- Jones KL, Russo A, Berry MK, et al. A longitudinal study of gastric emptying and upper gastrointestinal symptoms in patients with diabetes mellitus. Am J Med 2002;113:449-455.
- Gaber AO, Hathaway DK, Abell T, et al. Improved autonomic and gastric function in pancreas-kidney vs. kidney-alone transplantation contributes to quality of life. Transplant Proc 1994;26:515-516.
- Punkkinen J, Färkkilä M, Mätzke S, et al. Upper abdominal symptoms in patients with Type 1 diabetes: Ei liity autonomisen neuropatian aiheuttamaan mahalaukun tyhjenemisen häiriöön. Diabet Med 2008;25:570-577.
- Schvarcz E, Palmer M, Aman J, et al. Physiological hyperglycemia slows gastric emptying in normal subjects and patients with insulin-dependent diabetes mellitus. Gastroenterology 1997;113:60-66.
- Miller G, Palmer KR, Smith B, et al. Smoking delays gastric emptying of solids. Gut 1989;30:50-53.
- Rao AS, Camilleri M. Katsausartikkeli: Metoklopramidi ja tardiivi dyskinesia. Aliment Pharmacol Ther 2010;31:11-19.
- Patterson D, Abell T, Rothstein R ym. domperidonin ja metoklopramidin kaksoissokkoutettu monikeskuksinen vertailu sellaisten diabeetikkopotilaiden hoidossa, joilla on gastropareesin oireita. Am J Gastroenterol 1999;94:1230-1234.
- Arts J, Holvoet L, Caenepeel P, ym. kliininen tutkimus: Satunnaistettu, kontrolloitu crossover-tutkimus botuliinitoksiinin intrapylorisesta injektiosta gastropareesissa. Aliment Pharmacol Ther 2007;26:1251-1258.
- Friedenberg FK, Palit A, Parkman HP, et al. Botulinum toxin A for the treatment of delayed gastric emptying. Am J Gastroenterol 2008;103:416-423.
- Humanitarian Device Exemption for Enterra Device. Fed Reg 2000;65:78495-78496.
- O’Grady G, Egbuji JU, Du P, et al. High-frequency gastric electrical stimulation for the treatment of gastroparesis: A meta-analysis. World J Surg 2009;33:1693-1701.
- Reddymasu SC, Sarosiek I, McCallum RW. Vaikea gastropareesi: Lääkehoito vai mahalaukun sähköinen stimulaatio. Clin Gastroenterol Hepatol 2010;8:117-124.
- McCallum RW, Dusing RW, Sarosiek I, et al. Mechanisms of symptomatic improvement after gastric electrical stimulation in gastroparetic patients. Neurogastroenterol Motil 2010;22:161-167.
- Douloumpakas I, Pyrpasopoulou A, Triantafyllou A, et al. Prevalence of musculoskeletal disorders in patients with type 2 diabetes mellitus: A pilot study. Hippokratia 2007;11:216-218.
- Rosenbloom AL, Silverstein JH, Lezotte DC. Nivelten rajoittunut liikkuvuus lapsuusiän diabetes mellituksessa viittaa lisääntyneeseen mikrovaskulaarisen sairauden riskiin. N Engl J Med 1981;305;191-194.
- Lister DM, Graham-Brown RAC, Burden AC. Diabeettisen cheiroartropatian resoluutio. Br Med J 1986;293:1537.