Arvelisin, että sinulla on jo viinihapon empiirinen kaava ja että sinun on löydettävä sen molekyylikaava käyttämällä sen moolimassaa.
Emme oleta, että lähtökohtaisesti viinihapon empiirinen kaava näyttää tältä
#”C”_2 ”H”_3 ”O”_3 -># empiirinen kaava
Nyt yhdisteen empiirinen kaava kertoo pienimmän kokonaislukusuhteen, joka on olemassa yhdisteen alkuaineiden atomien välillä.
Tässä tapauksessa tiedät, että molekyylikaava, joka kertoo sinulle tarkan määrän atomeja, jotka muodostavat kyseisen yhdisteen molekyylin, sisältää
#color(black)(”2 atomia C:tä” color(red)(” jokaista ”) {(”3 atomia H:ta”),(”3 atomia O:ta”) :}#
Pohjimmiltaan etsit moninkertaista empiiristä kaavaa.
Viinihapon moolimassan sanotaan olevan #”150 g mol”^(-1)#. Tavoitteenasi on määrittää sen empiirisen kaavan moolimassa ja käyttää sitten tätä arvoa yhdisteen molekyylikaavan määrittämiseen.
Tässä tapauksessa saat
#2 xx ”12.011 g mol”^(-1) ””color(blue)(+)#
#3 xx ”1.00794 g mol”^(-1)#
#3 xx ”15.9994 g mol”^(-1)#
#color(white)(aaaaaaaaaaaaaaaaaaaaaaaa)/color(white)(aaaaaaaaaaaaaaaaaaaaaaaa)#
#”75.044 g mol”^(-1) -> #empiirisen kaavan moolimassa
Jos siis empiirisen kaavan moolimassa on #”75.044 g mol”^(-1)#, ja viinihapon moolimassa on #”150 g mol”^(-1)#, tästä seuraa, että sinun on kerrottava empiirinen kaava
#(150 color(red)(cancel(color(black)(”g mol”^(-1)))))/(75.044color(red)(cancel(color(black)(”g mol”^(-1))))) = 1.999 ~~ color(red)(2)#
molekyylikaavan saamiseksi. Tämä tarkoittaa, että viinihapon molekyylikaava on
#(”C”_2 ”H”_3 ”O”_3)_color(red)(2) implikoi color(green)(|bar(ul(color(white)(a/a) ”C”_4 ”H”_6 ”O”_6color(white)(a/a)|)))#
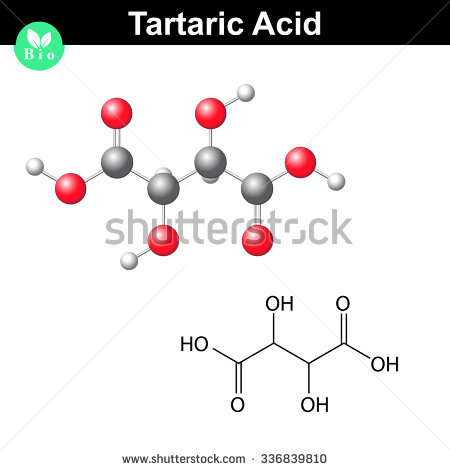
Tältä näyttää viinihappomolekyyli