Osallistuin vuoden 2013 American Academy of Ophthalmologyn kokouksessa keskusteluun, jossa käsiteltiin geneeristen lääkkeiden ja merkkilääkkeiden käytön etuja ja haittoja. Minua pyydettiin argumentoimaan merkkilääkkeiden puolesta, mutta kuten useimmissa väittelyissä, on liiallista yksinkertaistamista asettua sokeasti jommallekummalle puolelle. Todellisuus on monimutkaisempi. Geneeriset lääkkeet ovat kustannuksiltaan edullisia, mutta joskus ne eivät tarjoa samoja hoitomäärittelyjä tai tuloksia kuin merkkilääkkeet, vaikka elintarvike- ja lääkevirasto pyrkiikin varmistamaan, että näin on.
Tässä haluaisin puhua joistakin tavoista, joilla rinnakkaislääkkeet voivat poiketa niiden korvaamista merkkilääkkeistä, ja siitä, mitä kliinikkojen on oltava varuillaan.
Bioekvivalenssikysymys
Uuden, ”innovaattorilääkkeen” markkinoille saattamiseen vaadittavat esteet eroavat olennaisesti geneerisen seuraajalääkkeen esteistä. Tämä on tietysti osasyy siihen, että merkkilääke maksaa enemmän. Alkuperäisen innovatiivisen lääkkeen turvallisuus ja tehokkuus on osoitettava kliinisissä tutkimuksissa, kun taas geneerisen lääkkeen on osoitettava vain bioekvivalenssi.
Vaikka bioekvivalenssi kuulostaa siltä, että se saattaisi edellyttää biologisten tutkimusten tekemistä, FDA määrittelee sen niin, että sinun on osoitettava, että geneerisen versiosi ainesosat ovat tarkka kopio alkuperäisen lääkkeen ainesosista, mukaan lukien sekä vaikuttavat aineet että apuaineet. (Jos vaikuttavat aineet ja apuaineet eivät ole identtisiä, lääkettä ei pidetä rinnakkaislääkkeenä, vaan sen on läpäistävä FDA:n tavanomainen hyväksyntä aivan kuten minkä tahansa uuden lääkkeen). Lähtökohtana on, että tämä saa aikaan sen, että geneerisellä lääkkeellä on sama turvallisuus ja teho kuin merkkilääkkeellä.
Valitettavasti ajatus siitä, että geneeriset lääkkeet ovat samanarvoisia kuin merkkilääkkeet, koska niiden ainesosat ovat samat, ei välttämättä pidä paikkaansa. Monet tekijät, jotka vaikuttavat ajankohtaisen lääkkeen tehoon, ovat riippumattomia pullon sisällä olevista ainesosista. Esimerkiksi:
– Pullon materiaalilla on merkitystä. Monien merkkilääkkeiden ainesosat on sovitettu yhteen käytettävän pullon materiaalin kanssa. Näin oli varmasti latanoprostin kohdalla, jossa yhteensopivuus pullomateriaalin kanssa oli suuri osa tutkimus- ja kehitysprosessia, kun Xalatania tuotiin markkinoille. FDA ei tutki tätä suoraan.
– Pullon muoto ja koko vaikuttavat käyttöön. Innovaatiolääketutkimuksissa ei testata vain lääkettä vaan myös pulloa, jossa se toimitetaan potilaille, joten pullon muodon ja koon vaikutus on otettu huomioon. Geneeristen lääkkeiden valmistajien ei kuitenkaan tarvitse kopioida pullon muotoa ja kokoa, ja tämä voi vaikuttaa siihen, miten helposti potilaat voivat käyttää lääkettä.
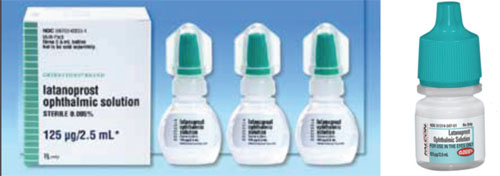
Yksi asia, joka voi aiheuttaa sekaannusta siirryttäessä merkkilääkkeestä geneeriseen lääkkeeseen tai geneerisestä lääkkeestä toiseen, on korkin muodon ja värin ero.
Xalatan on esimerkiksi litteässä, pienessä pullossa, jonka puristaminen vaatii tiettyä vaivannäköä ja hienovaraisuutta tipan tiputtamiseksi. Sen sijaan jotkut latanoprostin geneeriset pullot ovat pyöreitä ja jäykempiä, jolloin potilaan on vaikeampi puristaa pulloa. (Katso esimerkit viereisellä sivulla.) Monet potilaistamme ovat iäkkäitä ja heillä on fyysisiä rajoitteita. Jos he ovat tottuneet puristamaan tiettyä pulloa, joka on litteä ja hieman vähemmän jäykkä, ja sitten he vaihtavat pulloon, joka on pyöreä ja jäykempi, levitysprosessi – ja lääkityksen noudattaminen – saattaa olla erilainen kuin silloin, kun he käyttivät edellistä pulloa. Koska kukin geneeristen lääkkeiden valmistaja valitsee pullon muodon ja koon, potilaat saattavat joskus saada lääkkeen litteässä pullossa ja joskus pyöreässä pullossa. Tämä on aiheuttanut paljon hämmennystä potilaiden keskuudessa.
– Korkin väri ei aina täsmää. Silmälääkkeiden pullonkorkkien värit on tarkoitus sovittaa yhteen lääkeryhmän perusteella. FDA pyrkii varmistamaan, että väri on oikea, mutta on ollut tapauksia, joissa erivärinen korkki on lipsahtanut läpi. Tämän seurauksena geneerisen lääkkeen pullonkorkin väri (samoin kuin muoto ja koko) on joskus erilainen kuin merkkilääkkeen (ks. esimerkki edellä). Tämä aiheuttaa paljon sekaannusta, kun potilaat yrittävät muistaa, mikä useista tipoista heidän pitäisi ottaa milloinkin.
Jopa jos potilas ei ole koskaan käyttänyt merkkilääkettä, jonka korkin väri on oikea, muuttunut väri on silti ongelma; uusi korkin väri saattaa itse asiassa olla samanvärinen kuin jokin toinen lääkitys, jota potilas käyttää. Esimerkiksi prostaglandiinianalogipulloissa pitäisi olla tiilenpunaiset korkit. Jos potilaasi käyttää geneeristä versiota, jonka pullossa on valkoinen korkki, hän saattaa sekoittaa sen muihin lääkeryhmiin, joissa pitäisi olla valkoinen korkki.
– Jos huomaat esimerkin vääränlaisesta korkin väristä, FDA on sanonut haluavansa kuulla siitä, jotta voidaan ryhtyä toimenpiteisiin poikkeaman korjaamiseksi.
– Tipan koko voi olla erilainen. Tällä hetkellä markkinoilla olevat ajankohtaiset pisarapullot antavat 30-50 µl:n annoksen pisaraa kohti. Valitettavasti merkkivalmisteiden ja geneeristen valmisteiden välillä voi olla paljon vaihtelua yksinkertaisesti siksi, että kärjessä voi olla suurempi tai pienempi reikä. Tämä voi luonnollisesti vaikuttaa siihen, kuinka paljon lääkettä todella pääsee silmään; se voi olla vähemmän tai enemmän.
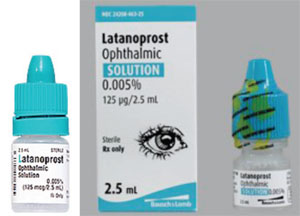
Toinen ongelma on pullon muodon ja jäykkyyden erot, jotka voivat vaikeuttaa tippojen levittämistä iäkkäälle potilaalle. Esimerkiksi xalatan on litteässä pullossa; monet lääkkeen rinnakkaisvalmisteet ovat pyöreissä pulloissa, joita on vaikeampi puristaa.
Mielenkiintoisempaa on, että markkinoille tuli timololin rinnakkaisvalmiste, jonka kärjessä ei ollut lainkaan reikää; potilaan piti puhkaista kärki saadakseen lääkkeen ulos, samaan tapaan kuin superliimatuubissa. Tämä aiheutti hämmennystä monissa potilaissa; jotkut eivät ymmärtäneet, että heidän piti tehdä näin, ja yrittivät silti käyttää tippoja. He luulivat laittavansa tipan, mutta he eivät olleet koskaan avanneet pulloa, joten mitään ei tullut ulos. Toiset taas luulivat, että pullo oli viallinen tai tyhjä. Lisäksi itse tehty reikä saattoi lopulta olla minkä kokoinen tahansa, mikä vaikutti annokseen, ja reiän tekoprosessi saattoi helposti vaarantaa sisällön steriiliyden.
Kaikki nämä näkökohdat – pullon materiaali, muoto ja koko, korkin väri ja tippa-aukon halkaisija – ovat hyvin tärkeitä sekä lääkärille että potilaalle. Valitettavasti nämä näkökohdat saatetaan jättää huomiotta, koska keskitytään pyrkimykseen osoittaa bioekvivalenssi.
– Potilaan rinnakkaislääke voi näyttää erilaiselta kuukaudesta toiseen. Tämä on toinen geneeristen lääkkeiden valitettava sivuvaikutus. Se johtuu siitä, että tietyn geneerisen lääkkeen valmistajia voi olla useita, ja jokaisella voi olla erilainen pullo. Esimerkiksi latanoprostin rinnakkaisvalmisteita on tällä hetkellä Yhdysvaltain markkinoilla kuudesta kahdeksaan eri valmistajaa. Tietyn apteekin myymä lääke voi vaihtua, koska CVS:n, Walgreensin tai Walmartin kaltaiset ketjut valitsevat yleensä sen valmistajan, joka tekee apteekkiryhmälle parhaan tarjouksen tiettynä ajankohtana. Tämän seurauksena apteekki saattaa vaihtaa tarjoamaansa geneeristä lääkettä, kun toinen geneeristen lääkkeiden valmistaja tekee alemman tarjouksen. Vaikka potilas kävisikin samassa apteekissa, hän voi saada lääkkeen eri geneerisiä versioita eri aikoina. Tämä voi olla hämmentävää, jos pullot näyttävät ja/tai käyttäytyvät eri tavalla. (Sietokyvyssä ja IOP:n hallinnassa saattaa jopa olla eroja.)
Pakkausseloste
Nykyiset säännöt estävät valmistajia varoittamasta lääkäreitä tai potilaita, vaikka geneerisessä lääkkeessä osoittautuisikin olevan ongelmia. On olemassa sääntö, jonka mukaan geneeristen lääkkeiden valmistajien on liitettävä mukaan tarkka kopio pakkausselosteesta, joka sisältyy innovaattorilääkkeen mukana. Vaikka tämän säännön tarkoituksena oli heijastaa ajatusta siitä, että lääkkeet ovat biologisesti samanarvoisia, sen tahaton sivuvaikutus on ollut se, että geneeristen lääkkeiden valmistajille ei ole asetettu samoja huolellisuusvaatimuksia ja taakkaa turvallisuuden varmistamisesta kuin mitä edellytämme merkkituotteiden valmistajilta.
Tämän seurauksena, jos geneerinen valmistaja tuo lääkkeen markkinoille ja huomaa joitakin sivuvaikutuksia tai haittavaikutuksia, joita esiintyy geneerisellä tuotteella, se ei saa muuttaa pakkausselostetta varoittaakseen lääkäreitä ja potilaita ongelmasta. Lisäksi tämä sääntö saattaa itse asiassa vähentää geneeristen valmistajien motivaatiota valvoa tuotteitaan asianmukaisesti; loppujen lopuksi ongelman ilmaantuessa ei ole oikeudenkäynnin uhkaa.
Onneksi tämä asia on tullut FDA:n tietoon. Marraskuussa 2013 FDA ehdotti sääntöä, jonka mukaan geneeristen lääkkeiden valmistajat voisivat päivittää merkintöjään, jos ne saavat tietoa mahdollisista turvallisuusongelmista. Jos tämä hyväksytään, se edistää pitkälle potilaidemme turvallisuuden varmistamista.
Importoidut rinnakkaislääkkeet
Toinen rinnakkaislääkkeisiin liittyvä ongelma on se, että monet niistä valmistetaan Yhdysvaltojen ulkopuolella, jossa laadunvalvonta on joskus ollut todellinen huolenaihe. Ongelmat ovat vaihdelleet lääkkeistä löytyneistä salaperäisistä epäpuhtauksista, ainesosien puutteellisesta yhteensovittamisesta suoranaisiin vilpillisiin formulaatioihin, joilla ei ole mitään hyödyllistä tarkoitusta (mikä voi joissakin tapauksissa aiheuttaa potilaille vakavia haittoja).
Todellisuudessa geneeriset lääkkeet eivät välttämättä ole samoja kuin merkkilääkkeet – vaikka ne olisivat täyttäneet FDA:n bioekvivalenssivaatimuksen. Tämä tarkoittaa, että geneerisiä lääkkeitä käytettäessä taakka turvallisuuden ja tehon varmistamisesta on meillä ja potilailla.
New York Timesin mukaan Intian lääketeollisuus toimittaa tällä hetkellä 40 prosenttia Yhdysvalloissa kulutetuista käsikauppalääkkeistä ja geneerisistä reseptilääkkeistä. Monet sen tehtaista ovat maailmanluokkaa ja ”käytännössä erottamattomia” yhdysvaltalaisista tuotantolaitoksista (Timesin mukaan), jotka tuottavat korkealaatuisia ja luotettavia lääkkeitä. Samaan aikaan Maailman terveysjärjestö WHO on kuitenkin arvioinut, että joka viides Intiassa valmistettu lääke on väärennös. (Vastaavia ongelmia on raportoitu muissa maissa, kuten Kiinassa, valmistetuista lääkkeistä.)
Ryhmämme teki pari vuotta sitten tutkimuksen, jossa verrattiin Intiassa valmistettua latanoprostia Xalataniin. Havaitsimme, että vaikuttavien aineiden stabiilisuus ei ollut sama ajan kuluessa tai kuumennettaessa. Lisäksi löysimme epäpuhtauksia kaikista tuontipulloista, mukaan lukien mikroskooppisia säikeitä, jotka muistuttivat narua, ja mitä kutsuimme ”ufoiksi”.
Pointti on se, että valmistuskäytäntöjen valvonta, joka tapahtuu ulkomailla muissa kuin Yhdysvaltoihin sijoittautuneissa yrityksissä, erityisesti yrityksissä, joilla ei ole tuotemerkillä varustettuja lääkkeitä markkinoilla, ei vain ole samanlaista.
Jotkut lääkärit saattavat olettaa, että tällaiset maahantuodut lääkkeet ovat ongelma vain silloin, kun potilaat ostavat lääkkeitä Yhdysvaltojen ulkopuolelta internetin kautta säästääkseen rahaa, mutta todellisuus on se, että näitä maahantuotuja lääkkeitä on yhä enemmän saatavilla täällä. Timololin ja travoprostin intialaiset formulaatiot ovat tällä hetkellä saatavilla yhdysvaltalaisten jakelijoiden kautta, ja muita lääkkeitä, kuten tulehduskipulääkkeitä, on pian saatavilla. On selvää, että monet yritykset Yhdysvaltojen ulkopuolella tuottavat korkealaatuisia rinnakkaislääkkeitä; huolenaiheena on, että muutamat niistä eivät tuota. Tämä asettaa lääkäreille ja potilaille taakan varmistaa, että tietty rinnakkaisvalmiste on turvallinen ja tehokas. (Ainakin Yhdysvaltojen sisällä saatavilla olevat lääkkeet ovat käyneet läpi FDA:n bioekvivalenssiprosessin; lääkkeet, joita jotkut potilaat ostavat ulkomailta internetin kautta, eivät välttämättä ole käyneet läpi, mikä tekee niistä vielä epäilyttävämpiä.)
Klinikkastrategiat
Koska kaikki käsittelemämme muuttujat ovat muuttujia, lääkäreiden on pysyttävä tarkoin perillä siitä, mitä potilaille tapahtuu, kun he vaihtavat merkkivalmisteesta rinnakkaisvalmisteeseen tai siirtyvät rinnakkaisvalmisteesta toiseen. Meidän on oltava valppaita varmistaaksemme, että silmänpaineen hallinta ei horju ja että potilaat eivät saa uusia merkkejä ja oireita lääkityksen sietämättömyydestä.
Tässä on muutamia asioita, joita voit tehdä suojellaksesi potilaitasi (ja käytäntöäsi):
– Pyydä potilaita tuomaan tippansa. Pyydän potilaitani tekemään näin riippumatta siitä, mitä lääkkeitä he käyttävät, ja monet heistä tekevät niin. Tämä antaa minulle mahdollisuuden kirjata, minkä geneerisen valmistajan lääkkeitä he käyttävät, ja tehdä parhaani pitääkseni sitä silmällä, jotta voin etsiä mahdollista yhteyttä, jos ongelmia ilmenee tai jokin asia muuttuu.
– Pyydä potilaita, jotka vaihtavat uuteen geneeriseen valmisteeseen, palaamaan klinikalle aikaisemmin kuin muuten pyytäisit heitä palaamaan. Näin voit varmistua siitä, että mitään ei-toivottuja seurauksia ei tapahdu. Pysy valppaana tehon muutosten tai uusien merkkien tai oireiden varalta.
– Jos huomaat, että potilaan siirtyessä geneeriseen lääkkeeseen ilmenee ongelmia, ilmoita asiasta FDA:lle. Muista, että tässä tilanteessa lääkärin tehtäväksi jää varmistaa, että rinnakkaislääke on todella turvallinen ja tehokas.
– Jos potilas ei pärjää yhtä hyvin rinnakkaislääkkeellä, ponnistele saadaksesi vakuutuksenantajan korvaamaan merkkilääkkeen. Olen kohdannut potilaita, jotka sietivät merkkilääkettä mutta joiden oli vaikea sietää geneeristä lääkettä sivuvaikutusten, kuten punoituksen tai ärsytyksen, vuoksi. Näissä tapauksissa kirjoitamme vakuutusyhtiölle ja teemme kaikkemme saadaksemme potilaan siirtymään takaisin merkkivalmisteeseen.
Merkkilääkkeessä voi esimerkiksi olla tietty säilöntäaine, kun taas geneerisessä valmisteessa on vaihtoehtoinen säilöntäaine, jolle potilas on herkkä. Travatan Z on Alconin valmistama merkkilääke, joka sisältää säilöntäainetta SofZia bentsalkoniumkloridin sijaan; geneeriset versiot sisältävät BAK:ta, koska niiden bioekvivalenssi perustui travoprostin vanhempaan versioon. Jos apteekki vaihtaa BAK:lle allergisen potilaan geneeriseen lääkkeeseen, siitä tulee ongelma.
Valitettavasti, kun vastaanotamme vastaanotollamme tuhansia potilaita vuodessa, on todella vaikeaa varmistaa, että voitamme taistelun jokaisen potilaan kohdalla, joka päätyy tähän tilanteeseen. Me kuitenkin pyrimme siihen.
Kuormitus on meidän harteillamme
Generaalilääkkeet ovat tulleet jäädäkseen, ja niistä on tulossa merkittävä osa kaikkien sairauksien hoitoa, ei vain silmälääketieteessä. Ne ovat yleensä turvallisia ja tehokkaita, ja ne voivat tuottaa kustannussäästöjä sekä potilaille että terveydenhuoltojärjestelmälle yleensä. Älkää erehtykö – olen suuri kustannusten leikkaamisen kannattaja. Jos löydämme turvallisen tavan leikata kustannuksia ja säilyttää samalla erinomainen hoito, kannatan sitä. Meidän on pidettävä silmällä yhtälön toista osaa.
Käytän itse geneerisiä lääkkeitä päivittäin, ja valtaosa potilaistani käyttää nykyään geneerisiä lääkkeitä. He voivat melkein kaikki hyvin, heidän silmänpohjansa on hyvin hallinnassa ja he sietävät lääkkeitä hyvin. En siis todellakaan sano, että meidän pitäisi välttää geneeristen lääkkeiden käyttöä. Todellisuudessa geneeriset lääkkeet eivät kuitenkaan välttämättä ole samoja kuin merkkilääkkeet, vaikka ne täyttäisivätkin FDA:n bioekvivalenssivaatimuksen. Tämä tarkoittaa, että geneerisiä lääkkeitä käytettäessä taakka turvallisuuden ja tehokkuuden varmistamisesta on meidän ja potilaidemme vastuulla. KATSAUS
Tohtori Kahook on The Slater Family Endowed Chair in Ophthalmology ja kliinisen ja translaatiotutkimuksen varapuheenjohtaja Coloradon yliopiston lääketieteellisessä tiedekunnassa Denverissä. Hän on Allerganin ja Alconin konsultti ja saa tutkimustukea.