Introduzione
La sindrome del midollo ancorato (TCS) è un disturbo neurologico dello sviluppo causato da un conus medullaris anormalmente basso. Si presenta tipicamente nell’infanzia, ma può persistere senza essere rilevato fino all’età adulta, e può essere associato a un lipoma intradurale. I pazienti con anomalie coesistenti (per esempio, mielomeningocele) e sintomi clinici evidenti (per esempio, debolezza progressiva delle gambe, incontinenza urinaria) possono richiedere un trattamento chirurgico. L’obiettivo della chirurgia è quello di slegare il midollo spinale per alleviare lo stiramento del midollo spinale. Tuttavia, le indicazioni per la chirurgia rimangono controverse (1).
Al contrario, la fistola arterovenosa spinale durale (SDAVF) è una condizione acquisita. È la malformazione vascolare più comune nella colonna vertebrale negli adulti. Si forma nel forame neurale da un’anomala connessione diretta tra l’arteria durale (che rifornisce il manicotto della radice durale e la dura spinale adiacente) e la vena midollare (che drena il plesso venoso coronale) (2, 3).
Può presentarsi con dolore alla schiena e deficit neurologico progressivo. Un SDAVF richiede tipicamente una gestione chirurgica o endovascolare.
La coincidenza di TCS, lipoma (o lipomielomeningocele), e un SDAVF a livello sacrale è molto rara. In questa comunicazione riportiamo due pazienti di questo tipo. (4-6).
Materiale del caso
Caso 1
Una donna di 30 anni si è presentata con una storia di 10 anni di dolore nella colonna lombosacrale; aveva avuto radiazioni casuali ad entrambi gli arti inferiori. Dopo il suo primo parto, ha sviluppato un dolore alla schiena. La risonanza magnetica ha dimostrato un midollo legato a livello di L4 e un lipoma del filum terminale. La risonanza magnetica ha anche mostrato vene tortuose sulla superficie del midollo spinale (Figura 1C). Nove anni dopo, durante la seconda gravidanza, ha notato debolezza e perdita sensoriale, squilibrio con incontinenza urinaria e fecale. All’ammissione, aveva una debolezza bilaterale di flessione plantare (grado 4 secondo il sistema modificato del Medical Research Council) e una sensazione ridotta nelle regioni glutee e nelle gambe, e una risposta plantare. I segni di Babinski e Rossolimo erano presenti bilateralmente. Una risonanza magnetica ripetuta ha rivelato cambiamenti intraspinali T2 iperintensivi nella spina toracica e nel cono (Figure 1A,B,D). Questi cambiamenti erano coerenti con il deficit neurologico e, dopo l’esclusione di malattie demielinizzanti infiammatorie, sulla base di una risonanza magnetica cerebrale e di un test per gli anticorpi dell’aquaporina-4, è stata diagnosticata una mielopatia. A causa delle vene tortuose descritte sulla superficie del midollo spinale (Figura 1B), il paziente è stato sottoposto ad angiografia a sottrazione digitale spinale (DSA). L’intervallo di DSA era dal livello Th6 all’arteria coccigea. I risultati non hanno rivelato alcuna malformazione vascolare. Pertanto, la diagnosi preliminare era TCS sintomatica e lipoma del filum terminale. In considerazione della debolezza e del deficit neurologico, è stato pianificato il de-tethering chirurgico del midollo spinale, senza resezione del lipoma.
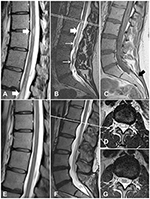
Figura 1. Immagini RM del midollo spinale del caso 1, prima e dopo il trattamento. (A) Cambiamenti mielopatici nel midollo spinale toracico (frecce bianche) (B) Cambiamenti mielopatici nel conus medullaris (freccia spessa) e vasi tortuosi ispessiti (frecce sottili). (C) La sequenza T1WI mostra un lipoma del filum terminale (freccia nera). (D) Una sezione trasversale a livello di L1/L2 mostra cambiamenti mielopatici. (E-G) Le immagini di follow-up dimostrano la risoluzione dei cambiamenti mielopatici e la scomparsa delle vene ispessite.
Il canale sacrale è stato aperto con un’incisione mediana. La dura era sottile e trasparente. Dopo un’incisione mediana della dura e dell’aracnoide, è stato visualizzato un tumore che sembrava essere un lipoma. Ha inghiottito il filum terminale e le radici del nervo spinale caudalmente, al livello S2. Le radici nervose S1 e S2 erano posizionate lateralmente al tumore. Un vaso ispessito, tortuoso e di colore rosso vivo è stato notato anche sul filum terminale, che correva in direzione craniale. La superficie esterna della dura è stata esplorata bilateralmente a livello sacrale alla ricerca di un SDAVF. Un nido chiaramente visibile è stato identificato a livello S3 sul lato sinistro. Un test empirico è stato eseguito per supportare questa scoperta. Una clip è stata posta sulla vena arterializzata, intraduralmente, per alcuni minuti. Poi, il vaso sul filum terminale ha chiaramente cambiato colore, da rosso vivo a grigio bluastro, e la sua tensione è diminuita. La SDAVF è stata poi scollegata intraduralmente e il nido è stato coagulato extraduralmente. Inoltre, il filum terminale è stato tagliato, e sono stati prelevati campioni di lipoma per l’istologia. La dura è stata suturata a tenuta stagna, e la ferita è stata chiusa a strati.
Il decorso postoperatorio è stato poco movimentato. Alcuni giorni dopo, il paziente è stato dimesso. Una risonanza magnetica di follow-up ha mostrato la risoluzione dei cambiamenti mielopatici (figure 1E-G). Al follow-up di 1 anno, il paziente era notevolmente migliorato, senza incontinenza o deficit motori.
Caso 2
Un uomo di 33 anni ha presentato una storia di 2 anni di dolore nella colonna lombosacrale con progressiva debolezza degli arti inferiori, frequenza urinaria e incontinenza. I sintomi si sono intensificati dopo l’esercizio fisico e la prolungata permanenza in piedi. La risonanza magnetica della colonna lombare ha dimostrato un midollo legato a livello di L3, un lipoma del filum terminale ed un edema nel midollo spinale. Ha anche mostrato vene tortuose sulla superficie posteriore del midollo spinale (Figure 2A,D).
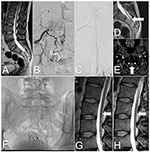
Figura 2. Immagini del midollo spinale del caso 2, prima e dopo il trattamento. (A) Risonanza magnetica pesata in T2: Cordone ancorato e lipoma sacrale. (B) DSA: SDAVF a livello S2-S3 alimentato dalle arterie sacrali laterali. (C) DSA: Vene tortuose sulla superficie posteriore del midollo spinale cervicale. (D) Risonanza magnetica pesata in T2: Vena tortuosa sulla superficie posteriore del midollo spinale legato (freccia). (E) RMN TOF: Vena drenante (freccia) a livello della giunzione atlanto-occipitale. (F) La radiografia dell’area sacrale mostra agenti embolici dopo tre embolizzazioni. (G) Risonanza magnetica lombare pesata in T2: Dopo l’ultima embolizzazione, i vasi tortuosi sono visibili sulla superficie posteriore del midollo spinale (freccia). (H) Risonanza magnetica di follow-up: a 6 mesi dall’intervento, le vene tortuose non sono più visibili sulla superficie posteriore del midollo spinale (freccia).
L’esame neurologico ha rivelato debolezza bilaterale della flessione dell’anca (grado 4 secondo il sistema modificato del Medical Research Council), debolezza della flessione plantare (grado 3 secondo il sistema modificato del Medical Research Council), e sensazione ridotta nei dermatomi S2-S3. I segni di Babinski e Rossolimo erano presenti bilateralmente. Sulla base dei segni clinici e radiologici, si sospettava una SDAVF. Un DSA ha confermato la SDAVF a livello S2-S3, nella dura alimentata dalle arterie sacrali laterali e dai rami delle arterie iliache interne. Vene drenanti tortuose erano presenti sulla superficie posteriore di tutto il midollo spinale e terminavano intracranicamente (Figure 2B,C,E).
Il paziente è stato sottoposto a tre embolizzazioni endovascolari, ciascuna con un agente diverso. In primo luogo, l’embolizzazione è stata eseguita con Onyx™ 18, somministrato in due microcateteri. Questo trattamento ha portato all’occlusione della fistola. Il paziente migliorò significativamente, ma a causa della scarsa penetrazione della vena drenante, dopo alcune settimane, la fistola si ricanalizzò e i sintomi ritornarono.
Una seconda embolizzazione fu eseguita 4 mesi dopo. L’accesso vascolare alla fistola era più complicato. Un’iniezione di Phil™ al 25% era possibile solo attraverso i piccoli rami sacrali dell’arteria iliaca interna sinistra. Questa procedura ha ottenuto una significativa riduzione del flusso attraverso la fistola. Diciotto mesi dopo si tentò l’embolizzazione della fistola con colla diluita. Nonostante la buona occlusione della fistola osservata in un DSA, i vasi tortuosi sono rimasti visibili nella risonanza magnetica di follow-up (Figure 2F,G). I sintomi persistevano, e il paziente è stato qualificato per il trattamento chirurgico.
L’obiettivo della chirurgia era quello di occludere la vena drenante e l’alimentatore arterioso e di ridurre il lipoma. Con un’incisione mediana, il canale sacrale è stato aperto sul lato destro. La dura era spessa e c’erano più vasi pieni di agenti embolici. C’era un grande vaso rosso brillante extradurale e uno intradurale a livello S2-S3. Una clip è stata posta sulla vena arterializzata intraduralmente per un paio di minuti. In seguito, il vaso ha cambiato colore e la tensione è diminuita. Entrambi i vasi intra ed extradurali sono stati coagulati. In seguito, il lipoma è stato visualizzato e parzialmente rimosso. La dura è stata suturata in modo impermeabile, e la ferita è stata chiusa a strati.
Il decorso postoperatorio è stato senza problemi, e pochi giorni dopo, il paziente è stato dimesso. Dopo 6 mesi, una risonanza magnetica di follow-up ha mostrato l’assenza di vasi tortuosi sulla superficie posteriore del midollo spinale e una significativa riduzione dei cambiamenti mielopatici (Figura 2H). Al follow-up, il paziente è notevolmente migliorato, senza incontinenza, con una certa frequenza urinaria e una lieve debolezza (grado 4 secondo il sistema modificato del Medical Research Council).
Discussione
La co-occorrenza di TCS, un lipoma intradurale e una SDAVF a livello sacrale, sebbene eccezionale, deve essere tenuta presente, alla luce del crescente numero di casi riportati. Questo studio ha descritto il quinto e il sesto caso di questo tipo, con una STC e una SDAVF a livello sacrale (Tabella 1). Recentemente, uno di questi casi è stato elencato da Horiuchi et al. e altri due sono stati aggiunti da Talenti et al. (6, 8).

Tabella 1. Rassegna della letteratura sulla coincidenza della fistola arterovenosa durale sacrale (DAVF), della sindrome del cordone ombelicale (TCS) e del lipoma del filum terminale/lipomielomeningocele.
La causa di questa tripla coincidenza è enigmatica. Da un lato, la SDAVF è ritenuta un’entità acquisita, in contrasto con le anomalie spinali primarie. Questa caratteristica ha suggerito che la coesistenza di queste patologie potrebbe essere accidentale. D’altra parte, i lipomi e gli angiomi nascono entrambi da un’origine mesenchimale. Rapporti precedenti di AVM intramidollare combinata e lipoma suggeriscono che ci può essere una correlazione tra queste eziologie (9, 10). Tuttavia, al meglio delle nostre conoscenze, nessuno studio precedente ha descritto la coesistenza di anomalie disrafiche e una SDAVF a livello sacrale, che si è presentata nell’infanzia. Inoltre, una ricerca nel database Medline non ha rivelato alcun rapporto su una SDAVF congenita. Tuttavia, diversi rapporti hanno descritto una SDAVF secondaria a un intervento chirurgico o a un trauma (11-15). Pertanto, teoricamente, un precedente intervento chirurgico per un mielomeningocele potrebbe successivamente innescare la formazione di una SDAVF.
Studi precedenti hanno riportato che una trombosi del seno venoso con associata ipertensione intravenosa e un’ostruzione del deflusso venoso potrebbe avviare la formazione di shunt (16-18). Pertanto, una spiegazione alternativa della coesistenza di disturbi riscontrati nei nostri casi potrebbe essere che un lipoma ha causato una pressione che ha ostruito il deflusso venoso e quindi ha promosso la formazione di una SDAVF. Questo meccanismo alternativo non sarebbe collegato a una storia precedente di trauma o chirurgia.
Le SDAVF acquisite sono tipicamente localizzate nella regione toraco-lombare e l’età media di presentazione è di circa 60 anni (19). Le SDAVF sacrali sono rare, e l’età media di presentazione delle SDAVF che coesistono con una STC è di 41 anni (Tabella 1). Pertanto, è anche possibile che un’anomalia congenita, come un lipoma intradurale, possa promuovere la formazione di una SDAVF a un’età più giovane. Recentemente, Horiuchi et al. hanno descritto due casi e rivisto nove casi precedentemente pubblicati di SDAVFs e AVMs che coesistevano con lipomi spinali di diversi tipi e a diversi livelli spinali (8). Sia Djindjian et al. che Horiuchi et al. hanno postulato che il meccanismo più probabile alla base di una formazione ritardata di SDAVF potrebbe essere il rilascio da parte degli adipociti di fattori angiogenici; questi fattori possono influenzare l’angiogenesi (20) e portare all’ipervascolarizzazione locale (5, 8). Inoltre, Jellema et al. hanno escluso fattori protrombotici nella patogenesi delle SDAVF (21).
La coincidenza sintomatica di TCS, lipoma sacrale e SDAVF fa sorgere la domanda: cosa guida esattamente i sintomi? Talenti et al. hanno recentemente descritto le difficoltà diagnostiche e terapeutiche di due casi simili (6). In entrambi i pazienti, una prima rimozione del midollo spinale e la rimozione del lipoma/lipomielomeningocele non hanno prodotto né miglioramenti né peggioramenti. Dopo l’angiografia spinale, hanno affrontato la patologia vascolare spinale. La storia naturale del lipoma del filum terminale è benigna; solo il 5% dei pazienti presenta sintomi di STC (22). Pertanto, il lipoma era la causa meno probabile di danno neurologico. Tuttavia, in una certa misura, sia la STC che la SDAVF potrebbero causare sintomi simili. Una STC diventa sintomatica più frequentemente nei bambini che negli adulti (23). Al contrario, i disturbi legati alle SDAVF si sviluppano in individui più anziani e di mezza età. Inoltre, le SDAVF sacrali inducono iperintensità del midollo spinale, visibili nella risonanza magnetica pesata in T2, che in genere scompaiono dopo un trattamento riuscito (24). Pertanto, la causa più probabile del deterioramento neurologico è la SDAVF, in base all’età media dei pazienti con TCS, lipoma sacrale e SDAVF coincidenti (vedi tabella 1) e in base al buon esito postoperatorio, cioè la risoluzione delle alterazioni intramidollari, dimostrata nelle risonanze magnetiche. Inoltre, a differenza della STC, i sintomi della SDAVF possono esacerbarsi con lo sforzo fisico e con l’aumento della pressione intra-addominale, come in entrambi i casi descritti nel presente studio.
Nei pazienti con questa tripla coincidenza, la SDAVF era sempre la causa diretta dell’aumento dei sintomi. Pertanto, l’obiettivo principale del trattamento dovrebbe essere l’occlusione. In letteratura, l’embolizzazione endovascolare sembrava essere altrettanto efficace della chirurgia, e l’embolizzazione era l’unico trattamento in casi simili (24). Purtroppo, l’embolizzazione era impraticabile o inefficace nei nostri casi. Con la chirurgia, sia la SDAVF che la TCS potrebbero essere esplorate e trattate in una sola procedura.
Nel nostro primo caso, l’obiettivo iniziale della chirurgia era quello di slegare il midollo spinale, perché la SDAVF non era confermata su un DSA preoperatorio. Tuttavia, rimane la domanda: perché la SDAVF era oscurata sul DSA? Oldfield et al. hanno descritto tre casi di SDAVFs che non sono stati rilevati in un DSA, ma erano altamente sospetti, sulla base di altre modalità di neuroimaging. Queste SDAVF sono state scollegate con successo durante l’intervento chirurgico (25). I fattori che hanno impedito il rilevamento DSA spinale incluso l’obesità, aneurisma aortico, aterosclerosi aortica con tortuosità, e ostruzione orifizio o tortuosità delle arterie lombari. Nel nostro caso, una potenziale spiegazione per i risultati falsi negativi del DSA potrebbe essere che il DSA non era sufficientemente approfondito; quindi, non abbiamo esaminato l’afflusso a livello sacrale.
I due casi qui descritti hanno dimostrato che le SDAVF sacrali possono essere difficili da rilevare nei DSA e difficili da occludere con l’embolizzazione endovascolare. Studi precedenti presentati nella Tabella 1 hanno anche descritto embolizzazioni senza successo nel trattamento delle SDAVF (4, 6, 8). In totale, ci sono stati 5 tentativi infruttuosi di occlusione endovascolare in 3 dei 6 casi riportati (Tabella 1). Così, abbiamo concluso che un approccio chirurgico potrebbe essere superiore all’embolizzazione endovascolare, perché la chirurgia offre un trattamento in una sola fase.
Raccomandazioni conclusive
La co-occorrenza di TCS, lipoma e SDAVF a livello sacrale è eccezionalmente rara. I rapporti precedenti e i nostri risultati rivelano che la chirurgia potrebbe essere superiore all’embolizzazione endovascolare per il trattamento delle SDAVF sacrali con entità coesistenti, perché la chirurgia offre un trattamento in una sola fase. Un numero crescente di casi riportati ha indicato che i sintomi di questo triplo disturbo possono essere causati esclusivamente dalla SDAVF, e non dal TCS o dal lipoma, che sono chiaramente visibili in neuroimaging.
Consenso
Un consenso informato scritto è stato ottenuto dai partecipanti per la pubblicazione di questo case report.
Contributi degli autori
PK ha progettato il progetto e lo ha rivisto criticamente. ŁP ha preparato il manoscritto, ha raccolto e rivisto i dati. PJ, MZ e MG hanno raccolto i dati dei casi. BC ha rivisto l’anatomia. AM ha fatto l’approvazione finale della versione da pubblicare.
Conflict of Interest Statement
Gli autori dichiarano che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che potrebbero essere interpretate come un potenziale conflitto di interessi.
1. Drake JM. Gestione chirurgica del midollo spinale ancorato – camminare sulla linea sottile. Neurosurg Focus. (2007) 23:E4. doi: 10.3171/FOC-07/08/E4
PubMed Abstract | CrossRef Full Text
2. McCutcheon IE, Doppman JL, Oldfield EH. Anatomia microvascolare delle anomalie arterovenose durali della colonna vertebrale: uno studio microangiografico. J Neurosurg. (1996) 84:215-20. doi: 10.3171/jns.1996.84.2.0215
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Gailloud P. Spinal dural arteriovenous fistula (SDAVF) variante con doppio drenaggio perimedollare ed epidurale. Eur Spine J. (2017). 27(Suppl 3):375-9. doi: 10.1007/s00586-017-5298-x
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Krisht KM, Karsy M, Ray WZ, Dailey AT. Extraspinale tipo I fistola arterovenosa durale con un lipomielomeningocele lombosacrale: un case report e revisione della letteratura. Case Rep Neurol Med. (2015) 2015:526321. doi: 10.1155/2015/526321
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Djindjian M, Ayache P, Brugieres P, Poirier J. Lipoma sacrale del filum terminale con fistola arterovenosa durale. Rapporto di caso. J Neurosurg. (1989) 71(5 Pt 1):768-71. doi: 10.3171/jns.1989.71.5.0768
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Talenti G, Vitale G, Cester G, Della Puppa A, Faggin R, Causin F. Rara associazione tra fistole arterovenose durali spinali e disrafismi: rapporto di due casi e revisione della letteratura con un focus sulle insidie nella diagnosi e nel trattamento. Intervent Neuroradiol. (2017) 23:458-64. doi: 10.1177/1591019917714636
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Przepiórka Ł, Kunert P, Juszynńska P, Zawadzki M, Ciszek B, Głowacki M, et al. Coincidenza di tethered cord, lipoma filum terminale, e sacrale fistola arterovenosa durale: rapporto di due casi e una revisione della letteratura. Fronte Neurol. (2018) 9:807. doi: 10.3389/fneur.2018.00807
CrossRef Full Text | Google Scholar
8. Horiuchi Y, Iwanami A, Akiyama T, Hikata T, Watanabe K, Yagi M, et al. Fistola arterovenosa spinale coesistente all’interno di un lipoma spinale: rapporto di due casi. Spinal Cord Series Cases (2017) 3:17079. doi: 10.1038/s41394-017-0011-1
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Weon YC, Chung JI, Roh HG, Eoh W, Byun HS. Malformazione artero-venosa intramidollare spifnale combinata e lipomielomeningocele. Neuroradiologia (2005) 47: 774-9. doi: 10.1007/s00234-005-1336-1
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Rice JF, Jelsma RK. Malformazione artero-venosa combinata e lipoma intramidollare: chirurgia ed emboloterapia. Am J Neuroradiol. (1986) 7:171-3.
PubMed Abstract | Google Scholar
11. Asakuno K, Kim P, Kawamoto T, Ogino M. Fistola arterovenosa durale e sindrome progressiva del conus medullaris come complicazioni della discectomia lombare. Rapporto di caso. J Neurosurg. (2002) 97(3 Suppl):375-9. doi: 10.3171/spi.2002.97.3.0375
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Kang JW, Koo JH, Kim DK, Joo YJ, Kim TH, Song SH. Mielopatia causata da fistola artero-venosa spinale durale dopo la prima frattura del corpo vertebrale lombare – un case report. Ann Rehabil Med. (2011) 35:729-32. doi: 10.5535/arm.2011.35.5.729
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Vankan Y, Demaerel P, Heye S, Van Calenbergh F, van Loon J, Maleux G, et al. Fistola arterovenosa durale come una complicazione tardiva della frattura della colonna vertebrale cervicale superiore. Case report. J Neurosurg. (2004) 100(4 Suppl Spine):382-4. doi: 10.3171/spi.2004.100.4.0382
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Nishimura Y, Natsume A, Ginsberg HJ. Spinal dural arteriovenous fistula associata con L-4 spondilolistesi istmica. J Neurosurg Spine (2014) 20:670-4. doi: 10.3171/2014.3.SPINE13492
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Khaldi A, Hacein-Bey L, Origitano TC. Fistola epidurale artero-venosa spinale con ipertensione venosa perimedollare ad insorgenza tardiva dopo un intervento chirurgico lombare: case report e discussione della fisiopatologia. Spine (2009) 34:E775-9. doi: 10.1097/BRS.0b013e3181ae4a52
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Jablawi F, Nikoubashman O, Mull M. L’ipertensione arteriosa è associata a fistole arterovenose spinali durali sintomatiche. World Neurosurg. (2017) 103:360-3. doi: 10.1016/j.wneu.2017.04.050
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Borden JA, Wu JK, Shucart WA. Una classificazione proposta per le malformazioni arterovenose fistolose spinali e craniche durali e le implicazioni per il trattamento. J Neurosurg. (1995) 82:166-79. doi: 10.3171/jns.1995.82.2.0166
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Lawton MT, Jacobowitz R, Spetzler RF. Ruolo ridefinito di angiogenesi nella patogenesi delle malformazioni arterovenose durali. J Neurosurg. (1997) 87:267-74. doi: 10.3171/jns.1997.87.2.0267
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Wojciechowski J, Kunert P, Nowak A, Dziedzic T, Czernicki T, Wojtowicz K, et al. Trattamento chirurgico per fistole arterovenose spinali durali: Esito, complicazioni e fattori prognostici. Neurol Neurochir Pol. (2017). 51:446-53. doi: 10.1016/j.pjnns.2017.07.001
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Lucarelli E, Sangiorgi L, Benassi S, Donati D, Gobbi GA, Picci P, et al. Angiogenesi nel lipoma: Uno studio sperimentale nella membrana corioallantoica dell’embrione di pulcino. Int J Mol Med. (1999) 4:593-6. doi: 10.3892/ijmm.4.6.593
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Jellema K, Tijssen CC, Fijnheer R, de Groot PG, Koudstaal PJ, van Gijn J. Spinal dural arteriovenous fistole non sono associati con fattori protrombotici. Stroke (2004) 35:2069-71. doi: 10.1161/01.STR.0000135766.22285.dc
CrossRef Full Text | Google Scholar
22. Cools MJ, Al-Holou WN, Stetler WR Jr, Wilson TJ, Muraszko KM, Ibrahim M, et al. Lipomi del filum terminale: prevalenza di imaging, storia naturale e posizione cono. J Neurosurg Pediatr. (2014) 13:559-67. doi: 10.3171/2014.2.PEDS13528
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Al-Holou WN, Muraszko KM, Garton HJ, Buchman SR, Maher CO. L’esito del rilascio del cordone ombelicale nella sindrome del cordone ombelicale secondario e multiplo ripetuto. J Neurosurg Pediatr. (2009) 4:28-36. doi: 10.3171/2009.2.PEDS08339
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Gioppo A, Farago G, Giannitto C, Caputi L, Saladino A, Acerbi F, et al. Fistole arterovenose sacrali durali: una sfida diagnostica e terapeutica – esperienza monocentrica di 13 casi e revisione della letteratura. J Neurointerv Surg. (2017). 10:415-21. doi: 10.1136/neurintsurg-2017-013307
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Oldfield EH, Bennett A 3rd Chen MY, Doppman JL. Gestione di successo di fistole arterovenose spinali durali non rilevate da arteriografia. Rapporto di tre casi. J Neurosurg. (2002) 96(2 Suppl):220-9. doi: 10.3171/spi.2002.96.2.0220
PubMed Abstract | CrossRef Full Text | Google Scholar