Introduction
Zespół rdzenia kręgowego (TCS) jest rozwojowym zaburzeniem neurologicznym spowodowanym nieprawidłowo niskim położeniem rdzenia kręgowego (conus medullaris). Zazwyczaj występuje w dzieciństwie, ale może pozostać niewykryty aż do wieku dorosłego i może być związany z wewnątrzoponowym tłuszczakiem. Pacjenci ze współistniejącymi nieprawidłowościami (np. myelomeningocele) i wyraźnymi objawami klinicznymi (np. postępujące osłabienie kończyn dolnych, nietrzymanie moczu) mogą wymagać leczenia operacyjnego. Celem zabiegu operacyjnego jest usunięcie więzów rdzenia kręgowego, aby zmniejszyć jego rozciągliwość. Niemniej jednak, wskazania do operacji pozostają kontrowersyjne (1).
W przeciwieństwie do tego, przetoka tętniczo-żylna rdzenia kręgowego (SDAVF) jest stanem nabytym. Jest to najczęstsza malformacja naczyniowa w obrębie kręgosłupa u dorosłych. Powstaje w otworze nerwowym w wyniku nieprawidłowego, bezpośredniego połączenia między tętnicą kręgową (zaopatrującą tuleję korzenia kręgowego i przyległą oponę twardą) a żyłą środkową (drenującą splot żylny wieńcowy) (2, 3).
Może przebiegać z bólem pleców i postępującym deficytem neurologicznym. SDAVF typowo wymaga albo chirurgicznego albo wewnątrznaczyniowego zarządzania.
Zbieżność TCS, lipoma (albo lipomyelomeningocele) i SDAVF na poziomie krzyżowym jest bardzo rzadka. W niniejszym komunikacie opisujemy dwóch takich pacjentów. (4-6).
Materiał przypadku
Przypadek 1
30-letnia kobieta zgłosiła się z 10-letnią historią bólów kręgosłupa lędźwiowo-krzyżowego; miała przypadkowe napromienianie obu kończyn dolnych. Po pierwszym porodzie wystąpił u niej ból pleców. Rezonans magnetyczny wykazał skrępowanie rdzenia na poziomie L4 i tłuszczaka końcowego (filum terminale lipoma). Rezonans magnetyczny wykazał również kręte żyły na powierzchni rdzenia kręgowego (ryc. 1C). Dziewięć lat później, podczas drugiej ciąży, pacjentka zauważyła osłabienie i utratę czucia, zaburzenia równowagi z nietrzymaniem moczu i stolca. Przy przyjęciu do szpitala stwierdzono obustronne osłabienie zgięcia podeszwowego (stopień 4 według zmodyfikowanego systemu Medical Research Council) oraz obniżone czucie w okolicach pośladków i nóg, a także odruchy podeszwowe. Objawy Babińskiego i Rossolimo były obecne obustronnie. Powtórne badanie MRI ujawniło wewnątrzrdzeniowe hiperintensywne zmiany T2 w kręgosłupie piersiowym i stożku (ryc. 1A,B,D). Zmiany te odpowiadały deficytowi neurologicznemu i po wykluczeniu zapalnych chorób demielinizacyjnych, na podstawie badania MRI mózgu i testu na obecność przeciwciał przeciwko akwaporynie-4, rozpoznano mielopatię. Ze względu na opisywane żyły krętarzowe na powierzchni rdzenia kręgowego (ryc. 1B) u chorej wykonano kręgosłupową cyfrową angiografię subtrakcyjną (DSA). Zakres DSA obejmował od poziomu Th6 do tętnicy ogonowej. Wyniki nie wykazały obecności malformacji naczyniowej. W związku z tym wstępne rozpoznanie brzmiało: objawowe TCS i filum terminale lipoma. Wobec osłabienia i deficytu neurologicznego zaplanowano chirurgiczne odbarczenie rdzenia kręgowego, bez resekcji tłuszczaka.
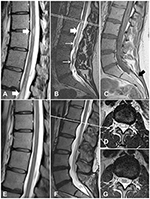
Rysunek 1. Obrazy MR rdzenia kręgowego w przypadku 1, przed i po leczeniu. (A) Zmiany mielopatyczne w piersiowym odcinku rdzenia kręgowego (białe strzałki) (B) Zmiany mielopatyczne w conus medullaris (gruba strzałka) i pogrubiałe naczynia krętarzowe (cienkie strzałki). (C) Sekwencja T1WI pokazuje tłuszczaka filum terminale (czarna strzałka). (D) Przekrój poprzeczny na poziomie L1/L2 pokazuje zmiany mielopatyczne. (E-G) Kolejne obrazy pokazują ustąpienie zmian mielopatycznych i zniknięcie pogrubiałych żył.
Kanał krzyżowy został otwarty przez nacięcie pośrodkowe. Opona twarda była cienka i przezroczysta. Po środkowym nacięciu opony twardej i pajęczynówki uwidoczniono guz, który wydawał się być tłuszczakiem. Obejmował on filum terminale i korzenie nerwów rdzeniowych do poziomu S2. Korzenie nerwowe S1 i S2 były ułożone bocznie od guza. Na włóknach końcowych zauważono pogrubiałe, kręte, jasnoczerwone naczynie biegnące w kierunku czaszkowym. Zewnętrzna powierzchnia opony twardej została zbadana obustronnie na poziomie krzyżowym w poszukiwaniu SDAVF. Wyraźnie widoczny nidus zidentyfikowano na poziomie S3 po stronie lewej. Przeprowadzono test empiryczny, aby potwierdzić to odkrycie. Klips był umieszczony na arterializowanej żyle, śródoperacyjnie, na kilka minut. Następnie naczynie na filum terminale wyraźnie zmieniło kolor, z jasnoczerwonego na niebieskoszary, a jego napięcie zmniejszyło się. Następnie śródoperacyjnie odłączono SDAVF, a nidus poddano koagulacji zewnątrzoponowej. Ponadto przecięto filum terminale i pobrano próbki tłuszczaka do badania histopatologicznego. Opona twarda została zaszyta w sposób wodoszczelny, a ranę zamknięto warstwowo.
Przebieg pooperacyjny był bez powikłań. Kilka dni później pacjent został wypisany do domu. W kontrolnym badaniu MRI stwierdzono ustąpienie zmian mielopatycznych (ryc. 1E-G). W czasie 1-letniej obserwacji stan pacjenta znacznie się poprawił, bez nietrzymania moczu i deficytu ruchowego.
Przypadek 2
33-letni mężczyzna przedstawił 2-letnią historię bólu w odcinku lędźwiowo-krzyżowym kręgosłupa z postępującym osłabieniem kończyn dolnych, częstym oddawaniem moczu i nietrzymaniem moczu. Objawy nasilały się po wysiłku fizycznym i długotrwałym przebywaniu w pozycji stojącej. Rezonans magnetyczny kręgosłupa lędźwiowego wykazał skrępowanie rdzenia na poziomie L3, tłuszczak końcowy filum terminale oraz obrzęk rdzenia kręgowego. Wykazano również obecność krętych żył na tylnej powierzchni rdzenia kręgowego (ryc. 2A,D).
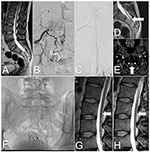
Rysunek 2. Obrazy rdzenia kręgowego w przypadku 2, przed i po leczeniu. (A) T2-ważony MRI: Skrępowany rdzeń i tłuszczak kości krzyżowej. (B) DSA: SDAVF na poziomie S2-S3 zaopatrywany przez tętnice krzyżowe boczne. (C) DSA: Żyły krętarzowe na tylnej powierzchni rdzenia kręgowego szyjnego. (D) T2-ważony MRI: Tortuous vein on the posterior surface of the tethered spinal cord (arrow). (E) TOF MRI: Żyła drenująca (strzałka) na poziomie połączenia szczytowo-potylicznego. (F) Zdjęcie rentgenowskie okolicy krzyżowej pokazuje środki embolizujące po trzech embolizacjach. (G) Rezonans magnetyczny odcinka lędźwiowego T2-ważony: Po ostatniej embolizacji widoczne są krętowate naczynia na tylnej powierzchni rdzenia kręgowego (strzałka). (H) Kontrolne badanie MRI: 6 miesięcy po zabiegu nie obserwuje się już krętych naczyń na tylnej powierzchni rdzenia kręgowego (strzałka).
Badanie neurologiczne ujawniło obustronne osłabienie zgięcia stawu biodrowego (stopień 4 według zmodyfikowanego systemu Medical Research Council), osłabienie zgięcia podeszwowego (stopień 3 według zmodyfikowanego systemu Medical Research Council) oraz obniżone czucie w dermatomach S2-S3. Obustronnie obecne były objawy Babińskiego i Rossolimo. Na podstawie objawów klinicznych i radiologicznych wysunięto podejrzenie SDAVF. DSA potwierdziła SDAVF na poziomie S2-S3, w obrębie opony twardej zaopatrywanej przez tętnice krzyżowe boczne i gałęzie od tętnic biodrowych wewnętrznych. Na tylnej powierzchni całego rdzenia kręgowego obecne były wijące się żyły odprowadzające, które kończyły się wewnątrzczaszkowo (ryc. 2B,C,E).
Pacjentka przeszła trzy embolizacje wewnątrznaczyniowe, każda innym środkiem. Najpierw wykonano embolizację preparatem Onyx™ 18, podawanym w dwóch mikrokateterach. W wyniku tego zabiegu uzyskano okluzję przetoki. U pacjenta nastąpiła znaczna poprawa, ale z powodu słabej penetracji żyły odprowadzającej, po kilku tygodniach przetoka uległa rekanalizacji i objawy powróciły.
Drugą embolizację wykonano 4 miesiące później. Dostęp naczyniowy do przetoki był bardziej skomplikowany. Wstrzyknięcie 25% Phil™ było wykonalne tylko przez małe gałęzie krzyżowe lewej tętnicy biodrowej wewnętrznej. Dzięki temu zabiegowi uzyskano istotne zmniejszenie przepływu przez przetokę. Osiemnaście miesięcy później podjęto próbę embolizacji przetoki za pomocą rozcieńczonego kleju. Pomimo dobrej okluzji przetoki w badaniu DSA, w kontrolnym badaniu MRI nadal widoczne były kręte naczynia (ryc. 2F,G). Objawy nie ustępowały i pacjentkę zakwalifikowano do leczenia operacyjnego.
Celem operacji było zamknięcie żyły odprowadzającej i doprowadzającej tętnicę oraz zmniejszenie tłuszczaka. Za pomocą cięcia pośrodkowego otwarto kanał krzyżowy po prawej stronie. Opona twarda była gruba i znajdowały się w niej liczne naczynia wypełnione środkami zatorowymi. Jedno duże, jasnoczerwone naczynie znajdowało się zewnątrzoponowo, a jedno wewnątrzoponowo na poziomie S2-S3. Na kilka minut założono klips na tętniczą żyłę wewnątrzoponowo. Po tym czasie naczynie zmieniło kolor i zmniejszyło się jego napięcie. Koagulowano zarówno naczynia wewnątrz-, jak i zewnątrzoponowe. Następnie uwidoczniono i częściowo usunięto tłuszczaka. Opona twarda została zaszyta w sposób wodoszczelny, a ranę zamknięto warstwowo.
Przebieg pooperacyjny był bez powikłań, a kilka dni później pacjentka została wypisana do domu. Po 6 miesiącach kontrolne badanie MRI wykazało brak krętych naczyń na tylnej powierzchni rdzenia kręgowego i znaczne zmniejszenie zmian mielopatycznych (ryc. 2H). W dalszej obserwacji stan pacjenta znacznie się poprawił, bez nietrzymania moczu, z niewielką częstością oddawania moczu i łagodnym osłabieniem (stopień 4 według zmodyfikowanego systemu Medical Research Council).
Dyskusja
Współwystępowanie TCS, tłuszczaka śródrdzeniowego i SDAVF na poziomie krzyżowym, choć wyjątkowe, powinno być brane pod uwagę w świetle rosnącej liczby zgłaszanych przypadków. W niniejszej pracy opisano piąty i szósty taki przypadek, z TCS i SDAVF na poziomie kości krzyżowej (tab. 1). Ostatnio jeden z tych przypadków został wymieniony przez Horiuchi i wsp. a dwa kolejne zostały dodane przez Talenti i wsp. (6, 8).

Tabela 1. Przegląd literatury na temat koincydencji przetoki tętniczo-żylnej opony krzyżowej (sacral dural arteriovenous fistula – DAVF), zespołu rdzenia kręgowego (tethered cord syndrome – TCS) i filum terminale lipoma/lipomyelomeningocele.
Przyczyna tej potrójnej koincydencji jest enigmatyczna. Z jednej strony uważa się, że SDAVF jest jednostką nabytą, w przeciwieństwie do pierwotnych anomalii kręgosłupa. Ta cecha sugerowała, że współistnienie tych patologii może być przypadkowe. Z drugiej strony, zarówno tłuszczaki, jak i naczyniaki mają pochodzenie mezenchymalne. Wcześniejsze doniesienia o łącznym występowaniu wewnątrzczaszkowego AVM i tłuszczaka sugerują, że może istnieć korelacja między tymi etiologiami (9, 10). Jednakże, zgodnie z naszą najlepszą wiedzą, w żadnym z wcześniejszych badań nie opisano współistnienia anomalii dysraficznych i SDAVF na poziomie kości krzyżowej, które wystąpiły w dzieciństwie. Również przeszukiwanie bazy danych Medline nie ujawniło żadnego doniesienia na temat wrodzonego SDAVF. Jednakże w kilku doniesieniach opisywano SDAVF wtórne do operacji lub urazu (11-15). Dlatego, teoretycznie, poprzednia operacja dla myelomeningocele mogłaby następnie wywołać formację SDAVF.
Poprzednie badania poinformowały , że zakrzepica zatoki żylnej z towarzyszącym dożylnym nadciśnieniem i żylną przeszkodą odpływu może zapoczątkować formację shunts (16-18). Dlatego, alternatywne wyjaśnienie współistnienia zaburzeń znalezionych w naszych przypadkach mogło być takie, że tłuszczak spowodował ciśnienie, które zablokowało odpływ żylny, a tym samym, promowało formowanie SDAVF. Ten alternatywny mechanizm byłby niezwiązany z poprzednią historią urazu albo chirurgii.
Acquired SDAVFs są typowo zlokalizowane w piersiowo-lędźwiowym regionie i średni wiek przy prezentacji jest około 60 lat (19). Sacral SDAVFs są rzadkie, a średni wiek wystąpienia SDAVFs współistniejących z TCS wynosi 41 lat (Tabela 1). Dlatego też możliwe jest, że wrodzona anomalia, taka jak tłuszczak wewnątrzoponowy, może sprzyjać powstawaniu SDAVF w młodszym wieku. Ostatnio Horiuchi i wsp. opisali dwa przypadki i dokonali przeglądu dziewięciu wcześniej opublikowanych przypadków SDAVF i AVM, które współistniały z tłuszczakami rdzeniowymi różnych typów i na różnych poziomach kręgosłupa (8). Zarówno Djindjian i wsp. jak i Horiuchi i wsp. postulowali, że najbardziej prawdopodobnym mechanizmem opóźnionego powstawania SDAVF może być uwalnianie przez adipocyty czynników angiogennych, które mogą wpływać na angiogenezę (20) i prowadzić do miejscowej hiperwaskularyzacji (5, 8). Ponadto Jellema i wsp. wykluczyli w patogenezie SDAVF czynniki prozakrzepowe (21).
Zbieżność objawowa TCS, tłuszczaka kości krzyżowej i SDAVF nasuwa pytanie: co dokładnie kieruje tymi objawami? Talenti i wsp. opisali niedawno trudności diagnostyczne i terapeutyczne w dwóch podobnych przypadkach (6). U obu tych pacjentów wstępne odbarczenie rdzenia kręgowego i usunięcie tłuszczaka/lipomyelomeningocele nie przyniosło poprawy ani pogorszenia. Po wykonaniu angiografii kręgosłupa zajęto się następnie patologią naczyniową rdzenia kręgowego. Historia naturalna tłuszczaka filum terminale jest łagodna; tylko u 5% pacjentów występują objawy TCS (22). W związku z tym, tłuszczak był najmniej prawdopodobną przyczyną zaburzeń neurologicznych. Niemniej jednak, w pewnym stopniu zarówno TCS, jak i SDAVF mogą powodować podobne objawy. TCS częściej staje się objawowy u dzieci niż u dorosłych (23). Natomiast upośledzenia związane z SDAVF rozwijają się u osób starszych i w średnim wieku. Co więcej, SDAVF krzyżowe wywołują hiperintensywności w rdzeniu kręgowym, widoczne w T2-ważonym MRI, które zwykle ustępują po skutecznym leczeniu (24). Dlatego też najbardziej prawdopodobną przyczyną pogorszenia stanu neurologicznego jest SDAVF, na podstawie średniego wieku pacjentów ze zbieżnymi TCS, tłuszczakiem kości krzyżowej i SDAVF (patrz Tabela 1) oraz na podstawie dobrego wyniku pooperacyjnego, tj. ustąpienia zmian śródrdzeniowych, wykazanego w badaniu MRI. Ponadto, w przeciwieństwie do TCS, objawy SDAVF mogą się nasilać przy wysiłku fizycznym i przy wzroście ciśnienia wewnątrzbrzusznego, jak w obu przypadkach opisanych w niniejszej pracy.
U pacjentów z tą potrójną koincydencją SDAVF było zawsze bezpośrednią przyczyną narastania objawów. Dlatego głównym celem leczenia powinna być okluzja. W piśmiennictwie embolizacja wewnątrznaczyniowa okazała się równie skuteczna jak zabieg operacyjny, a embolizacja była jedynym sposobem leczenia w podobnych przypadkach (24). Niestety, w naszych przypadkach embolizacja była albo niewykonalna, albo nieskuteczna. Dzięki operacji, zarówno SDAVF jak i TCS mogły być zbadane i leczone podczas jednej procedury.
W naszym pierwszym przypadku, początkowym celem operacji było odłączenie rdzenia kręgowego, ponieważ SDAVF nie zostało potwierdzone w przedoperacyjnym DSA. Pozostaje jednak pytanie, dlaczego SDAVF był przesłonięty na DSA? Oldfield i wsp. opisali trzy przypadki SDAVF, które nie zostały wykryte w DSA, ale były bardzo podejrzane na podstawie innych metod neuroobrazowania. Te SDAVF zostały skutecznie odłączone podczas operacji (25). Czynnikami, które utrudniały wykrycie DSA kręgosłupa były: otyłość, tętniak aorty, miażdżyca aorty z krętością oraz niedrożność otworu lub krętość tętnic lędźwiowych. W naszym przypadku potencjalnym wyjaśnieniem fałszywie ujemnych wyników DSA może być to, że DSA nie była wystarczająco dokładna; w związku z tym nie zbadaliśmy napływu na poziomie krzyżowym.
Dwa opisane tu przypadki pokazały, że krzyżowe SDAVF mogą być trudne do wykrycia w DSA i trudne do okluzji za pomocą embolizacji wewnątrznaczyniowej. Wcześniejsze prace przedstawione w tabeli 1 również opisywały nieskuteczne embolizacje w leczeniu SDAVFs (4, 6, 8). W sumie w 3 z 6 opisanych przypadków podjęto 5 nieudanych prób wewnątrznaczyniowej okluzji (tab. 1). W związku z tym doszliśmy do wniosku, że podejście chirurgiczne może być lepsze niż embolizacja wewnątrznaczyniowa, ponieważ zabieg chirurgiczny oferuje jednoetapowe leczenie.
Uwagi końcowe
Współwystępowanie TCS, tłuszczaka i SDAVF na poziomie kości krzyżowej jest wyjątkowo rzadkie. Dotychczasowe doniesienia i nasze wyniki wskazują, że chirurgia może być lepsza niż embolizacja wewnątrznaczyniowa w leczeniu SDAVF na poziomie krzyżowym z jednostkami współistniejącymi, ponieważ chirurgia oferuje leczenie jednoetapowe. Rosnąca liczba opisywanych przypadków wskazuje, że objawy tego potrójnego zaburzenia mogą być spowodowane wyłącznie przez SDAVF, a nie przez TCS lub tłuszczaka, które są wyraźnie widoczne w badaniach neuroobrazowych.
Zgoda
W celu opublikowania tego opisu przypadku uzyskano pisemną świadomą zgodę uczestników.
Wkład autorów
PK opracował projekt i dokonał jego krytycznej recenzji. ŁP przygotował manuskrypt, zebrał i przejrzał dane. PJ, MZ i MG zebrali dane dotyczące przypadków. BC dokonał przeglądu anatomii. AM dokonał ostatecznego zatwierdzenia wersji do publikacji.
Oświadczenie o konflikcie interesów
Autorzy oświadczają, że badania zostały przeprowadzone przy braku jakichkolwiek komercyjnych lub finansowych powiązań, które mogłyby być interpretowane jako potencjalny konflikt interesów.
1. Drake JM. Surgical management of the tethered spinal cord-walking the fine line. Neurosurg Focus. (2007) 23:E4. doi: 10.3171/FOC-07/08/E4
PubMed Abstract | CrossRef Full Text
2. McCutcheon IE, Doppman JL, Oldfield EH. Microvascular anatomy of dural arteriovenous abnormalities of the spine: a microangiographic study. J Neurosurg. (1996) 84:215-20. doi: 10.3171/jns.1996.84.2.0215
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Gailloud P. Spinal dural arteriovenous fistula (SDAVF) variant with dual perimedullary and epidural drainage. Eur Spine J. (2017). 27(Suppl 3):375-9. doi: 10.1007/s00586-017-5298-x
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Krisht KM, Karsy M, Ray WZ, Dailey AT. Extraspinal type I dural arteriovenous fistula with a lumbosacral lipomyelomeningocele: a case report and review of the literature. Case Rep Neurol Med. (2015) 2015:526321. doi: 10.1155/2015/526321
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Djindjian M, Ayache P, Brugieres P, Poirier J. Sacral lipoma of the filum terminale with dural arteriovenous fistula. Case report. J Neurosurg. (1989) 71(5 Pt 1):768-71. doi: 10.3171/jns.1989.71.5.0768
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Talenti G, Vitale G, Cester G, Della Puppa A, Faggin R, Causin F. Rare association between spinal dural arteriovenous fistulas and dysraphisms: report of two cases and review of the literature with a focus on pitfalls in diagnosis and treatment. Intervent Neuroradiol. (2017) 23:458-64. doi: 10.1177/1591019917714636
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Przepiórka Ł, Kunert P, Juszynńska P, Zawadzki M, Ciszek B, Głowacki M, et al. Coincidence of tethered cord, filum terminale lipoma, and sacral dural arteriovenous fistula: report of two cases and a literature review. Front Neurol. (2018) 9:807. doi: 10.3389/fneur.2018.00807
CrossRef Full Text | Google Scholar
8. Horiuchi Y, Iwanami A, Akiyama T, Hikata T, Watanabe K, Yagi M, et al. Spinal arteriovenous fistula coexisting within a spinal lipoma: report of two cases. Spinal Cord Series Cases (2017) 3:17079. doi: 10.1038/s41394-017-0011-1
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Weon YC, Chung JI, Roh HG, Eoh W, Byun HS. Combined spifnal intramedullary arteriovenous malformation and lipomyelomeningocele. Neuroradiology (2005) 47:774-9. doi: 10.1007/s00234-005-1336-1
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Rice JF, Jelsma RK. Połączona malformacja tętniczo-żylna i tłuszczak wewnątrzczaszkowy: operacja i emboloterapia. Am J Neuroradiol. (1986) 7:171-3.
PubMed Abstract | Google Scholar
11. Asakuno K, Kim P, Kawamoto T, Ogino M. Dural arteriovenous fistula and progressive conus medullaris syndrome as complications of lumbar discectomy. Case report. J Neurosurg. (2002) 97(3 Suppl):375-9. doi: 10.3171/spi.2002.97.3.0375
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Kang JW, Koo JH, Kim DK, Joo YJ, Kim TH, Song SH. Myelopathy caused by spinal dural arterio-venous fistula after first lumbar vertebral body fracture – a case report. Ann Rehabil Med. (2011) 35:729-32. doi: 10.5535/arm.2011.35.5.729
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Vankan Y, Demaerel P, Heye S, Van Calenbergh F, van Loon J, Maleux G, et al. Dural arteriovenous fistula as a late complication of upper cervical spine fracture. Case report. J Neurosurg. (2004) 100(4 Suppl Spine):382-4. doi: 10.3171/spi.2004.100.4.0382
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Nishimura Y, Natsume A, Ginsberg HJ. Spinal dural arteriovenous fistula associated with L-4 isthmic spondylolisthesis. J Neurosurg Spine (2014) 20:670-4. doi: 10.3171/2014.3.SPINE13492
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Khaldi A, Hacein-Bey L, Origitano TC. Spinal epidural arteriovenous fistula with late onset perimedullary venous hypertension after lumbar surgery: case report and discussion of the pathophysiology. Spine (2009) 34:E775-9. doi: 10.1097/BRS.0b013e3181ae4a52
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Jablawi F, Nikoubashman O, Mull M. Arterial Hypertension is associated with symptomatic spinal dural arteriovenous fistulas. World Neurosurg. (2017) 103:360-3. doi: 10.1016/j.wneu.2017.04.050
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Borden JA, Wu JK, Shucart WA. A proposed classification for spinal and cranial dural arteriovenous fistulous malformations and implications for treatment. J Neurosurg. (1995) 82:166-79. doi: 10.3171/jns.1995.82.2.0166
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Lawton MT, Jacobowitz R, Spetzler RF. Redefined role of angiogenesis in the pathogenesis of dural arteriovenous malformations. J Neurosurg. (1997) 87:267-74. doi: 10.3171/jns.1997.87.2.0267
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Wojciechowski J, Kunert P, Nowak A, Dziedzic T, Czernicki T, Wojtowicz K, et al. Surgical treatment for spinal dural arteriovenous fistulas: Wyniki, powikłania i czynniki prognostyczne. Neurol Neurochir Pol. (2017). 51:446-53. doi: 10.1016/j.pjnns.2017.07.001
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Lucarelli E, Sangiorgi L, Benassi S, Donati D, Gobbi GA, Picci P, et al. Angiogenesis in lipoma: An experimental study in the chick embryo chorioallantoic membrane. Int J Mol Med. (1999) 4:593-6. doi: 10.3892/ijmm.4.6.593
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Jellema K, Tijssen CC, Fijnheer R, de Groot PG, Koudstaal PJ, van Gijn J. Spinal dural arteriovenous fistulas are not associated with prothrombotic factors. Stroke (2004) 35:2069-71. doi: 10.1161/01.STR.0000135766.22285.dc
CrossRef Full Text | Google Scholar
22. Cools MJ, Al-Holou WN, Stetler WR Jr, Wilson TJ, Muraszko KM, Ibrahim M, et al. Filum terminale lipomas: imaging prevalence, natural history, and conus position. J Neurosurg Pediatr. (2014) 13:559-67. doi: 10.3171/2014.2.PEDS13528
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Al-Holou WN, Muraszko KM, Garton HJ, Buchman SR, Maher CO. The outcome of tethered cord release in secondary and multiple repeat tethered cord syndrome. J Neurosurg Pediatr. (2009) 4:28-36. doi: 10.3171/2009.2.PEDS08339
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Gioppo A, Farago G, Giannitto C, Caputi L, Saladino A, Acerbi F, et al. Sacral dural arteriovenous fistulas: a diagnostic and therapeutic challenge – single-centre experience of 13 cases and review of the literature. J Neurointerv Surg. (2017). 10:415-21. doi: 10.1136/neurintsurg-2017-013307
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Oldfield EH, Bennett A 3rd Chen MY, Doppman JL. Successful management of spinal dural arteriovenous fistulas undetected by arteriography. Report of three cases. J Neurosurg. (2002) 96(2 Suppl):220-9. doi: 10.3171/spi.2002.96.2.0220
PubMed Abstract | CrossRef Full Text | Google Scholar
.