Cukrzyca jest kosztowna, ale większość kosztów przypisuje się powikłaniom i opiece szpitalnej.1 Według Amerykańskiego Stowarzyszenia Diabetologicznego (ADA), w 2012 roku całkowity szacowany koszt cukrzycy wyniósł 245 miliardów dolarów.1 Szacuje się, że 43% stanowiły koszty hospitalizacji, a kolejne 18% koszty recept na leczenie powikłań cukrzycy.1
Większości z tych powikłań można zapobiec dzięki ukierunkowanej kontroli stężenia glukozy. Dane epidemiologiczne wykazują, że na każdy punkt procentowy zmniejszenia stężenia hemoglobiny A1c (HbA1c) przypada 35% zmniejszenie ryzyka powikłań mikronaczyniowych.2 Dobrą wiadomością jest zmniejszenie częstości powikłań cukrzycy,3 ale zostało to wyprzedzone przez samo zwiększenie liczby chorych na cukrzycę, u których dochodzi do rozwoju powikłań.
Wielu chorych na cukrzycę typu 2 może mieć powikłania związane z cukrzycą w chwili rozpoznania. Zarówno w cukrzycy typu 1, jak i typu 2 niektóre z powikłań, takie jak retinopatia i nefropatia, są nieme. Wymaga to agresywnego, ukierunkowanego podejścia, ponieważ oczekiwanie na objawy będzie zbyt późne. Nawet neuropatia cukrzycowa będzie przebiegać bezobjawowo u 50% osób z mierzalnymi nieprawidłowościami.4
W niniejszym artykule dokonano przeglądu zaleceń zawartych w Standardach Opieki ADA 2017 dotyczących powikłań mikronaczyniowych oraz odpowiednich deklaracji stanowiska, a także zwrócono uwagę na profilaktyczne badania przesiewowe i perły kliniczne dla lekarza podstawowej opieki zdrowotnej leczącego pacjentów z cukrzycą.
- Retinopatia cukrzycowa
- Tabela 1. Stadia retinopatii wraz z opisem
- Perełki kliniczne
- Cukrzycowa choroba nerek
- Tabela 2. Select Landmark Studies Demonstrating Glycemic Control with A1c Below 7%
- Tabela 3. Estimated GFR with Stage and Description
- Tabela 4. Kategorie albuminurii w CKD
- Figura 1. Sugerowana częstość oceny (liczba wizyt w ciągu roku) według kategorii eGFR i albuminurii
- Tabela 5. Red Flags Suggesting Nondiabetic Glomerular Disease
- Tabela 6. Dose Adjustments and Recommendations for Glucose-lowering Agents in Patients with Renal Impairment
- Klasa
- Leki
- Perełki kliniczne
- Cukrzycowa neuropatia obwodowa
- Tabela 7. Other Causes of Neuropathy67
- Tabela 8. Powszechnie stosowane środki farmakologiczne w przypadku DPN4,69
- Perełki kliniczne
- Gastropareza
- Perełki kliniczne
- Cheiroartropatia cukrzycowa
- Wnioski
Retinopatia cukrzycowa
Retinopatia cukrzycowa jest częstym powikłaniem mikronaczyniowym cukrzycy typu 1 i typu 2. Szacuje się, że na całym świecie 3,7 miliona osób ma umiarkowany lub ciężki niedowidzenie z powodu retinopatii cukrzycowej, a ponad 800 000 osób na całym świecie jest niewidomych z powodu retinopatii cukrzycowej.5 Retinopatia cukrzycowa jest najczęstszą przyczyną nowo powstałej ślepoty u dorosłych w wieku 20-74 lat.6 Stwierdzono silną korelację z kontrolą glikemii, kontrolą ciśnienia tętniczego i czasem trwania choroby. Dzięki wczesnym, regularnym badaniom przesiewowym i kontroli tych czynników ryzyka retinopatia cukrzycowa może być wykryta i leczona w celu zapobiegania upośledzeniu widzenia.
Czas trwania cukrzycy jest największym czynnikiem ryzyka progresji retinopatii cukrzycowej. W cukrzycy typu 1 retinopatia występuje rzadko w ciągu pierwszych 3-5 lat lub przed okresem dojrzewania.7 W ciągu kolejnych 20 lat u prawie wszystkich pacjentów z cukrzycą typu 1 rozwinie się retinopatia cukrzycowa.7 U pacjentów z cukrzycą typu 2 aż 21% będzie miało pewien stopień retinopatii w momencie rozpoznania choroby.7 Przewlekła hiperglikemia, nefropatia, nadciśnienie tętnicze i dyslipidemia to inne czynniki, które zwiększają ryzyko retinopatii cukrzycowej lub są z nią związane.8 Do 50% pacjentów z albuminurią (niezależnie od poziomu szacowanego współczynnika filtracji kłębuszkowej) będzie miało retinopatię.9 W tabeli 1 opisano różne stadia retinopatii.
Tabela 1. Stadia retinopatii wraz z opisem |
|
|
Stopień |
Opis |
|
Łagodna Nie-…Proliferacyjna retinopatia cukrzycowa |
Mikrotętniaki obecne |
|
Umiarkowana nieproliferacyjna retinopatia cukrzycowa |
Mikrotętniaki, krwotoki w plamkach lub kropkach siatkówki, twarde wysięki, lub plamki waty mogą być obecne |
|
Szeroko nieproliferacyjna retinopatia cukrzycowa |
Wewnątrzsiatkówkowe krwotoki, paciorkowanie żylne, lub wewnątrzsiatkówkowe nieprawidłowości mikronaczyniowe mogą być obecne |
|
Proliferacyjna retinopatia cukrzycowa |
Nowaskularyzacja, krwotoki do ciała szklistego lub przedsiatkówkowe obecne |
Patofizjologia. Łagodne, nieproliferacyjne nieprawidłowości charakteryzujące się zwiększoną przepuszczalnością naczyń mogą przejść w umiarkowaną lub ciężką nieproliferacyjną retinopatię cukrzycową (NPDR).7 Proliferacyjna retinopatia cukrzycowa charakteryzuje się proliferacją nowych naczyń krwionośnych siatkówki.7 Obrzęk plamki, czyli centralne zgrubienie siatkówki z wysiękiem i obrzękiem, może wystąpić na każdym etapie retinopatii.7 Retinopatię cukrzycową może przyspieszyć ciąża, dojrzewanie, brak kontroli glikemii, nadciśnienie tętnicze i operacja zaćmy.7
Zapobieganie retinopatii cukrzycowej. Kontrola glikemii ma kluczowe znaczenie w zapobieganiu retinopatii cukrzycowej. W badaniu Diabetes Control and Complications Trial (DCCT) badacze oceniali wpływ ścisłej kontroli glikemii i progresji od braku retinopatii lub minimalnej retinopatii na poziomie wyjściowym do umiarkowanej NPDR.10 U pacjentów z grupy intensywnej terapii, u których na poziomie wyjściowym nie stwierdzono retinopatii, średnie ryzyko retinopatii zostało zmniejszone o 76% w ciągu 36 miesięcy.10 U pacjentów z grupy intensywnej terapii, u których już wystąpiło minimalne do umiarkowanego NPDR, ryzyko progresji było zmniejszone o 54% w porównaniu z pacjentami stosującymi leczenie konwencjonalne.10 W oryginalnym badaniu Action to Control Cardiovascular Risk in Diabetes (ACCORD) uczestników z cukrzycą typu 2 od 10 lat i znaną chorobą sercowo-naczyniową randomizowano do intensywnego lub standardowego leczenia glikemii, skurczowego ciśnienia tętniczego i dyslipidemii. Cztery lata później progresja retinopatii była mniejsza u osób z wcześniejszą intensywną kontrolą glikemii, niezależnie od podobnych aktualnych poziomów HbA1c.11 Podobnych efektów dziedziczenia nie zaobserwowano w grupach z intensywną kontrolą ciśnienia tętniczego lub przyjmujących fenofibrat na dyslipidemię.11
Badania przesiewowe. Ponieważ obrzęk plamki i retinopatia cukrzycowa proliferacyjna mogą przebiegać bezobjawowo, badania przesiewowe są niezbędne do wczesnego wykrywania i leczenia. U pacjentów z cukrzycą typu 1 badania przesiewowe należy rozpocząć po pięciu latach od rozpoznania choroby.8 U pacjentów z cukrzycą typu 2 badania przesiewowe należy rozpocząć w momencie rozpoznania choroby.8 Badania przesiewowe powinny być wykonywane przez okulistę lub optometrystę, który ma doświadczenie w zakresie retinopatii cukrzycowej. Badania przesiewowe powinny być przeprowadzane przy rozszerzonych oczach. Jeśli retinopatia jest już obecna, zalecane jest skierowanie do okulisty.8 Powtórna ocena powinna być przeprowadzana co roku, jeśli choroba jest minimalna lub nie występuje.8
Ciąża jest okresem wysokiego ryzyka wystąpienia retinopatii proliferacyjnej. U kobiet ciężarnych z istniejącą wcześniej cukrzycą typu 1 lub typu 2, badania okulistyczne powinny być wykonywane przed poczęciem lub w pierwszym trymestrze ciąży. Badania należy powtarzać w każdym trymestrze i przez rok po porodzie.8 W przypadku osób z cukrzycą ciążową nie ma konieczności wykonywania dodatkowych badań okulistycznych po porodzie.
Ciąża u pacjentek z istniejącą wcześniej cukrzycą typu 1 lub typu 2 może spowodować szybką progresję retinopatii cukrzycowej. Dotyczy to zwłaszcza sytuacji, gdy w momencie zapłodnienia występuje słaba kontrola glikemii.14 Kobiety chore na cukrzycę, które są w ciąży lub planują ciążę, powinny być poinformowane o ryzyku rozwoju lub progresji retinopatii cukrzycowej oraz o konieczności kontroli glikemii przed zapłodnieniem.8 Jednak wczesne pogorszenie retinopatii może nastąpić przy szybkim wdrożeniu intensywnego leczenia glikemii, jeśli retinopatia już występuje.8 Cukrzyca ciążowa nie wydaje się wiązać z takim samym ryzykiem rozwoju retinopatii cukrzycowej w czasie ciąży.8
Leczenie. Wykazano, że oprócz kontroli glikemii kontrola ciśnienia tętniczego (< 140 mmHg skurczowego) również zmniejsza progresję retinopatii cukrzycowej, ale nie ma dodatkowych korzyści ze ścisłej kontroli ciśnienia skurczowego < 120 mmHg.12 Fenofibrat również może spowalniać progresję retinopatii cukrzycowej, zwłaszcza w przypadku bardzo łagodnego NPDR, u pacjentów z dyslipidemią.13 Wykazano, że aspiryna nie ma wpływu na progresję retinopatii, rozwój wylewu krwi do ciała szklistego lub czas trwania wylewu krwi do ciała szklistego i może być bezpiecznie stosowana w innych wskazaniach medycznych bez zagrożenia dla oka.7
Leczenie pacjentów z cukrzycą powinno obejmować zalecenia dotyczące wysiłku fizycznego. Osoby z łagodną retinopatią nieproliferacyjną mogą bezpiecznie rozpocząć aktywność fizyczną. Jednak pacjenci z umiarkowaną retinopatią nieproliferacyjną powinni unikać czynności, które znacznie zwiększają ciśnienie krwi, takich jak podnoszenie ciężarów.15 Pacjenci z ciężką retinopatią nieproliferacyjną lub retinopatią niestabilną powinni unikać wszelkich energicznych ćwiczeń fizycznych (skakania, szarpania), czynności wykonywanych głową w dół i wstrzymywania oddechu.15 W przypadku krwotoku do ciała szklistego nie należy wykonywać żadnych ćwiczeń.15
Wczesne wykrycie retinopatii cukrzycowej jest ważne, ponieważ leczenie może zapobiec utracie wzroku lub ją odwrócić. W badaniu Diabetic Retinopathy Study (DRS) naukowcy stwierdzili, że operacja fotokoagulacji była skutecznym sposobem leczenia retinopatii cukrzycowej. Badanie Early Treatment Diabetic Retinopathy oraz DRS wykazały, że fotokoagulacja zmniejszała ryzyko utraty wzroku, przy czym największe korzyści odnosili pacjenci z bardziej zaawansowaną chorobą podstawową.16,17 Aktualne dane dostarczają dowodów na to, że dożylne leki anty-VEGF (antivascular endothelial growth factor) są skuteczniejsze w leczeniu obrzęku plamki niż monoterapia lub terapia skojarzona z koagulacją laserową.8 Ponadto leki anty-VEGF mogą poprawić widzenie, podczas gdy fotokoagulacja zapobiega jedynie dalszej utracie wzroku.18,19 Jedną z wad anty-VEGF jest konieczność comiesięcznej terapii dożylnej przez pierwsze 12 miesięcy.
Perełki kliniczne
- Nie ma specyficznych oznak ani objawów wczesnej retinopatii cukrzycowej.
- Badania przesiewowe w kierunku retinopatii cukrzycowej powinny być wykonywane u pacjentów:
– z cukrzycą typu 1 pięć lat po rozpoznaniu.
– u pacjentów z cukrzycą typu 2 w momencie rozpoznania.
- Poradnictwo i wzmożone badania należy zapewnić kobietom chorym na cukrzycę, które planują ciążę lub są w ciąży, ponieważ retinopatia cukrzycowa może gwałtownie przyspieszyć w czasie ciąży.
- Ścisła kontrola glikemii i kontrola ciśnienia tętniczego (< 140 mmHg skurczowego) może zapobiec rozwojowi retinopatii cukrzycowej.
- Do 50% pacjentów z albuminurią (niezależnie od poziomu eGFR) będzie miało retinopatię.9
- Leczenie fotokoagulacją może zapobiec postępowi choroby, a leczenie anty-VEGF może odwrócić utratę wzroku spowodowaną obrzękiem plamki.
Cukrzycowa choroba nerek
Cukrzycowa choroba nerek (DKD), terminologia preferowana przez ADA, jest główną przyczyną przewlekłej choroby nerek (CKD) w Stanach Zjednoczonych.20,21 DKD ma znaczący długoterminowy wpływ na jakość życia pacjentów z cukrzycą i jest odpowiedzialna nawet za 40% przypadków schyłkowej niewydolności nerek (end-stage renal disease – ESRD).20 Na podstawie inicjatywy National Kidney Foundation’s Kidney Disease Outcomes Quality Initiative (KDOQI) oraz Standardów Opieki ADA 2017 w tej części zostaną przedstawione wytyczne dotyczące docelowych poziomów HbA1c, postępowania z lekami oraz postępowania terapeutycznego u pacjentów z DKD.
KDOQI stratyfikuje docelowy poziom HbA1c na podstawie ryzyka hipoglikemii i chorób współistniejących u pacjenta. Inicjatywa ta opiera się na trzech publikacjach, w których wykazano, że kontrola glikemii z HbA1c poniżej 7% zapobiega lub zmniejsza progresję choroby nerek u pacjentów z cukrzycą typu 2.22,23,24 Badania te podsumowano w tabeli 2. ADA zaleca, aby u pacjentów z podwyższonym ryzykiem hipoglikemii docelowa wartość HbA1c była wyższa niż 7%.8 KDOQI zaleca, aby u pacjentów z CKD w stadium 4 i 5, u których przewidywana długość życia jest ograniczona, utrzymywać wartość HbA1c wyższą niż 7%.25
Tabela 2. Select Landmark Studies Demonstrating Glycemic Control with A1c Below 7% |
||
|
Trial |
Results |
|
|
Action in Diabetes and Vascular Disease: Preterax and Diamicron Modified Release Controlled Evaluation (ADVANCE) Trial22 |
21% redukcja nowej makroalbuminurii i leczenie nerkozastępcze przy A1c poniżej 7% |
|
|
Veterans Affairs Diabetes Trial (VADT)23 |
37% redukcja makroalbuminurii i 32% redukcja mikroalbuminurii przy A1c poniżej 7% |
|
|
Badanie Action to Control Cardiovascular Risk in Diabetes (ACCORD)24 |
. |
2% redukcja makroalbuminurii i 21% redukcja mikroalbuminurii przy A1c poniżej 7% |
Epidemiologia. Mężczyźni i kobiety są w równym stopniu dotknięci DKD.20 Szczyt zachorowalności na DKD przypada na 15 lat po rozpoznaniu choroby.21 Afroamerykanie są trzy do pięciu razy bardziej narażeni na rozwój nefropatii cukrzycowej niż osoby rasy kaukaskiej.20 Meksykanie i Indianie Pima również mają większe ryzyko rozwoju DKD.20
Białkomocz jest predyktorem chorobowości sercowo-naczyniowej i śmiertelności z wszystkich przyczyn w cukrzycy.21 Obecność DKD jest czynnikiem zwiększonego ryzyka chorób sercowo-naczyniowych. Pacjenci z DKD są konsekwentnie narażeni na większą śmiertelność z powodu chorób układu sercowo-naczyniowego.26 Ponadto śmiertelność z powodu wszystkich przyczyn jest większa u pacjentów z DKD.21
W cukrzycy typu 1 powikłania mikronaczyniowe, takie jak DKD, zaczynają się rozwijać po około 10-20 latach od rozpoznania choroby; w cukrzycy typu 2 dokładny początek często nie jest znany, co uzasadnia wcześniejsze badania przesiewowe.27
Patofizjologia i patogeneza. Uważa się, że hiperglikemia wywołuje trzy główne zmiany histologiczne w kłębuszkach nerkowych prowadzące do DKD: 1) rozrost mezangium, 2) pogrubienie błony podstawnej kłębuszków nerkowych i 3) stwardnienie kłębuszków nerkowych.28 Chociaż dokładna patogeneza przyczyn powstawania DKD nie jest znana, uważa się, że hiperglikemia początkowo powoduje hiperfiltrację i uszkodzenie nerek w wyniku zmian histologicznych i aktywacji cytokin.20 Zazwyczaj albuminuria może być pierwszym objawem DKD.29
Jest to jeszcze bardziej nasilone w wyniku współistniejących stanów hiperlipidemii, miażdżycy, nadciśnienia tętniczego i otyłości, które przyczyniają się do uszkodzenia nerek i późniejszego pogorszenia ich funkcji. Otyłość centralna prowadzi do nadciśnienia tętniczego poprzez hiperaktywację układu renina-angiotensyna-aldosteron i współczulnego układu nerwowego.20 Ponadto, w miarę jak naczynia nerkowe ulegają miażdżycy, dochodzi do zwiększonej progresji nefropatii cukrzycowej. Ważną cechą wyróżniającą nefropatię cukrzycową w porównaniu z innymi postaciami CKD jest to, że kłębuszki nerkowe i nerki zwykle są początkowo prawidłowe lub powiększone.20
Klasyfikacja. Zarówno eGFR, jak i obecność albuminurii są wykorzystywane do oceny zaawansowania CKD.30,31 eGFR jest oparty na rasie, wieku, płci, masie ciała i stężeniu kreatyniny w surowicy. (Patrz Tabela 3.) Historycznie, termin mikroalbuminuria był używany do określenia umiarkowanie zwiększonego stężenia albumin. National Kidney Foundation zaleca obecnie stosowanie terminów „łagodny”, „umiarkowany” lub „znacznie zwiększony” do opisywania poziomów albuminurii na podstawie poziomów przedstawionych w tabeli 4.31 Stosunek albuminy do kreatyniny jest wstępnym badaniem stosowanym do wykrywania albuminurii.
Tabela 3. Estimated GFR with Stage and Description |
|||
|
Stage |
GFR (mL/min per 1.73 m2) |
Opis |
|
|
90+ |
Przekroczenie filtracji kłębuszkowej |
||
|
Łagodnie obniżona funkcja nerek |
|||
|
3A |
Umiarkowanie zmniejszona funkcja nerek |
||
|
3B |
|||
|
Skrajnie ograniczona funkcja nerek |
|||
|
< 15 lub dializowany |
Końcowastadium niewydolności nerek |
||
Tabela 4. Kategorie albuminurii w CKD |
||
|
Kategorie |
Albuminuria do |
Normalny do łagodnie podwyższonego |
|
A2 |
Umiarkowanie podwyższone |
|
|
A3 |
> 300 |
Silnie podwyższone |
Dwa schematy klasyfikacji reprezentują podwójną drogę do rozwoju CKD. Jedną z nich jest podwyższenie stężenia kreatyniny i pogorszenie GFR. Druga – przez rozwój albuminurii. Narastanie albuminurii często wiąże się ze spadkiem eGFR;32 można jednak temu zapobiec, stosując inhibitory konwertazy angiotensyny (ACE) lub blokery receptora angiotensyny (ARB) oraz kontrolując glikemię. (Patrz rycina 1.)
Figura 1. Sugerowana częstość oceny (liczba wizyt w ciągu roku) według kategorii eGFR i albuminurii
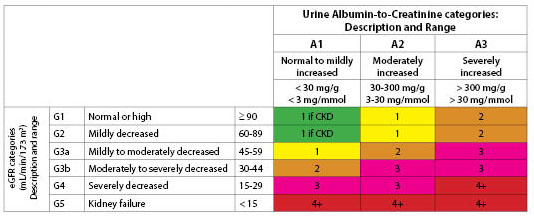
Przedrukowano za zgodą z Kidney Disease: Improving Global Outcomes (KDIGO).
Współczesne objawy. Większość ludzi nie ma żadnych objawów nefropatii cukrzycowej. Często pacjenci mogą mieć dowody lub rozpoznanie innych powikłań mikronaczyniowych.20 Wczesna DKD zwykle przebiega bezobjawowo. Późnym objawem DKD jest pienisty mocz. Ponadto, jeśli u pacjenta występuje ciężka hipoalbuminemia, może on prezentować obrzęki pedałów i zmęczenie.20 U pacjentów z DKD typowe jest nadciśnienie systemowe. Pacjenci z nefropatią cukrzycową zazwyczaj mają również retinopatię i neuropatię.8
Opcje diagnostyczne. Ponieważ nie występują objawy, rutynowe badania przesiewowe są niezbędne. ADA zaleca coroczne badanie stosunku albuminy w moczu do kreatyniny.8 Ponadto, co najmniej raz w roku należy badać eGFR u pacjentów z cukrzycą typu 1 trwającą 5 lat oraz u wszystkich pacjentów z cukrzycą typu 2 lub u pacjentów z nadciśnieniem tętniczym i cukrzycą.8 Nie ma jednoznacznych zaleceń dotyczących wykonywania badań obrazowych, takich jak badanie ultrasonograficzne, w celu rozpoznania DKD.
Diagnostyka różnicowa. Niektóre czerwone flagi mogą sugerować, że cukrzyca nie jest jedyną przyczyną CKD. Jeśli u danej osoby występuje zaawansowana CKD bez dowodów na inne powikłania mikronaczyniowe, jest to sygnał ostrzegawczy. Nadmierny białkomocz z nagłym pojawieniem się (mniej niż 5 lat od początku cukrzycy) osadu moczu z dysmorficznymi czerwonymi krwinkami i odlewami lub nagłym zmniejszeniem GFR sugeruje chorobę nerek o etiologii innej niż cukrzycowa.20 Elektroforezę surowicy lub moczu można wykonać, jeśli istnieje obawa, że może to być szpiczak mnogi. Brak albuminurii przy zmniejszonym eGFR i cukrzycy wymaga zbadania w kierunku innych przyczyn CKD niż DKD.21 W tabeli 5 wymieniono czerwone flagi sugerujące niecukrzycową chorobę kłębuszków nerkowych.
Tabela 5. Red Flags Suggesting Nondiabetic Glomerular Disease
- Początek białkomoczu < 5 lat od udokumentowanego początku cukrzycy typu 1 lub ostrego początku choroby nerek
- Gwałtowny spadek eGFR; Nefropatia cukrzycowa
- Osad z moczu zawierający dysmorficzne krwinki czerwone lub odlewy komórkowe
- Brak innych powikłań mikronaczyniowych, takich jak neuropatia lub retinopatia
- Znaki i/lub objawy innej choroby ogólnoustrojowej
Leczenie. Cechą charakterystyczną nefropatii cukrzycowej jest kontrola stężenia glukozy, redukcja soli, ciśnienia tętniczego i dyslipidemii. Ponadto chorzy powinni unikać leków nefrotoksycznych i suplementów diety, takich jak aminoglikozydy i niesteroidowe leki przeciwzapalne. Pacjenci powinni być kierowani do nefrologa w IV stadium choroby nerek lub w przypadku gwałtownie pogarszającej się funkcji nerek. Inne wskazania do skierowania zależą od złożoności przypadku. Nowsze doustne leki przeciwcukrzycowe mogą pomóc w zapobieganiu postępowi niewydolności nerek.
Kontrola glikemii. Wybór leków, ich monitorowanie i farmakologia mają wpływ na pacjentów z nefropatią cukrzycową. W miarę obniżania się eGFR pacjenta niektóre leki doustne będą wymagały dostosowania dawki. Insulina pozostaje podstawową terapią w celu kontroli glikemii u pacjentów z cukrzycą i zaawansowaną CKD.31 W tabeli 6 przedstawiono zalecane dostosowanie dawki leków przeciwglikemicznych u pacjentów z chorobą nerek. W 2016 roku wykazano, że zarówno empagliflozin, jak i kanagliflozin zmniejszają progresję CKD i mikroalbuminurię.33,34 Empagliflozin obniżył wskaźniki progresji nefropatii i zmniejszył ryzyko poważnych niepożądanych zdarzeń sercowo-naczyniowych w porównaniu z placebo po dodaniu do standardowej opieki nad chorymi na cukrzycę typu 2 w przełomowym badaniu Empagliflozin Cardiovascular Outcome Event Trial in Type 2 Diabetes Mellitus Patients (EMPA-REG).33
Tabela 6. Dose Adjustments and Recommendations for Glucose-lowering Agents in Patients with Renal Impairment |
||||
|
Glucose-obniżające poziom glukozy |
Dostosowanie dawkowania u pacjentów z niewydolnością nerek |
|||
Klasa |
Leki |
|||
|
Biguanidy |
Metformina |
eGFR 30 do 45 mL/min/1.73 m2: Nie zaleca się rozpoczynania terapii. Jeśli po rozpoczęciu leczenia, należy ocenić korzyści/ryzyko kontynuacji terapii. eGFR < 30 mL/min/1,73 m2: Stosowanie jest przeciwwskazane |
||
|
Sulfonylomoczniki |
Glimepiryd |
Łagodne do umiarkowanego upośledzenie: Rozpoczynać od dawki 1 mg raz na dobę Silne zaburzenia: Stosowanie jest przeciwwskazane |
||
|
Glipizyd |
O przedłużonym uwalnianiu: Rozpoczynać od dawki 2,5 mg raz na dobę |
|||
|
Gliburyd |
eGFR < 60 mL/min/1,73 m2: Stosowanie nie jest zalecane |
|||
|
Meglitynidy |
Nateglinid |
Brak konieczności modyfikacji dawki |
Brak konieczności modyfikacji dawki |
. nie jest konieczna zmiana dawkowania |
|
Repaglinid |
CrCl 20 do 40 mL/min: Rozpoczynać od dawki 0.5 mg z posiłkami CrCl < 20 mL/min: Brak informacji |
|||
|
Thiazolidinediones |
Pioglitazon |
Brak konieczności dostosowania dawki Konieczne |
||
|
Rosiglitazon |
Brak konieczności dostosowania dawki |
|||
|
α-.Inhibitory glukozydazy |
Akarboza |
SCr > 2.0 mg/dl: Use is not recommended |
||
|
Miglitol |
CrCl < 25 mL/min lub SCr >2.0 mg/dl: stosowanie nie jest zalecane |
|||
|
InhibitoryDPP-4 |
Alogliptyna |
CrCl 30 do 60 mL/min: 12.5 mg raz na dobę CrCl < 30 mL/min: 6,25 mg raz na dobę ESRD wymagający hemodializy: 6.25 mg raz na dobę i podawać bez względu na czas hemodializy |
||
|
Linagliptyna |
Bez konieczności zmiany dawkowania |
|||
|
Saksagliptyna |
CrCl ≤ 50 mL/min: 2.5 mg raz na dobę ESRD wymagająca hemodializy: 2.5 mg raz na dobę i podawać po hemodializie |
|||
|
Sitagliptyna |
CrCl 30 do 50 mL/min: 50 mg raz na dobę CrCl < 30 mL/min: 25 mg raz na dobę ESRD wymagająca hemodializy lub dializy otrzewnowej: 25 mg raz na dobę i podawać bez względu na czas hemodializy |
|||
|
Wildagliptyna |
CrCl < 50 mL/min: 50 mg raz na dobę |
|||
|
Sekwestranty kwasów żółciowych |
Kolesevelam |
Nie ma konieczności zmiany dawkowania |
||
|
Dopamina-.2 agoniści |
Bromokryptyna |
Brak informacji |
||
|
Inhibitory SGLT-2 |
Kanagliflozin |
eGFR 45 do 60 mL/min/1.73 m2: Nie należy przekraczać dawki 100 mg raz na dobę eGFR < 45 mL/min/1,73 m2: Nie zaleca się rozpoczynania leczenia. Jeśli po rozpoczęciu leczenia, należy przerwać terapię u pacjentów z eGFR utrzymującym się < 45 mL/min/1,73 m2. eGFR < 30 mL/min/1,73 m2/ESRD/Hemodializa: Stosowanie jest przeciwwskazane |
||
|
Dapagliflozin |
eGFR < 60 mL/min/1,73 m2: Nie zaleca się rozpoczynania terapii. Jeśli po rozpoczęciu leczenia, należy przerwać terapię u pacjentów z eGFR utrzymującym się w zakresie od 30 do < 60 mL/min/1,73 m2. eGFR < 30 mL/min/1,73 m2/ESRD/Hemodializa: Stosowanie jest przeciwwskazane |
|||
|
Empagliflozin |
eGFR < 45 mL/min/1,73 m2: Nie zaleca się rozpoczynania leczenia. Jeśli po rozpoczęciu leczenia, należy przerwać terapię u pacjentów z eGFR utrzymującym się < 45 mL/min/1,73 m2. eGFR < 30 mL/min/1,73 m2. ESRD/ Hemodializa: Use is contraindicated |
|||
|
GLP-.Agoniści receptora 1 |
Albiglutyd |
Nie ma konieczności dostosowania dawki |
||
|
Dulaglutyd |
Brak konieczności dostosowania dawki |
|||
|
Eksenatyd |
CrCl 30 do 50 mL/min: Brak informacji. Stosować z zachowaniem ostrożności. CrCl < 30 mL/min/ ESRD: Stosowanie nie jest zalecane |
|||
|
Liraglutyd |
Brak informacji |
|||
|
Liksisenatyd |
eGFR 15 do 29 mL/min/1.73 m2: Brak informacji. Monitorować pod kątem nasilenia działań niepożądanych ze strony przewodu pokarmowego, które mogą prowadzić do odwodnienia i pogorszenia czynności nerek. eGFR <15 mL/min/1.73 m2/ ESRD: Stosowanie nie jest zalecane |
|||
|
Mimetyki amyliny |
Pramlintid |
CrCl ≥15 mL/min: Nie ma konieczności dostosowania dawki ESRD: Brak informacji |
||
|
Insuliny |
Rapid-działające analogi
Skrótko działająca
Średnio działająca
Pośredniodziałająca
Analogi insuliny bazalnej
|
Zapotrzebowanie na insulinę może być zmniejszone z powodu zmian w klirensie lub metabolizmie insuliny. Należy ściśle monitorować stężenie glukozy we krwi. |
||
Ciśnienie tętnicze krwi. U pacjentów z cukrzycą i cukrzycową chorobą nerek leczenie ciśnienia tętniczego należy rozpocząć od wartości 140/90 mmHg.37 W badaniu United Kingdom Prospective Diabetes Study (UKPDS) stwierdzono zmniejszenie ryzyka powikłań cukrzycowych o 12% na każde 10 mmHg spadku ciśnienia skurczowego do wartości 120 mmHg.38 Lekami z wyboru pozostają inhibitory ACE lub ARB u osób z nadciśnieniem tętniczym i cukrzycą, DKD i CKD. Wykazano, że inhibicja ACE opóźnia rozwój DKD, jeśli rozpoczyna się ją u pacjentów z łagodnie podwyższoną albuminurią. Kreatynina może wzrosnąć nawet o 30% po rozpoczęciu stosowania inhibitora ACE lub ARB.39 Należy rozważyć ocenę innych chorób nerek, jeśli kreatynina wzrośnie powyżej tej wartości.
KDOQI zaleca, aby nie podawać inhibitorów ACE/ARB pacjentom z cukrzycą typu 2, którzy są normotensyjni i mają normoalbuminurię.40,41,42 Inhibitory ACE lub ARB są zalecane u chorych na cukrzycę, u których występuje normotensja i mikroalbuminuria.31,37 Nie ma określonej dawki ani sposobu miareczkowania u tych osób. Podwójna blokada układu renina-angiotensyna przez ACE i ARB nie jest zalecana ze względu na zwiększone ryzyko hiperkaliemii, upośledzenia czynności nerek i niedociśnienia tętniczego.43
Zmniejszenie spożycia soli. W badaniach Reduction of Endpoints in Non-insulin-dependent diabetes mellitus with the Angiotensin II Antagonist Losartan (RENAAL) Trial (2012) i Irbesartan Diabetic Nephropathy Trial (IDNT) wykazano, że dieta niskosodowa zwiększa działanie nefroprotekcyjne i kardioprotekcyjne ARB u pacjentów z cukrzycą typu 2 i nefropatią cukrzycową.44,45
Dializa nerkowa i przeszczep nerki. Pacjenci z ESRD powinni być kierowani do nefrologii. Opcje leczenia obejmują dializę otrzewnową lub hemodializę, transport nerek lub możliwość przerwania leczenia i rozpoczęcia opieki paliatywnej lub hospicyjnej. W jednym z badań obserwacyjnych stwierdzono, że pacjenci, którzy rozpoczynali dializy w młodszym wieku (< 60 lat), mieli gorszą przeżywalność.46
Skierowanie. Rycina 1 zawiera wskazania do skierowania na podstawie klasyfikacji GFR i albuminurii. Należy rozważyć inne przyczyny choroby nerek niezwiązane z cukrzycą, zwłaszcza u chorych na cukrzycę typu 1, u których wystąpienie retinopatii nie poprzedza rozwoju nefropatii.21 Nefrolodzy mogą pomóc w wyjaśnieniu rozpoznania, kontroli opornego nadciśnienia tętniczego i hiperkaliemii oraz przygotowaniu chorych do dializoterapii.8
Należy również wziąć pod uwagę, że rozwój nefropatii może nie być związany z samą cukrzycą. U pacjentów z cukrzycą typu 1 wystąpienie retinopatii zwykle poprzedza rozwój nefropatii.47 U osoby, u której występuje nefropatia, ale nie ma retinopatii, należy przeprowadzić ocenę w kierunku innych przyczyn. Skierowanie do nefrologa powinno nastąpić w celu ustalenia przyczyny nefropatii, gdy jest ona niepewna lub gdy występują trudne do opanowania problemy związane z DKD, w tym niedokrwistość, nadczynność przytarczyc i postępująca choroba nerek z eGFR < 30 mL/min/1,73 m2.8 Konsultacja nefrologa w momencie rozwoju stadium 4 CKD (eGFR < 30 mL/min/1,73 m2) wiąże się z mniejszą zachorowalnością, mniejszymi kosztami opieki zdrowotnej i opóźnieniem dializoterapii.48 Należy rozważyć skierowanie na leczenie w stadium 3B, aby wcześniej przygotować pacjentów i umożliwić nefrologii maksymalne leczenie farmakologiczne.
Perełki kliniczne
- Roczna kontrola DKD powinna polegać na badaniu stężenia albuminy w moczu i pomiarze eGFR.
- Kontrola ciśnienia tętniczego i stężenia glukozy może zapobiegać progresji nefropatii. U pacjentów z cukrzycą i CKD należy utrzymywać ciśnienie tętnicze < 140/90 mmHg. Inhibitory ACE lub ARBs powinny być leczeniem z wyboru.
- Inhibitory ACE i ARBs nie powinny być stosowane w celu zapobiegania nefropatii, jeśli ciśnienie krwi i wydalanie białka są prawidłowe. Inhibitory ACE i ARB nie powinny być stosowane w skojarzeniu.
- Pacjenci z CKD w stadium 3-5 mają zwiększone ryzyko hipoglikemii. Należy zachować ostrożność podczas stosowania środków doustnych, takich jak sulfonylomoczniki.
- W przypadku niektórych pacjentów z CKD właściwe jest ustalenie docelowej wartości HbA1c > 7%, zwłaszcza gdy ryzyko hipoglikemii jest duże.
Cukrzycowa neuropatia obwodowa
Powszechnie przyjętą w praktyce klinicznej definicją cukrzycowej neuropatii obwodowej (DPN) jest „obecność objawów i/lub oznak dysfunkcji nerwów obwodowych u osób z cukrzycą po wykluczeniu innych przyczyn.”49 Klasyfikacja ADA dystalnej symetrycznej polineuropatii to: 1) neuropatia głównie małych włókien, 2) neuropatia głównie dużych włókien oraz 3) mieszana neuropatia małych i dużych włókien (najczęstsza).
Patofizjologia i patogeneza. Rozwój i progresja DPN wynikają ze złożonych relacji między nerwami i otaczającymi je komórkami.50 Zarówno czynniki naczyniowe, jak i interakcje metaboliczne przyczyniają się do wszystkich etapów DPN.51 Ogólnie przyjętym rozumieniem cukrzycy u ludzi prowadzącej do rozwoju DPN jest złożona interakcja między hiperglikemią, czasem trwania cukrzycy, związanymi z wiekiem uszkodzeniami neuronów, stopniem kontroli ciśnienia tętniczego i stężenia lipidów we krwi oraz masą ciała.52,53,54,55 Hiperglikemia aktywuje liczne szlaki biochemiczne, które determinują stan metaboliczny komórki nerwowej i łączy się z upośledzoną perfuzją nerwów, przyczyniając się do progresji neuropatii. Przełomowe badanie DCCT potwierdza znaczenie hiperglikemii w patogenezie neuropatii.10,56,57 Innym związanym z hiperglikemią mechanizmem prowadzącym do DPN jest wywołany hiperglikemią stres oksydacyjny i nitrozacyjny ze wzrostem produkcji wolnych rodników.58,59
Oprócz hiperglikemii, ostatnio zasugerowano, że nisko nasilony stan zapalny może odgrywać ważną rolę w patogenezie neuropatii cukrzycowej, prowadząc do deficytów w obwodowych i autonomicznych włóknach nerwowych.51,60 Złożony zestaw czynników metabolicznych i naczyniowych wyzwala brak równowagi między uszkodzeniami a naprawą włókien nerwowych, szczególnie wpływając na dystalne włókna czuciowe i przyczyniając się do stopniowej utraty czucia, która manifestuje się klinicznymi objawami polineuropatii cukrzycowej.58,61
Wspólne objawy. Pytając o objawy DPN, należy zwrócić uwagę na lokalizację (najczęściej odczuwane w dłoniach i stopach), czynniki wywołujące, charakterystykę dolegliwości, a także początek i częstość zaostrzeń nocnych, ponieważ objawy są specyficzne dla danego pacjenta.4 Podwyższone stężenie glukozy we krwi wpływa zarówno na małe, jak i duże włókna nerwowe, a odczuwane objawy różnią się w zależności od klasy włókien czuciowych. Gdy dotknięte chorobą włókna nerwowe są w przeważającej mierze małe, wywoływane objawy to zwykle ból (kłujący, lancetowaty, kłujący, piekący, bolący, nużący i nadmiernie wrażliwy), dysestezje (nieprzyjemne uczucie pieczenia, mrowienia, kłucia i uderzania) oraz drętwienie.4
Intensywność dyskomfortu może wahać się od odczuwania niewielkich nietypowych wrażeń do bycia niepełnosprawnym przez ból, który może nasilać się w nocy i zakłócać sen, co, jak wykazano, wiąże się z depresją ze względu na postrzeganie obniżonej jakości życia.4
Z drugiej strony, gdy uszkodzone są głównie duże włókna, pacjenci mogą odczuwać drętwienie i mrowienie w kończynach, doświadczać niestabilnego chodu i tracić równowagę (co prowadzi do potencjalnych upadków).4 Niektórzy pacjenci mogą doświadczać pogorszenia objawów w miarę zmniejszania się stężenia glukozy we krwi z powodu intensyfikacji postępowania terapeutycznego w cukrzycy. Pacjenci mogą być bezobjawowi, ale z różnym stopniem utraty czucia; niepożądanym skutkiem ciężkiej utraty czucia spowodowanej neuropatią cukrzycową może być bezbolesny uraz, prowadzący do zwiększonego ryzyka owrzodzenia stopy lub, w ciężkich przypadkach, amputacji.62
Najczęstszą postacią obwodowej neuropatii cukrzycowej jest dystalna symetryczna polineuropatia z postępującą utratą czuciowych włókien nerwowych.4 Typowy obustronny wzór „pończochy” powstaje w wyniku uszkodzenia najbardziej dystalnych odcinków najdłuższych nerwów (dotkniętych chorobą jako pierwsze).63,64,65 W miarę upływu czasu, w wyniku proksymalnego postępowania deficytów nerwowych powstaje wzór „pończochy-rękawiczki”, promujący utratę czucia i typowe objawy DNP.4
Diagnostyka kliniczna. Rozpoznanie kliniczne DPN można postawić na podstawie objawów neuropatii u chorego na cukrzycę po wykluczeniu innych przyczyn neuropatii.66 Bezobjawowa obwodowa neuropatia cukrzycowa może występować nawet u 50% chorych z tym powikłaniem, dlatego wdrożenie profilaktycznej pielęgnacji stóp jest niezbędne, zwłaszcza u osób, które są w grupie wysokiego ryzyka urazów z powodu niewrażliwych stóp.4 Coroczne badania przesiewowe w kierunku DPN powinny być przeprowadzane u wszystkich chorych na cukrzycę poprzez badanie uszczypnięć, temperatury, odczuwania wibracji (przy użyciu widełek stroikowych 128 Hz), czucia ucisku przez 10-g monofilament oraz głębokich odruchów ścięgnistych w stawie skokowym; potencjalne owrzodzenia stóp można przewidzieć na podstawie utraty czucia przez 10-g monofilament (utrata czucia ochronnego) i zmniejszonego odczuwania wibracji.63 Standardy opieki medycznej w cukrzycy ADA’s Standards of Medical Care in Diabetes-2017 nadal zalecają coroczne wykonywanie testu 10-g monofilamentu w celu identyfikacji pacjentów zagrożonych rozwojem owrzodzenia i amputacją.8 Ponadto wytyczne ADA z 2017 roku zalecają badania przesiewowe w kierunku DPN przy rozpoznaniu cukrzycy typu 2 i pięć lat po rozpoznaniu cukrzycy typu 1.8
W 2009 roku Toronto Consensus Panel on Diabetic Neuropathies zaktualizował kryteria diagnostyczne, aby zapewnić kategorie diagnostyczne. Ponadto w procesie diagnostycznym świadczeniodawcy mogą wykorzystywać kilka dobrze zwalidowanych narzędzi przesiewowych, w tym Michigan Neuropathy Screening Instrument (MNSI), Toronto Clinical Neuropathy Score oraz Utah Neuropathy Scale. W tabeli 7 opisano inne przyczyny neuropatii, które należy wykluczyć.
Tabela 7. Other Causes of Neuropathy67
- Alkohol lub inne toksyny
- Leki neurotoksyczne, zwłaszcza chemioterapia
- Niedobór witaminy B12
- Niedoczynność tarczycy
- Choroba wrotna
- Złośliwe nowotwory (szpiczak mnogi, rak oskrzeli)
- Ludzki wirus niedoboru odporności (HIV)
- Przewlekła zapalna neuropatia demielinizacyjna, neuropatie dziedziczne i zapalenie naczyń
Badania diagnostyczne. Istnieje kilka badań diagnostycznych, które mogą potwierdzić obecność DPN. Badania przewodnictwa nerwowego są od lat uważane za złoty standard diagnostyczny dla DPN ze względu na ich obiektywne pomiary bez odpowiedzi pacjentów, co prowadzi do wysokiej wiarygodności.4 Ilościowe testy sensoryczne oceniają zdolność pacjentów do wykrywania lekkiego dotyku, wibracji i dyskryminacji temperatury, co wiąże się z pewnym poziomem subiektywności.4 Inne metody, w tym biopsja skóry i śródnaskórkowa gęstość włókien nerwowych oraz mikroskopia konfokalna rogówki, nie są stosowane rutynowo w praktyce klinicznej, ale mogą być wykorzystywane w badaniach klinicznych.4
Możliwości leczenia: Leczenie farmakologiczne. Leczenie farmakologiczne DPN ma na celu poprawę objawową, a więc stosowane leki nie mają na celu zapobiegania progresji choroby. Tabela 8 zawiera podsumowanie leków z trzech najczęściej stosowanych klas (leki przeciwdrgawkowe, przeciwdepresyjne i opioidy) w celu kontroli objawów neuropatii. Mimo że kilka leków jest powszechnie stosowanych jako początkowe postępowanie w DPN, tylko pregabalina i duloksetyna zostały zatwierdzone przez FDA do leczenia tego schorzenia; dlatego każdy z tych leków jest zalecany jako pierwszy wybór w przypadku objawowego bólu neuropatycznego.4 Gabapentyna, mimo że nie została zatwierdzona przez FDA do stosowania w leczeniu DPN, jest często stosowana jako lek początkowy, a jej skuteczność jest porównywalna ze skutecznością leków zatwierdzonych przez FDA. Trójpierścieniowe leki przeciwdepresyjne (np. amitryptylina) – niezatwierdzone przez FDA do stosowania w leczeniu DPN – są skuteczne w leczeniu DPN, ale należy je stosować ostrożnie ze względu na większe ryzyko działań niepożądanych.
Tabela 8. Powszechnie stosowane środki farmakologiczne w przypadku DPN4,69 |
|||||
|
Składnik farmakologiczny (zakres NNT 30-.50% poprawa*) |
Maksymalna dawka dobowa dla DNP (mg/dobę) |
Wspólne działania niepożądane |
Czy konieczna jest zmiana dawki? |
Przeciwwskazania |
Wskazania do stosowania |
|
Leki przeciwdrgawkowe
|
|||||
|
Pregabalina (3.3-8.3) |
Zawroty głowy Somnolencja Zwiększenie masy ciała Obrzęki obwodowe Niewyraźne widzenie Zaparcia |
Wątroba: Tak Wątroba: Nie |
Nadwrażliwość na pregabalinę |
Silne dowody; zatwierdzony przez FDA; substancja kontrolowana |
|
|
Gabapentyna (3.3-7.2) |
3,600 |
Zawroty głowy Ataksja Somnolencja Ból głowy Nudności Biegunka Zwiększenie masy ciała |
Renal: Tak Wątroba: Nie |
Nadwrażliwość na gabapentynę |
Umiarkowane dowody; niezatwierdzone przez FDA |
|
Leki przeciwdepresyjne
|
|||||
|
Amitryptylina (2.1-4.2) |
Szerokie uspokojenie; konfuzja; działanie antycholinergiczne (zaparcia, niewyraźne widzenie) |
Renal: Nie Wątrobowe: Nie Zaleca się stosowanie mniejszych dawek u pacjentów w podeszłym wieku |
Nadwrażliwość na amitryptylinę; jednoczesne stosowanie z IMAO lub w ciągu 14 dni; jednoczesne stosowanie z cyzaprydem; ostra faza zdrowienia po zawale mięśnia sercowego |
Umiarkowane dowody; niezatwierdzony przez FDA; ostrożnie stosować u osób z chorobą sercowo-naczyniową w wywiadzie |
|
|
Duloksetyna (3.8-11) |
(USA) |
Nudności; sedacja; uogólniona senność |
Renal: Yes Hepatic: Unikać stosowania w zaburzeniach czynności wątroby |
Nadwrażliwość; jednoczesne stosowanie z lub w ciągu 14 dni z MAO; rozpoczynanie leczenia u osób otrzymujących linezolid lub dożylnie błękit metylenowy |
Umiarkowane dowody; FDA approved; można dodać do pregabaliny lub gabapentyny |
|
Venlafaksyna (5.2-8.4) |
Nudności; sedacja; uogólniona senność |
Wątroba: Tak Wątroba: Yes |
Weak evidence; not FDA approved; may be added to gabapentin |
||
|
Opioidy
|
|||||
|
Tramadol (2.1-6.4) |
Somnolencja Nudności Wymioty Zaparcia Światłowstręt Zawroty głowy Ból głowy |
Renal: Yes Hepatic: Nie |
Nadwrażliwość na tramadol, opioidy lub którykolwiek składnik preparatu; formułaER: znaczna depresja oddechowa i ostra lub ciężka astma; formułaIR: ostre zatrucie alkoholem, środkami hipnotycznymi, narkotycznymi, działającymi ośrodkowo lekami przeciwbólowymi, opioidami lub lekami psychotropowymi |
Mały potencjał nadużywania (substancja kontrolowana według schematu IV); niezalecany do stosowania jako lek pierwszego lub drugiego rzutu |
|
|
Tapentadol (N/A) |
Immediate-release: Przedłużone uwalnianie: |
Somnolencja Nudności Wymioty Zaparcia Zawroty głowy |
Renal: Nie zaleca się stosowania, gdy Wątroba: Nie |
Nadwrażliwość na tapentadol; znacząca depresja oddechowa; ostra lub ciężka astma; paralityczne niedrożności jelit; w ciągu 14 dni stosowania inhibitorów MAO |
Zatwierdzony przez FDA; substancja kontrolowana według schematu II; nie zalecany do stosowania jako środek pierwszego lub drugiego rzutu |
|
Informacje dotyczą środków farmaceutycznych uzyskanych z odpowiednich ulotek dołączonych do opakowań (z podaniem nazw handlowych) |
|||||
Wytyczne Amerykańskiej Akademii Neurologii (AAN) zalecają następujące środki stosowane miejscowo: kapsaicynę i dinitrat izosorbidu w sprayu (umiarkowane dowody) oraz plaster Lidoderm (słabe dowody).69 Okskarbazepina, lamotrygina, lakozamid, klonidyna, pentoksyfilina i meksyletyna nie są zalecane w wytycznych AAN w leczeniu DPN.69
Dodatkowo opioidy były zalecane przez niektórych do stosowania w opornej na leczenie DPN. Opioidy zalecane w wytycznych AAN obejmują dekstrometorfan (400 mg/dobę), siarczan morfiny (miareczkowany do 120 mg/dobę) i oksykodon (średnio 37 mg/dobę, maksymalnie 120 mg/dobę); nie ma jednak wystarczających danych, aby sugerować stosowanie jednego środka zamiast drugiego.69 Autorzy niniejszej pracy zalecają stosowanie opioidów tylko w ciężkich opornych przypadkach ze ścisłym monitorowaniem pacjentów, którzy uzyskują prawdziwą poprawę funkcjonalną po zastosowaniu opioidów. Autorzy stosują się do stanowiska Centers for Disease Control and Prevention z 2016 r., zgodnie z którym opioidy mają ograniczone długoterminowe zastosowanie w bólu typu nienowotworowego.70
Jednym z wyzwań w leczeniu farmakologicznym DPN jest niewystarczająca liczba badań typu head-to-head uwzględniających wyniki dotyczące jakości życia.4 W niedawnym badaniu porównującym ośmiotygodniową terapię z zastosowaniem pregabaliny w dużej dawce, duloksetyny w dużej dawce lub w połączeniu nie stwierdzono istotnych różnic w średniej zmianie bólu między monoterapią a terapią łączoną.71 Potrzeba więcej badań porównujących dwie aktywne substancje, aby zapewnić wgląd w poprawę opieki nad osobami cierpiącymi na obwodową neuropatię cukrzycową.
Leczenie niefarmakologiczne. Procedury. Wytyczne ANN sugerują rozważenie przezskórnej elektrycznej stymulacji nerwów przez trzy do czterech tygodni w leczeniu DPN.69 Pilotażowe, dwustylowe, randomizowane, kontrolowane badanie z zastosowaniem akupunktury72 oraz badanie z pojedynczo ślepą próbą, kontrolowane placebo, randomizowane73 oceniające skuteczność akupunktury w DPN wykazały poprawę w zakresie miar wyników związanych z bólem. Potrzebne są jednak dalsze badania, aby potwierdzić rolę akupunktury w leczeniu DPN.
Kwas alfa-liponowy. Niektóre dowody sugerują, że stosowanie antyoksydacyjnego kwasu alfa-liponowego może pomóc w redukcji stresu oksydacyjnego wywołanego przez wolne rodniki i zapewnić następujące korzyści: ukierunkowanie na patogenezę, spowolnienie rozwoju i poprawę objawów DPN.74,75
Prewencja. Wykazano, że modyfikacje stylu życia, koncentrujące się na zdrowej diecie i aktywności fizycznej, stale zmniejszają częstość występowania cukrzycy i jej powikłań, w tym obwodowej neuropatii cukrzycowej.68 Wykazano, że intensywna kontrola glikemii pomaga zmniejszyć ryzyko neuropatii cukrzycowej u chorych na cukrzycę poprzez poprawę funkcji nerwów.61,76,77 W badaniu DCCT ustalono rolę kontroli glikemii w zapobieganiu i hamowaniu progresji neuropatii cukrzycowej u chorych na cukrzycę typu 1.10,56
Perełki kliniczne
- Do 50% pacjentów może mieć bezbolesną lub bezobjawową neuropatię obwodową.
- Pacjentom z neuropatią zaleca się edukację w zakresie pielęgnacji stóp (codzienna samokontrola stóp) oraz regularną opiekę podologiczną u wybranych pacjentów.
- Pacjentom z DPN, u których występują objawy utraty czucia ochronnego z lub bez deformacji, należy zalecić wizytę kontrolną u lekarza co trzy do sześciu miesięcy w celu podjęcia działań profilaktycznych.64
- Aby skutecznie zarządzać objawami DPN, niezbędne jest podejście multidyscyplinarne; to kompleksowe podejście może obejmować terapię farmakologiczną, psychologiczną i/lub fizyczną.
- Nowe stanowisko w sprawie neuropatii cukrzycowej opublikowane przez ADA zaleca badania przesiewowe w kierunku DPN u pacjentów z prediabetes wykazujących objawy neuropatii obwodowej.4
- Specjalistycznej opieki wymagają osoby z chorobą obwodową, neuropatią nieczułą lub stopą Charcota.
Gastropareza
Inną postacią neuropatii cukrzycowej jest gastropareza. Stan ten jest związany z objawami ze strony górnego odcinka przewodu pokarmowego, w tym nudnościami, wymiotami, wczesną sytością lub poposiłkową pełnością, bólem brzucha i wzdęciami, ale przy braku niedrożności ujścia. Chociaż istnieje wiele przyczyn gastroparezy, szacuje się, że cukrzyca odpowiada za około jedną trzecią wszystkich przypadków.78
Patofizjologia. Proponowane mechanizmy patofizjologiczne gastroparezy cukrzycowej obejmują upośledzoną kontrolę glikemii, neuropatię nerwów błędnych lub przedkręgowych zwojów współczulnych, nieprawidłowości komórek śródmiąższowych Cajala, utratę syntazy tlenku azotu oraz, prawdopodobnie, miopatię.79,80
Prezentacja kliniczna. We wczesnym okresie choroby pacjenci są zwykle bezobjawowi. Nie ma liniowej zależności między objawami a ciężkością neuropatii. Duża różnorodność objawów utrudnia diagnozowanie tego schorzenia. Inne prezentacje kliniczne obejmują anoreksję, niedożywienie, utratę masy ciała i hipoglikemię wynikającą z niedopasowania wchłaniania pokarmu i insuliny. Ból rzeczywiście może być niedostrzegany, ale znaczący dla wielu osób. W badaniu konsorcjum finansowanym przez NIH, 72% pacjentów z gastroparezą miało bóle brzucha.81 Był to dominujący objaw u 18% tych pacjentów. Ból był wywoływany przez jedzenie (72%), występował w nocy (74%) i zakłócał sen (66%) u tych pacjentów.81
Jak często występuje gastropareza cukrzycowa? Skumulowaną 10-letnią częstość występowania gastroparezy oszacowano na 5,2% w przypadku cukrzycy typu 1 i 1% w przypadku cukrzycy typu 2 wśród ogółu chorych na cukrzycę.82 W innych badaniach częstość ta wynosiła 5-12%.83,84 Jednak jest ona znacznie większa, gdy rozpoznanie opiera się na objawach, a nie na badaniu opróżniania żołądka.
Gastropareza występuje częściej u chorych na cukrzycę typu 1 niż na cukrzycę typu 2 i jest najczęściej obserwowana u osób, które chorują na cukrzycę od ponad 10 lat i u których rozwinęły się inne powikłania mikronaczyniowe: retinopatia, nefropatia i neuropatia obwodowa. Jeśli u chorego wystąpi gastropareza wcześniej niż można się spodziewać, należy zbadać inne przyczyny, najczęściej okołooperacyjne uszkodzenie nerwu błędnego lub farmakologiczne działanie leków inkretynowych – agonistów receptora glukagonopodobnego peptydu-1 (GLP-1RA) i inhibitorów dipeptydylo-peptydazy 4 (inhibitory DPP-4).
Po wystąpieniu u chorego objawów gastroparezy objawy te zwykle utrzymują się i są stabilne przez 12-25 lat. Dzieje się tak nawet w przypadku poprawy kontroli glikemii,85 z wyjątkiem przeszczepu trzustki i nerki.86 Chociaż nie ma jednoznacznych dowodów na to, że gastropareza sama w sobie zwiększa śmiertelność, to jednak istotnie obniża wszystkie aspekty jakości życia.87
Diagnostyka. W rozpoznaniu może pomóc szereg badań. Złotym standardem w tej diagnostyce jest scyntygrafia żołądkowo-przełykowa. Jest ona nieinwazyjna, bada fizjologię i dostarcza wyników ilościowych. Gastroparezę można rozpoznać w przypadku zatrzymania co najmniej 35% standardowego niskotłuszczowego posiłku cztery godziny po spożyciu.80
Aby zapewnić jak najdokładniejsze wyniki badania, protokół badania wstępnego powinien obejmować odstawienie wszystkich leków zmieniających motorykę na co najmniej dwa do trzech dni przed badaniem, w tym prokinetyków, opiatów i leków antycholinergicznych. Należy również odstawić leki inkretynowe, takie jak agoniści GLP-1 i inhibitory DPP-4, ponieważ wiadomo, że opóźniają one opróżnianie żołądka. Wykazano, że hiperglikemia również opóźnia opróżnianie żołądka, a stężenie glukozy powinno wynosić poniżej 275 mg/dl przed rozpoczęciem badania.79,88
Pacjenci powinni powstrzymać się od palenia tytoniu i spożywania alkoholu w dniu badania, ponieważ oba te czynniki mogą spowalniać opróżnianie żołądkowo-przełykowe.89 Ponadto GLP-1RAs mogą nasilać gastroparezę, ponieważ spowalniają opróżnianie żołądka. Co więcej, u niektórych osób może występować subkliniczna gastropareza, która ujawnia się po rozpoczęciu stosowania GLP-1RA.
Leczenie. Leczenie gastroparezy zależy w dużej mierze od nasilenia objawów. Ogólne zasady leczenia obejmują leczenie wspomagające (płyny, elektrolity, kontrola glukozy i odżywianie), leczenie medyczne (prokinetyki, leki przeciwwymiotne i łagodzenie bólu) oraz leczenie inwazyjne (chirurgia, wstrzyknięcia botoksu, stymulacja żołądka lub stymulacja elektryczna).79
Leczenie wspomagające zwykle rozpoczyna się w szpitalu i koncentruje się na normalizacji płynów, elektrolitów i zaburzeń odżywiania. Przy zapewnianiu wsparcia żywieniowego preferuje się żywienie dojelitowe zamiast pozajelitowego, ponieważ jest ono bardziej fizjologiczne i może pomóc w utrzymaniu flory jelitowej. Ponadto, zmiany w diecie mogą być bardzo pomocne w gastroparezie. Diety niskobłonnikowe, niskotłuszczowe i niskoresztkowe są zalecane dla pacjentów z gastroparezą.85 Diety wysokobłonnikowe mogą nasilać objawy, ponieważ wymagają więcej trawienia.
Leki. Leki prokinetyczne: W Stanach Zjednoczonych metoklopramid i erytromycyna są najczęściej stosowanymi lekami w leczeniu gastroparezy. Jednakże metoklopramid posiada ostrzeżenie „black box” ze względu na ryzyko wystąpienia dyskinez tardywnych. Rozwój tego stanu jest bezpośrednio związany z czasem stosowania metoklopramidu i liczbą przyjmowanych dawek. Podczas stosowania tego leku najlepiej jest stosować go tylko u pacjentów z objawami i rozpoczynać od najmniejszej skutecznej dawki 15 minut przed posiłkiem. Wakacje lekowe czasami mogą pomóc w przedłużeniu czasu trwania efektów.90
Domperidon jest bardziej selektywnym agonistą dopaminy, który jest równie skuteczny jak metoklopramid, ale ma mniej działań niepożądanych ze strony ośrodkowego układu nerwowego.91
Środki przeciwwymiotne: Leki przeciwwymiotne mogą być stosowane w celu złagodzenia objawów. Jednak ryzyko interakcji lekowych jest znaczne i należy je uważnie monitorować.91
Zarządzanie bólem może być wyzwaniem u pacjentów z gastroparezą. Trójcykliczne leki przeciwdepresyjne są często stosowane jako terapia pierwszego rzutu w leczeniu bólu w gastroparezie. Leki drugiego rzutu to słaby agonista receptorów mu-opioidowych, tramadol, który również uwalnia serotoninę i hamuje wychwyt zwrotny noradrenaliny, oraz analog kwasu gamma-aminomasłowego, gabapentyna. Nie zaleca się jednak stosowania leków narkotycznych w gastroparezie, ponieważ mogą one przyczynić się do zaparć i pogorszenia objawów.
Leczenie inwazyjne: Zastrzyki z botoksu są powszechnie stosowane w leczeniu gastroparezy, ale ich stosowanie nie jest poparte badaniami klinicznymi.92,93
Urządzenie do elektrycznej stymulacji żołądka zostało zatwierdzone przez FDA na mocy zwolnienia z obowiązku stosowania urządzeń humanitarnych w 2000 r.94 Urządzenie do elektrycznej stymulacji żołądka dostarcza do żołądka stymulację elektryczną o wysokiej częstotliwości i niskiej energii. Jest ono bardziej pomocne w gastroparezie cukrzycowej niż w gastroparezie idiopatycznej. Metaanaliza wykazała znaczne korzyści w zakresie objawów u pacjentów. Dokładny mechanizm korzyści nadal nie jest znany.95 Zaproponowano, że elektryczna stymulacja żołądka powoduje zmiany w centralnych mechanizmach kontrolujących nudności i wymioty, zwiększa czynność błędnika i powoduje zmniejszenie wrażliwości na rozciąganie.97 Pacjenci, którzy dobrze reagują na leczenie, zazwyczaj szybko reagują. Z tego powodu niektórzy zalecają najpierw przeprowadzenie próby z tymczasowym umieszczeniem elektrody przed długotrwałym wdrożeniem.
Perełki kliniczne
- Diabetyczna gastropareza jest częstsza u osób z długotrwałą cukrzycą i u osób z innymi powikłaniami mikronaczyniowymi.
- Złotym standardem diagnostycznym w przypadku gastroparezy jest scyntygrafia przełyku.
- Dieta niskobłonnikowa, niskotłuszczowa, niskoresztkowa jest zalecana w gastroparezie cukrzycowej.
- Leczenie farmakologiczne i interwencyjne przynosi ograniczone korzyści i wiąże się ze znacznym długoterminowym ryzykiem.
Cheiroartropatia cukrzycowa
Jednym z mniej znanych powikłań cukrzycy jest cheiroartropatia. Stan ten charakteryzuje się ograniczoną ruchomością stawów spowodowaną pogrubieniem skóry u osób z wieloletnią cukrzycą. Prawdopodobnie było to pierwsze powikłanie zidentyfikowane na podstawie cukrzycy typu 1. Częstość występowania waha się od 8-50%.98
Uważa się, że cheiroartropatia jest spowodowana glikozylacją i sieciowaniem kolagenu. Może wpływać na skórę i ścięgna, a jej skutkiem może być ograniczona ruchomość stawów, najczęściej wydłużenie palców, sztywność i ból. Klasycznym objawem badania fizykalnego dla cheiropatii cukrzycowej jest „objaw modlitwy”. W tym stanie osoba nie jest w stanie w pełni spłaszczyć dłoni do „modlitwy”, pozostawiając przerwę między palcami lewej i prawej ręki. Istnieją dowody na to, że u osób, u których rozwinęła się cheiropatia, trzykrotnie wzrasta ryzyko powikłań mikronaczyniowych.99
Cheiropatia cukrzycowa jest zwykle gorsza u osób z długotrwałą lub źle kontrolowaną glikemią. Na szczęście wiele osób doświadcza złagodzenia objawów i poprawy sprawności ruchowej, gdy poprawia się kontrola glikemii.100
Wnioski
Zarządzanie powikłaniami cukrzycy wymaga pracy wielodyscyplinarnego zespołu. Wczesne badania przesiewowe w kierunku retinopatii, nefropatii i neuropatii są niezbędne ze względu na bezobjawowy charakter choroby. Cechą charakterystyczną postępowania w przypadku wszystkich powikłań cukrzycy pozostaje kontrola glikemii i ciśnienia tętniczego.
- American Diabetes Association. Cost of Diabetes. Dostępne na: http://www.diabetes.org/advocacy/news-events/cost-of-diabetes.html?referrer=https://www.google.com/. Zaktualizowano 22 czerwca 2015. Dostęp 8 lutego, 2017.
- UK Prospective Diabetes Study Group. Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes. Lancet 1998;352:837-853.
- Gregg EW, Yanfed L, Wang J. Changes in diabetes-related complications in the United States, 1990-2010. N Engl J Med 2014;370:1514-1523.
- Pop-Busui R, Boulton A, Feldman E, et al. Diabetes neuropathy: Oświadczenie o stanowisku Amerykańskiego Stowarzyszenia Diabetyków. Diabetes Care 2017;40:136-154.
- Leasher JL, Bourne RR, Flaxman SR, et al. Global estimates on the number of people blind or visually impaired by diabetic retinopathy: A meta-analysis from 1990 to 2010. Diabetes Care 2016;39:1643-1649.
- Narodowy Instytut Oka. Fakty na temat cukrzycowej choroby oczu. Dostępne na: https://nei.nih.gov/health/diabetic/retinopathy. Updated Sept. 2015. Accessed Feb. 8, 2017.
- Fong, DS, Aiello L, Gardner TW, et al. Retinopatia w cukrzycy. Diabetes Care 2004;27(Suppl 1):S84-S87.
- American Diabetes Association. Standardy opieki medycznej w cukrzycy-2017. Diabetes Care 2017;40:(Suppl 1):S4-S5.
- Doggen K, Nobels F, Scheen AJ, et al. Cardiovascular risk factors and complications associated with albuminuria and impaired renal function in insulin-treated diabetes. J Diabetes Complications 2013;27:370-375.
- The Diabetes Control and Complications Trial Research Group. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. N Engl J Med 1993;329:977-986.
- Action to Control Cardiovascular Risk in Diabetes Follow-On (ACCORDION) Eye Study Group and the Action to Control Cardiovascular Risk in Diabetes Follow-On (ACCORDION) Study Group. Persistent effects of intensive glycemic control on retinopathy in type 2 diabetes in the Action to Control Cardiovascular Risk in Diabetes (ACCORD) follow-on study. Diabetes Care 2016;39:1089-1100.
- ACCORD Study Group, ACCORD Eye Study Group, Chew EY, et al. Effects of medical therapies on retinopathy progression in type 2 diabetes. N Engl J Med 2010;363:233-244.
- Chew EY, Davis MD, Danis RP, et al. The effects of medical management on the progression of diabetic retinopathy in persons with type 2 diabetes: The Action to Control Cardiovascular Risk in Diabetes (ACCORD) Eye Study. Ophthalmology 2014;121:2443-2451.
- Diabetes Control and Complications Trial Research Group. Effect of pregnancy on microvascular complications in the Diabetes Control and Complications Trial (Wpływ ciąży na powikłania mikronaczyniowe w badaniu Diabetes Control and Complications Trial). Diabetes Care 2000;23:1084-1091.
- Colberg SR, Sigal RJ, Yardley JE, et al. Physical activity/exercise and diabetes: A position statement of the American Diabetes Association. Diabetes Care 2016;39:2065-2079.
- The Diabetic Retinopathy Study Research Group. Preliminary report on effects of photocoagulation therapy. Am J Ophthalmol 1976;81:383-396.
- Early Treatment Diabetic Retinopathy Study Research Group. Photocoagulation for diabetic macular edema: Early Treatment Diabetic Retinopathy Study report number 1. Arch Ophthalmol 1985;103:1796-1806.
- Nguyen QD, Brown DM, Marcus DM, et al. Ranibizumab for diabetic macular edema: Results from 2 phase III randomized trials: RISE i RIDE. Ophthalmology 2012;119:789-801.
- Wong TY, Cheung CMG, Larsen M, et al. Diabetic retinopathy. Nat Rev Disease Prim doi:10.1038/nrdp.2016.12; published online March 17, 2016.
- Batuman V, Soman AS, Schmidt RJ, Soman SS. Nefropatia cukrzycowa. Medscape Dostępne na: http://emedicine.medscape.com/article/238946-overview. Updated Sept. 30, 2016. Accessed Feb. 12, 2017.
- Tuttle KR, Bakris GL, Bilous RW, et al. Diabetic kidney disease: A report from an ADA Consensus Conference. Diabetes Care 2014;37:2864-2883. https://doi.org/10.2337/dc14-1296
- Patel A, MacMahon S, Chalmers J, et al. Intensywna kontrola stężenia glukozy we krwi a wyniki naczyniowe u pacjentów z cukrzycą typu 2. N Engl J Med 2008;358:2560-2572.
- Duckworth W, Abraira C, Moritz T, et al. Glucose control and vascular complications in veterans with type 2 diabetes. N Engl J Med 2009;360:129-139.
- Ismail-Beigi F, Craven T, Banerji MA, et al. Effect of intensive treatment of hyperglycaemia on microvascular outcomes in type 2 diabetes: An analysis of the ACCORD randomised trial. Lancet 2010;376:419-430.
- National Kidney Foundation. Wytyczne praktyki klinicznej KDOQI dotyczące cukrzycy i CKD: aktualizacja 2012. Am J Kidney Dis 2012;60:850-886.
- Fox CS, Matsushita K, Woodward M, et al. Chronic Kidney Disease Prognosis Consortium. Associations of kidney disease measures with mortality and end-stage renal disease in individuals with and without diabetes: A meta-analysis. Lancet 2012;380:1662-1673.
- Hahr AJ, Molitch ME. Postępowanie w cukrzycy u pacjentów z przewlekłą chorobą nerek. Clin Diabetes Endocrinol 2015. doi: 10.1186/s40842-015-0001-9.
- Alsaad KO, Herzenberg AM. Distinguishing diabetic nephropathy from other casues of glomerulosclerosis: An update. J Clin Pathol 2007;60:18-26.
- Narva AS, Bilous RW. Laboratoryjna ocena cukrzycowej choroby nerek. Diabetes Spectr 2015;28:162-166.
- Levey AS, Stevens LA, Schmid CH, et al. A new equation to estimate glomerular filtration rate. Ann Intern Med 2009;150:604-612.
- National Kidney Foundation. KDOQI clinical practice guidelines for chronic kidney disease: Evaluation, classification, and stratification. Am J Kidney Dis 2002;39(2 Suppl 1):S1-S266.
- de Boer IH, Rue TC, Cleary PA, et al. Long-term renal outcomes of patients with type 1 diabetes mellitus and microalbuminuria: An analysis of the Diabetes Control and Complications Trial/Epidemiology of Diabetes Interventions and Complications cohort. Arch Intern Med 2011;171:412-420.
- Wanner C, Inzucchi SE, Lachin JM, et al. Empagliflozin and progression of kidney disease in type 2 diabetes. N Engl J Med 2016;375:323-334.
- Heerspink HJL, Desai M, Jardine M, et al. Canagliflozin slows progression of renal function decline independently of glycemic effects. J Am Soc Nephrol 2016;28:1-8.
- Lexi-Drugs. Lexicomp. Wolters Kluwer Health, Inc. Riverwoods, IL. Dostępne na: http://online.lexi.com. Dostęp 31 października 2016 r.
- Micromedex Solutions. Truven Health Analytics, Inc. Ann Arbor, MI. Dostępne na: http://www.micromedexsolutions.com. Accessed Oct. 31, 2016.
- James PA, Oparil S, Carter BL, et al. 2014 evidence-based guideline for the management of high blood pressure in adults. JAMA 2014;311:507-520.
- King P, Peacock I, Donnelly R. The United Kingdom Prospective Diabetes Study (UKPDS): Implikacje kliniczne i terapeutyczne dla cukrzycy typu 2. Br J Clin Pharmacol 1999;48:643-648.
- Jackevicius CA, Wong J, Aroustamian I, et al. Rates and predictors of ACE inhibitor discontinuation subsequent to elevated serum creatinine: A retrospective cohort study. BMJ Open 2014;4:e005181.
- Mauer M, Zinman B, Gardiner R, et al. Renal and retinal effects of enalapril and losartan in type 1 diabetes. N Engl J Med 2009;361:40-51.
- Bilous R, Chaturvedi N, Sjølie AK, et al. Effect of candesartan on microalbuminuria and albumin excretion rate in diabetes: Three randomized trials. Ann Intern Med 2009;151:11-20.
- Haller H, Ito S, Izzo JL Jr, et al. Olmesartan for the delay or prevention of microalbuminuria in type 2 diabetes. N Engl J Med 2011;364:907-917.
- Makani H, Bangalore S, Desouza KA, et al. Efficacy and safety of dual blockade of the renin-angiotensin system: Meta-analiza badań z randomizacją. BMJ 2013;346:f360.
- Miao Y, Ottenbros SA, Laverman GD, et al. Effect of a reduction of uric acid on renal outcomes during losartan treatment: A post-hoc analysis of the reduction of endpoints in non-insulin-dependent diabetes mellitus with the Angiotensin II Antagonist Losartan Trial. Hypertension 2011;58:2-7.
- Lewis EJ, Hunsicker LG, Clarke WR, et al. Renoprotekcyjne działanie antagonisty receptora angiotensyny irbesartanu u pacjentów z nefropatią spowodowaną cukrzycą typu 2. N Eng J Med 2001;354:851-860.
- Adler A, Casula A, Steenkamp R, et al. Association between glycemia and mortality in diabetic individuals on renal replacement therapy in the U.K. Diabetes Care 2014;37:1304-1311.
- Sharma SG, Bomback AS, Radhakrishnan J, et al. The modern spectrum of renal biopsy findings in patients with diabetes. Clin J Am Soc Nephrol 2013;8:1718-1724.
- Smart NA, Dieberg G, Ladhani M, Titus T. Early referral to specialist nephrology services for preventing the progression to end-stage kidney disease. Cochrane Database Syst Rev 2014;6:CD007333.
- Boulton AJM, Gries FA, Jervell JA. Guidelines for the diagnosis and outpatient management diabetic peripheral neuropathy. Diabet Med 1998;15:508-514.
- O’Brien PD, Hinder LM, Sakowski SA, Feldman EL. ER stres w cukrzycowej neuropatii obwodowej: Nowy cel terapeutyczny. Antioxid Redox Signal 2014;21:621-633.
- Cameron NE, Cotter MA. Mechanizmy prozapalne w neuropatii cukrzycowej: Focus on the nuclear factor kappa B pathway. Curr Drug Targets 2008;9:60-67.
- Tesfaye S, Chaturvedi N, Eaton SE, et al. Vascular risk factors and diabetic neuropathy. N Engl J Med 2005;352:341-350.
- Wiggin TD, Sullivan KA, Pop-Busui R, et al. Elevated triglycerides correlated with progression of diabetic neuropathy. Diabetes 2009;58:1634-1640.
- Stella P, Ellis D, Maser RE, Orchard TJ. Cardiovascular autonomic neuropathy (expiration and inspiration ratio) in type 1 diabetes. Incidence and predictors. J Diabetes Complications 2000;14:1-6.
- Witten DR, Tesfaye S, Chaturvedi N, et al. Risk factors for cardiac autonomic neuropathy in type 1 diabetes mellitus. Diabetologia 2005;48:164-171.
- Diabetes Control and Complication Trial (DCCT) Research Group. Effect of intensive diabetes treatment on nerve conduction in the Diabetes Control and Complications Trial. Ann Neurol 1995;38:869-880.
- Diabetes Control and Complication Trial (DCCT) Research Group. The effect of intensive diabetes therapy on measures of autonomic nervous system function in the Diabetes Control and Complications Trial (DCCT). Diabetologia 1998;41:416-423.
- Edwards JL, Vincent AM, Cheng HT, Feldman EL. Neuropatia cukrzycowa: Mechanisms to management. Pharmacol Ther 2008;120:1-34.
- Vincent AM, Callaghan BC, Smith AL, Feldman EL. Diabetic neuropathy: Cellular mechanisms a therapeutic target. Nat Rev Neurol 2011;7:573-583.
- Kellogg AP, Wiggin T, Larkin D, et al. Protective effects of cyclooxygenase-2 gene inactivation against peripheral nerve dysfunction and intraepidermal nerve fibers loss in experimental diabetes. Diabetes 2007;56:2997-3005.
- Callaghan BC, Cheng HT, Stables CL, et al. Diabetic neuropathy: Clinical manifestations and current treatments. Lancet Neurol 2012;11:521-534.
- Boulton AJM, Kirsner RS, Vileikyte L. Clinical practice: Neuropatyczne owrzodzenia stopy cukrzycowej. N Eng J Med 2004;351:48-55.
- Boulton AJM, Vinik AI, Arezzo JC, et al. Diabetic neuropathies: A statement by the American Diabetes Association. Diabetes Care 2005;28:956-962.
- Boulton AJM, Armstrong DG, Albert SF, et al. Comprehensive foot examination and risk assessment: A report of the task force of the foot care interest group of the American Diabetes Association, with endorsement by the American Association of Clinical Endocrinologists. Diabetes Care 2008;31:1679-1685.
- Tesfaye S, Boulton AJ, Dyck PJ, et al. Diabetic neuropathies: Update on definitions, diagnostic criteria, estimation of severity, and treatments. Diabetes Care 2010;33:2285-2293.
- Dyke PJ, Albers JW, Andersen H, et al. Diabetic polyneuropathies: Update on research definition, diagnostic criteria and estimation of severity. Diabetes Metab Res Rev 2011;27:620-628.
- Freeman R. Not all neuropathy is diabetes is of diabetic etiology: Diagnostyka różnicowa neuropatii cukrzycowej. Curr Diabe Rep 2009;9:423-431.
- Balducci S, Iacobellis G, Parisi L, et al. Exercise training can modify the natural history of diabetic peripheral neuropathy. J Diabetes Complications 2006;20:216-223.
- Bril V, England J, Franklin GM, et al. Evidence-based guideline: Leczenie bolesnej neuropatii cukrzycowej. Raport American Academy of Neurology, American Association of Neuromuscular and Electrodiagnostic Medicine oraz American Academy of Physical Medicine and Rehabilitation. Neurology 2011;76:1758-1765.
- Dowell D, Haegerich TM, Chou R. CDC Guideline for prescribing opioids for chronic pain – United States 2016. MMWR Recomm Rep 2016;65:1-49.
- Tesfaye S, Wilhelm S, Lledo A, et al. Duloksetyna i pregabalina: monoterapia wysokimi dawkami czy ich połączenie? The „COMBO-DN study” – a multinational, randomized, double-blind, parallel-group study in patients with diabetic peripheral neuropathic pain. Pain 2013;154:2616-2625.
- Ahn AC, Bennani T, Freeman R, et al. Two styles of acupuncture for treating painful diabetic neuropathy – a pilot randomized control trial. Acupunct Med 2007;25:11-17.
- Garrow A, Xing M, Vere J, et al. Role of acupuncture in the management of diabetic painful neuropathy (DPN): A pilot RCT. Acupunct Med 2014;32:242-249.
- Ziegler D, Nowak H, Kempler P, et al. Treatment of symptomatic diabetic polyneuropathy with the antioxidant alpha-lipoic acid: A meta-analysis. Diabet Med 2004;21:114-121.
- Ziegler D, Low PA, Litchy WJ, et al. Efficacy and safety of antioxidant treatment with alpha-lipoic acid over 4 years in diabetic polyneuropathy: The NATHAN 1 trial. Diabetes Care 2011;34:2054-2060.
- Kuwabara S, Ogawara K, Harrori T, et al. The acute effects of glycemic control on axonal excitability in human diabetic nerves. Intern Med 2002;41:360-365.
- Peltier A, Goutman SA, Callaghan BC. Bolesna neuropatia cukrzycowa. BMJ 2014;348:g1799.
- Soykan I, Sivri B, Sarosiek I, et al. Demography, clinical characteristics, psychological and abuse profiles, treatment, and long-term follow-up of patients with gastroparesis. Dig Dis Sci 1998;43:2398-2404.
- Camilleri M, Bharucha AE, Farrugia G. Epidemiology, mechanisms, and management of diabetic gastroparesis. Clin Gastroenterol Hepatol 2011;9:5-12.
- Shin AS, Camilleri M. Diagnostic assessment of diabetic gastroparesis. Diabetes 2013;62:2667-2673.
- Hasler WL, Wilson L, Parkman HP, Lee L. Importance of abdominal pain as a symptom in gastroparesis: Relation to clinical factors, disease severity, quality of life, gastric retention, and medication use. Gastroenterology 2010;138. doi: 10.1016/S0016-5085(10)62131-2.
- Choung RS, Locke GR 3rd, Schleck CD, et al. Risk of gastroparesis in subjects with type 1 and 2 diabetes in the general population. Am J Gastroenterol 2012;107:82-88.
- Maleki D, Locke GR III, Camilleri M, et al. Gastrointestinal tract symptoms among persons with diabetes mellitus in the community. Arch Intern Med 2000;160:2808-2816.
- Bytzer P, Talley NJ, Leemon M, et al. Prevalence of gastrointestinal symptoms associated with diabetes mellitus: A population-based survey of 15,000 adults. Arch Intern Med 2001;161:1989-1996.
- Jones KL, Russo A, Berry MK, et al. A longitudinal study of gastric emptying and upper gastrointestinal symptoms in patients with diabetes mellitus. Am J Med 2002;113:449-455.
- Gaber AO, Hathaway DK, Abell T, et al. Improved autonomic and gastric function in pancreas-kidney vs kidney-alone transplantation contributes to quality of life. Transplant Proc 1994;26:515-516.
- Punkkinen J, Färkkilä M, Mätzke S, et al. Upper abdominal symptoms in patients with Type 1 diabetes: Bez związku z upośledzeniem opróżniania żołądka spowodowanym przez neuropatię autonomiczną. Diabet Med 2008;25:570-577.
- Schvarcz E, Palmer M, Aman J, et al. Physiological hyperglycemia slows gastric emptying in normal subjects and patients with insulin-dependent diabetes mellitus. Gastroenterology 1997;113:60-66.
- Miller G, Palmer KR, Smith B, et al. Smoking delays gastric emptying of solids. Gut 1989;30:50-53.
- Rao AS, Camilleri M. Review article: Metoklopramid i dyskineza tardywna. Aliment Pharmacol Ther 2010;31:11-19.
- Patterson D, Abell T, Rothstein R, et al. A double-blind multicenter comparison of domperidone and metoclopramide in the treatment of diabetic patients with symptoms of gastroparesis. Am J Gastroenterol 1999;94:1230-1234.
- Arts J, Holvoet L, Caenepeel P, et al. Badanie kliniczne: A randomized-controlled crossover study of intrapyloric injection of botulinum toxin in gastroparesis. Aliment Pharmacol Ther 2007;26:1251-1258.
- Friedenberg FK, Palit A, Parkman HP, et al. Botulinum toxin A for the treatment of delayed gastric emptying. Am J Gastroenterol 2008;103:416-423.
- Humanitarian Device Exemption for Enterra Device. Fed Reg 2000;65:78495-78496.
- O’Grady G, Egbuji JU, Du P, et al. High-frequency gastric electrical stimulation for the treatment of gastroparesis: A meta-analysis. World J Surg 2009;33:1693-1701.
- Reddymasu SC, Sarosiek I, McCallum RW. Ciężka gastropareza: Terapia medyczna czy elektryczna stymulacja żołądka. Clin Gastroenterol Hepatol 2010;8:117-124.
- McCallum RW, Dusing RW, Sarosiek I, et al. Mechanisms of symptomatic improvement after gastric electrical stimulation in gastroparetic patients. Neurogastroenterol Motil 2010;22:161-167.
- Douloumpakas I, Pyrpasopoulou A, Triantafyllou A, et al. Prevalence of musculoskeletal disorders in patients with type 2 diabetes mellitus: Badanie pilotażowe. Hippokratia 2007;11:216-218.
- Rosenbloom AL, Silverstein JH, Lezotte DC. Limited joint mobility in childhood diabetes mellitus indicates increased risk for microvascular disease. N Engl J Med 1981;305;191-194.
- Lister DM, Graham-Brown RAC, Burden AC. Resolution of diabetic cheiroarthropathy. Br Med J 1986;293:1537.
.