Możliwość całkowitego opróżnienia jamy klatki piersiowej, rozbicia skupisk płynu opłucnowego, pełnego uwidocznienia wszystkich aspektów przestrzeni opłucnowej i uniknięcia chorobowości związanej z torakotomią sprawiła, że torakoskopia stała się atrakcyjna w leczeniu odmy i odmy opłucnowej.
Wybór pacjenta
Możliwość całkowitego opróżnienia jamy klatki piersiowej, rozbicia złogów płynu opłucnowego, pełnego uwidocznienia wszystkich aspektów przestrzeni opłucnowej i uniknięcia chorobowości związanej z torakotomią sprawiły, że torakoskopia stała się atrakcyjna w leczeniu odmy i odmy opłucnowej.
Tabela 1: Laboratoryjne kryteria drenażu obrzęku
Wysięk zajmujący ponad 50% powierzchni półotrzewnej lub taki, który jest zlokalizowany;
Dodatni wynik barwienia metodą Grama lub hodowli płynu opłucnowego;
Ropny płyn opłucnowy, który ma pH poniżej 7.20 lub glukozę poniżej 60,
Poziom dehydrogenazy kwasu mlekowego ponad trzykrotnie wyższy od górnej granicy normy dla surowicy.
Pacjenci, u których w wyniku torakentezy stwierdzono zakażoną odmę opłucnową i którzy spełniają laboratoryjne kryteria interwencji, są kandydatami do torakoskopowej dekortykacji.
Gdy odma jest w stadium wysiękowym lub fibrynopurulentnym i jest obecna przez około 3 tygodnie lub krócej, interwencja torakoskopowa jest zazwyczaj skuteczna (Wideo 1, Wideo 2 poniżej). Jeśli odma jest obecna dłużej niż 3 tygodnie (faza organizacyjna), możliwość wykonania odpowiedniej dekortykacji może być trudniejsza ze względu na gęstsze zrosty i obecność przylegającej skórki trzewi płucnych. Pacjenci z wysiękowym lub fibrynopurulentnym obrzękiem prawie zawsze mogą być operowani za pomocą torakoskopii; tomografia komputerowa nie jest pomocna w przewidywaniu, którzy pacjenci będą wymagali torakotomii. Konwersja do otwartej torakotomii jest wykonywana w razie potrzeby i nie powinna być traktowana jako porażka torakoskopii, ale raczej jako ćwiczenie dojrzałego osądu chirurgicznego. Torakoskopia jest również wskazana, gdy charakter procesu opłucnowego jest nierozpoznany, ponieważ pozwala na wykonanie ukierunkowanej biopsji opłucnej, która prawdopodobnie pozwoli na postawienie diagnozy, przy jednoczesnym uniknięciu chorobowości związanej z torakotomią. Inne wskazania do dekortykacji torakoskopowej obejmują odmę opłucnową i usunięcie śródpiersia u pacjentów z zstępującym zapaleniem śródpiersia. Wcześniejsza torakotomia, wcześniejsza pleurodeza talkowa i wcześniejsza odma są względnymi przeciwwskazaniami do torakoskopii. Niezdolność do tolerowania wentylacji jednego płuca i obecność zwłóknienia klatki piersiowej są przeciwwskazaniami do wykonania torakoskopowej dekortykacji. Pacjenci, u których rozwinęła się odma w następstwie perforacji przełyku, nie powinni być leczeni torakoskopowo, lecz przez torakotomię.
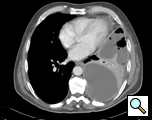
Ryc. 1: Tomografia komputerowa wykazująca obecność odmy
TK klatki piersiowej dostarcza informacji na temat lokalizacji, stopnia umiejscowienia, rozległości odmy i leżącego u jej podłoża miąższu płuca (rys. 1). Nierzadko nie udaje się zidentyfikować drobnoustroju w posiewie płynu opłucnowego, dlatego w momencie rozpoznania odmy należy rozpocząć antybiotykoterapię o szerokim spektrum działania. Można to zmodyfikować, jeśli w wyniku posiewu zostanie zidentyfikowany jakiś organizm. Antybiotyki są kontynuowane przez cały okres okołooperacyjny.
Należy ocenić stan odżywienia pacjenta i w razie potrzeby rozpocząć żywienie uzupełniające. Bronchoskopia powinna być wykonana przed dekortykacją, aby wykluczyć niedrożność wewnątrzoskrzelową w części płuca uwięzionej przez odmę.
Kroki operacyjne
Znieczulenie ogólne jest wprowadzane, a izolacja płuc jest wykonywana przy użyciu rurki intubacyjnej o podwójnym świetle lub rurki o pojedynczym świetle z blokerem oskrzeli. Pozwala to na rozszerzanie i zapadanie się płuc w zależności od potrzeb podczas dekortykacji. Monitorowanie śródoperacyjne obejmuje linię ciśnienia tętniczego, dostęp dożylny z dużym otworem, cewnik Foleya i pulsoksymetrię. Pacjent jest układany w pozycji jak do torakotomii tylno-bocznej.

Ryc. 3. Pooperacyjne zdjęcie radiologiczne klatki piersiowej po dekortykacji VATS, z założonymi drenażami lewej jamy opłucnej.

Ryc. 2b: Zastosowanie retraktora do utrzymania otwartego portu roboczego.
Port kamery umieszcza się w 7. lub 6. przestrzeni międzyżebrowej w linii przedniego górnego odcinka kręgosłupa biodrowego lub tuż przed nim. Dekortykacja VATS i/lub ewakuacja hemothorax może być wykonana przez 2 lub 3 porty. Port roboczy powinien być umieszczony nad 5. przestrzenią międzyżebrową, pomiędzy linią pachową środkową a przednią. (Rycina 2a) Nacięcie międzyżebrowe powinno umożliwiać włożenie 3 palców. Do odciągnięcia tkanek miękkich używany jest Weitlaner (Rycina 2b). Trzeci port może być umieszczony z tyłu, tak aby umożliwić dostęp do przedniej części jamy opłucnej.
Po wprowadzeniu do klatki piersiowej, ssak Yankauera jest używany do opróżnienia klatki piersiowej z wysięku lub krwi (Wideo 3, Wideo 4 poniżej) i wraz z palcem używany do rozbijania prostych blokad (Wideo 5 poniżej). Przedoperacyjna tomografia komputerowa pomaga w prowadzeniu tego „ślepego” wstępnego drenażu i tworzy roboczą przestrzeń opłucnową dla instrumentów torakoskopowych. Złogi żelatyny, fibryny i skrzepy krwi są usuwane za pomocą zakrzywionych kleszczyków pierścieniowych (Nagranie 6, Nagranie 7 poniżej). Po wytworzeniu przestrzeni opłucnowej usuwa się materiał włóknisty z bocznej części jamy opłucnowej, zaczynając od szczytu płuca i kierując się w stronę przepony lub odwrotnie. Za pomocą przyssawki i zacisku pierścieniowego usuwa się materiał włóknisty z jamy opłucnej, a za pomocą kirety, orzeszka ziemnego i zacisku pierścieniowego rozcina się skórę płuca. W dolnej części jamy opłucnej warto zidentyfikować i oddzielić dolny płat płuca od przepony (Video 9 poniżej). Płaszczyzna ta jest rozwinięta w kierunku tylnym i przednim, co pozwala na wypełnienie przez płuco bruzdy kostno-przeponowej po zakończeniu dekortykacji. Następnie usuwa się tylną część przestrzeni opłucnowej i odbarcza się leżące pod nią płuco. Odsłonięcie jest ułatwione przez przetoczenie pacjenta do przodu. Wreszcie, przednia część jamy opłucnej jest oczyszczana, a płuco uwalniane z miejsca, w którym przylega do śródpiersia. Odsłonięcie to jest ułatwione przez przetoczenie pacjenta do tyłu. Po lewej stronie należy zwrócić uwagę na ochronę nerwu przeponowego.
Przerwana wentylacja płuca jest wykorzystywana do oceny kompletności dekortykacji w miarę postępu dysekcji. Jeśli nie ma odpowiedniego postępu lub płuco nie jest wystarczająco rozprężone, aby wypełnić klatkę piersiową, należy wykonać konwersję do otwartej dekortykacji. Szczególną uwagę należy zwrócić na hemostazę (Wideo 10, Wideo 11 poniżej) zarówno na opłucnej ciemieniowej, jak i trzewnej.
Po wykonaniu odpowiedniego odbarczenia wykonuje się irygację i wizualizuje się rozprężenie płuca, aby upewnić się, że jama opłucnej jest wypełniona przez płuco (Wideo 12 poniżej). Rurki w klatce piersiowej mogą być umieszczone przednio i tylnio w celu odprowadzenia powietrza i płynu. Jeśli istnieje niewielka przestrzeń nad przeponą, umieszcza się w tym miejscu rurkę pod kątem prostym, aby zapewnić drenaż i umożliwić stopniowe rozprężanie płuc.
Rurki klatki piersiowej są utrzymywane na ssaniu, aby upewnić się, że nastąpiło całkowite rozprężenie płuc i odpowiedni drenaż przestrzeni opłucnej (Rycina 3). Gdy drenaż jest mniejszy niż 200 cm3/24 godziny, rurki można usunąć. U pacjentów z odmą opłucnową kontynuuje się antybiotykoterapię dożylną w trakcie przebiegu pooperacyjnego oraz przez kolejne 14 dni antybiotyki doustne po wypisaniu pacjenta. U chorych z odmą opłucnową antybiotyki kontynuuje się pooperacyjnie przez 48 godzin.
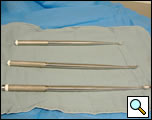
Ryc. 5. Długie kirety do stosowania w dekortykacji VATS.

Ryc. 4b: Kleszcze pierścieniowe zakrzywione otwarte.
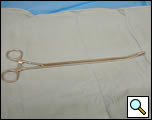
Ryc. 4a. Kleszcze pierścieniowe zakrzywione zamknięte (lewy panel) i otwarte (prawy panel).
Karta preferencji
- Torakoskop 30 stopni
- Krzywy zacisk pierścieniowy do torakoskopów (Ryc. 4a, 4b)
- Przyssawka Yankauera
- Dyssektor orzechowy
- Długie kirety (Rycina 5)
Porady &Pułapki
- Użyj przyssawki / palca / patyczka z gąbki migdałkowej, aby „na ślepo” stworzyć przestrzeń roboczą w jamie opłucnej.
- Sprawdź, czy płuco ponownie się rozpręża, aby odpowiednio wypełnić klatkę piersiową przed opuszczeniem sali operacyjnej.
- Jeśli nie masz pewności co do postępu operacji, krwawienia, wielkości przecieku powietrza i ponownego rozprężenia płuca, przejdź do otwartej dekortykacji.
Wyniki
Dekortykacja torakoskopowa jest obecnie sprawdzonym postępowaniem w leczeniu odmy, a czas, jaki upłynął od powstania odmy do interwencji chirurgicznej, jest prawdopodobnie najbardziej predykcyjny dla możliwości przeprowadzenia operacji z powodzeniem. Tomografia komputerowa nie jest przydatna w tym zakresie, ale pomaga w umiejscowieniu portu i określeniu kierunku dekortykacji w obrębie klatki piersiowej. Zasady otwartej dekortykacji powinny być przestrzegane podczas stosowania technologii torakoskopowej. Wszystkie obszary z materiałem włóknistym muszą zostać zdrenowane, a leżące u ich podłoża płuca uwolnione od ograniczającej je powłoki opłucnej, aby umożliwić ich pełne ponowne rozprężenie. Odsetek powodzeń jest wysoki, a czas noszenia rurki w klatce piersiowej, długość pobytu w szpitalu, ból pooperacyjny i powrót do zdrowia są lepsze niż w przypadku torakotomii. Wskaźniki śmiertelności są niskie, podobnie jak wskaźniki nawrotów i komplikacji. Konwersje do otwartej torakotomii są częstsze niż po innych zabiegach torakoskopowych, ale należy to uznać raczej za efekt zdrowego osądu chirurgicznego niż porażkę tej techniki.
Torakoskopowa dekortykacja rozszerza wszechstronność torakochirurga w radzeniu sobie z infekcjami przestrzeni opłucnowej i może być stosowana do diagnozowania i leczenia tychże z doskonałymi wynikami.
Wideo 1
Wideo 2
Wideo 3
Wideo 4
Wideo 5
Wideo 6
Wideo 7
Video 8
Video 9
Video 10
Video 11
Video 12
- Światło RW. Parapneumonic effusions and empyema. Proc Am Thorac Soc 2006;3:75-80.
- Cassina PC et al. Video-assisted thoracoscopy in the treatment of pleural empyema: stage-based management and outcome. J Thorac Cardiovasc Surg 1999;117:234-8.
- Lardinois D et al. Delayed referral and gram-negative organisms increase the conversion thoracotomy rate in patients undergoing video-assisted thoracoscopic surgery for empyema. Ann Thorac Surg 2005;79:1851-6.
- Roberts JR. Minimally invasive surgery in the treatment of empyema: intraoperative decision making. Ann Thorac Surg 2003;76:225-30.
- Navsaria PH, Vogel RJ, Nicol AJ. Thoracoscopic evacuation of retained posttraumatic hemothorax. Ann Thorac Surg 2004;78:282-6.
- Shimizu K, et al. Successful video-assisted mediastinoscopic drainage of descending necrotizing mediastinitis. Ann Thorac Surg 2006;81:2279-81.
- Hope WW, Bolton WD, Stephenson JE. The utility and timing of surgical intervention for parapneumonic empyema in the era of video-assisted thoracoscopy. Am Surg 2005;71:512-4.
- Luh SP, et al. Video-assisted thoracoscopic surgery in the treatment of complicated parapneumonic effusions or empyemas: outcome of 234 patients. Chest 2005;127:1427-32.
- Wurnig PN, et al. Video-assisted thoracic surgery for pleural empyema. Ann Thorac Surg 2006;81:309-13.
.