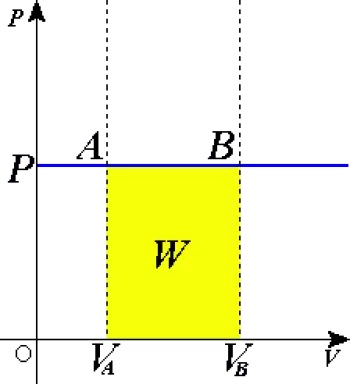
Un processo isobarico è un cambiamento di stato termodinamico di una certa quantità di materia in cui la pressione rimane costante. Ciò che può cambiare è una o più variabili di stato. Se viene trasferito calore al sistema, viene fatto del lavoro e cambia anche l’energia interna del sistema.
In un diagramma pressione-volume, guida una linea orizzontale secondo la legge dei gas ideali.
Il processo isobarico è governato dalla legge di Charles. Secondo la legge di Charles, per una massa fissa di gas ideale a pressione costante, il volume è direttamente proporzionale alla temperatura di Kelvin.
I processi isobarici sono regolati dalla prima legge della termodinamica. In questi processi, l’aumento di energia è uguale all’aumento di entalpia meno la pressione moltiplicato per l’aumento di volume:ΔE = ΔH – P – ΔV.
Da non confondere con i processi isotermici, che si svolgono a pressione costante o con quelli adiabatici, che non scambiano calore. In questi processi, può verificarsi una variazione di pressione. Quando il processo avviene in un volume costante si chiama processo isocorico.
Esempi di processi isobarici
Per capire meglio questo processo termodinamico, ci aiuterà vedere un paio di esempi.
-
Fase di espansione del cilindro di un motore.
-
Bollitura dell’acqua in un contenitore aperto.
-
Riscaldamento di un globo dovuto agli effetti della radiazione solare.
-
I palloni ad aria calda sperimentano un processo isobarico e isocronico.
Riscaldamento dell’aria di un pallone
Il cambiamento di volume che un pallone sperimenta quando i raggi del sole lo colpiscono è un esempio di processo isobarico. Mentre il sole aumenta la temperatura, il volume del gas (aria) sperimenta un’espansione isobarica.
All’inizio della mattina presenta una certa pressione, volume e temperatura, man mano che l’aria all’interno si riscalda, la pressione aumenta, ma questa non varia a causa dell’aumento del suo volume.
Fase di espansione del cilindro di un motore termico
Il cilindro di un motore termico può essere espanso o contratto a seconda della fase del ciclo. L’espansione dell’aria in un cilindro con un pistone mobile a cui viene fornito il calore si realizza con un processo isobarico. Allo stesso modo, durante la compressione, il volume si riduce isobaricamente.
Il volume aumenterà in proporzione alla sua temperatura e la pressione rimarrà costante. Questo è in accordo con la legge di Charles.
Bollitura dell’acqua in un contenitore aperto
Un esempio quotidiano di un processo isobarico è la bollitura dell’acqua in un contenitore aperto. Fornendo energia termica all’acqua, questa aumenta di temperatura e si trasforma in vapore.
Il vapore ottenuto ha una temperatura maggiore e occupa un volume maggiore, tuttavia, la pressione rimane costante. Dall’inizio la pressione è uguale alla pressione atmosferica.
Riscaldamento di una mongolfiera
Una mongolfiera è un esempio di processo isobarico.
I palloni ad aria calda funzionano perché l’aria calda sale. Riscaldando l’aria all’interno del pallone con il bruciatore, essa diventa più leggera dell’aria più fredda all’esterno. Questo fa sì che il pallone galleggi verso l’alto, come se fosse in acqua.
La pressione all’interno del pallone è la stessa di quella atmosferica. Quando il pilota inietta calore nell’aria, la temperatura aumenta. Fa diminuire la densità dell’aria e a causa della differenza tra la sua densità e quella dell’aria, il pallone sale.
Termodinamicamente, parte del calore viene convertito in lavoro facendo salire il pallone ad aria calda. Parte di questo calore viene rilasciato all’esterno del sistema a causa del contatto termodinamico dell’aria esterna e a causa della perdita di aria calda quando si espande.
W 1-2 = P ( V 2 – V 1 ) W 1-2 = n R ( T 2 – T 1 ) Q 1-2 = m c p ( T 2 – T 1 ) Q 1-2 = ( k / ( k -1)) P ( V 2 – V 1 )
dove,
-
W 1-2 quantità di lavoro fatto dal cambiamento di stato
-
Q 1-2 la quantità di calore fornito o rimosso
-
P la pressione
-
V il volume
-
T la temperatura assoluta
-
n la quantità di polvere (solitamente espressa in moli)
-
m la massa della sostanza
-
cp il calore specifico della sostanza a pressione costante
-
k è un rapporto uguale al quoziente del calore specifico a pressione costante e volume costante, rispettivamente
Dalla prima equazione possiamo vedere che se il sistema si espande (ΔV è positivo), allora il sistema fa lavoro positivo. Al contrario, se l’aumento di volume è negativo, il sistema si contrae e il lavoro è negativo.
Equazione di stato di un gas ideale
L’equazione di stato di un gas ideale (a volte l’equazione di Mendeleev – Clapeyron o l’equazione di Clapeyron) è una formula che stabilisce la relazione tra pressione, volume molare e temperatura assoluta di un gas ideale. L’equazione è:
pV = nRT
dove,
p – pressione,
V- volume del gas,
n- la quantità di gas,
R – costante universale dei gas, R ≈ 8,314 J / (mol⋅K),
T – temperatura termodinamica, K kelvin.