Historie
. V roce 1926 Boas tyto příznaky toxicity označil jako syndrom poškození vaječným bílkem. Mezi hlavní nálezy patřila těžká dermatitida, ztráta srsti a nedostatek svalové koordinace. Boas také zjistil, že kvasnice, játra a některé další potraviny obsahují látku, která krysy před syndromem poškození vaječným bílkem chrání. Hledání tohoto ochranného faktoru vedlo v roce 1936 k objevu biotinu.
Biochemický základ syndromu poškození vaječným bílkem byl rychle objasněn, když bylo zjištěno, že syrové vaječné bílky obsahují glykoprotein avidin, který má pozoruhodnou afinitu k biotinu. Vazba biotin-avidin je v podstatě nevratná; v důsledku toho se biotin z potravy neuvolňuje a komplex biotin-avidin se ztrácí ve stolici. Posledním krokem k vyřešení záhady syndromu poškození vaječných bílků bylo prokázání, že syndromu lze zabránit zahřátím vaječných bílků, což je proces, který denaturuje avidin a ničí jeho afinitu k biotinu.
Struktura
Biotin je bicyklická molekula složená z ureidového kruhu sloučeného s tetrahydrothiofenovým kruhem.
Ureidový kruh se podílí na vysoké afinitě biotinu k avidinu, glykoproteinu, který se nachází ve vaječném bílku. Na jeden ze dvou atomů uhlíku tetrahydrothiofenového kruhu je připojen substituent kyseliny valerové. Prostřednictvím této karboxylové skupiny je biotin kovalentně spojen s β-aminoskupinou lysinu v 5 karboxylázách, které hrají klíčovou roli v intermediárním metabolismu.
FUNKCE BIOTINU
Kromě dobře známé role biotinu jako kofaktoru v karboxylačních reakcích nedávné studie ukázaly, že biotin hraje důležitou roli v regulaci genové exprese a imunitní funkce.
Karboxylační reakce závislé na biotinu
Biotin funguje jako koenzym v karboxylačních reakcích zahrnujících metabolismus lipidů, glukózy a aminokyselin. Existuje 5 biotin-dependentních karboxylas, z nichž každá existuje jako neaktivní apoforma. Enzym holokarboxyláza syntetáza (HCLS ) katalyzuje přidání biotinu (biotinylace) k neaktivní apoformě, což vede ke vzniku aktivní karboxylázy. U všech 5 karboxylas funguje biotin jako koenzym nebo prostetická skupina, která slouží jako nosič CO2 ve vícestupňové reakci.
Pět biotin-dependentních karboxylas a jejich funkce jsou stručně popsány níže:
Pyruvátkarboxyláza (PC) katalyzuje tvorbu oxaloacetátu z pyruvátu, což je krok důležitý v TCA cyklu, glukoneogenezi a lipogenezi; nedostatek této funkce může vést k hypoglykémii, ketóze a laktátové acidóze.
Propionyl-CoA karboxyláza (PCC) katalyzuje přeměnu propionyl CoA na methylmalonyl CoA, který následně izomerizuje na sukcinyl CoA a vstupuje do TCA (Krebova) cyklu. PCC je důležitá v metabolismu mastných kyselin s lichým řetězcem a aminokyselin isoleucinu, valinu, methioninu a threoninu. Nedostatek funkce tohoto enzymu může vést k propionové acidémii. Hladina PCC v lymfocytech je citlivým ukazatelem stavu biotinu.
3-Methylcrotonoyl-CoA karboxylasa (MCC) se podílí na katabolismu větvené aminokyseliny leucinu. Nedostatek biotinu může vést k přesunu produktů katabolismu leucinu do alternativní katabolické dráhy vedoucí k produkci kyseliny 3-hydoxyisovalerové, která se pak vylučuje močí.
Acetyl-CoA karboxyláza I (ACC I) katalyzuje přeměnu acetyl CoA na malonyl CoA, v cytosolu, což je krok důležitý pro syntézu lipidů.
Acetyl-CoA karboxyláza II (ACC II), katalyzuje identickou reakci v mitochondriích; výsledný malonyl CoA hraje regulační roli při oxidaci mastných kyselin.
ACC I je cytosolový enzym; ostatní karboxylázy se nacházejí v mitochondriích.
Klinické projevy nedostatku biotinu se mohou vyskytnout také v důsledku genetických poruch způsobujících nedostatek enzymu holokarboxylázy syntetázy nebo nedostatek jednotlivých enzymů karboxylázy.
Exprese genů
Studie ukázaly, že biotinylace histonů může hrát roli v expresi genů. V lidských histonech bylo identifikováno více míst, která se vážou na biotin. Biotin může ovlivňovat genovou expresi i jinými mechanismy. V lidských buňkách je známo několik tisíc genů závislých na biotinu. Mezi geny ovlivňované biotinem patří geny kódující enzymy zapojené do metabolismu glukózy (např. glukokinázu), cytokiny jako interleukin-2 a inzulinový receptor.
Imunitní funkce
Studie naznačují roli biotinu v produkci protilátek, funkci makrofágů, diferenciaci T a B lymfocytů a také normální funkci přirozených zabíječů. U pacientů s nedostatkem biotinu jsou časté opakované infekce, zejména plísňové.
Úloha biotinu u neurologických stavů reagujících na vysoké dávky biotinu
Biotin-thiamin-responzivní onemocnění bazálních ganglií (BTBGD) je vzácný neurologický stav, který se může projevovat záchvaty a encefalopatií přecházející v kóma a smrt. K léčbě tohoto stavu byly úspěšně použity vysoké dávky biotinu ( 5-10 mg/kg/den), ale mechanismus účinku není znám.
Nedávno bylo zjištěno, že léčba vysokými dávkami biotinu (100-300 mg/den) zlepšuje příznaky u části pacientů s roztroušenou sklerózou. Předpokládá se, že zlepšení neurologických příznaků může zahrnovat zlepšení tvorby myelinu sekundárně v důsledku účinku vysokých dávek biotinu na syntézu mastných kyselin s dlouhým řetězcem.
Úloha biotinu u jedinců s poruchami vlasů, kůže a nehtů
Doplňky stravy s biotinem hojně užívají ti, kteří doufají, že dosáhnou zdravějších vlasů, kůže a nehtů. Důkazy o účinnosti biotinu pro toto použití jsou však omezené. Bylo zjištěno, že biotin ve vysokých dávkách je užitečný u dvou vzácných stavů: familiárního syndromu nekompletních vlasů a syndromu lámavých nehtů. Ve studii 541 žen trpících vypadáváním vlasů byla zjištěna nízká hladina biotinu v séru u 38 % pacientek. Autor dospěl k závěru, že etiologie vypadávání vlasů je multifaktoriální a doplňky biotinu lze zvážit, pokud byl prokázán nedostatek biotinu a byly vyloučeny jiné příčiny.
Zdroje biotinu
Biotin je obsažen v celé řadě potravin (maso, mléčné výrobky, zelenina, semena a ořechy) a je také produkován střevními bakteriemi. Kromě toho může značná část osob konzumovat doplňky stravy obsahující biotin.
Fyziologie biotinu
Přijatý biotin je přítomen ve volné a na bílkoviny vázané formě. Formy vázané na bílkoviny jsou tráveny gastrointestinálními proteázami a peptidázami za vzniku biocytinu a biotin-oligopeptidů. Volný biotin se uvolňuje z biocytinu a biotin-oligopeptidů působením střevní biotinidázy. Volný biotin se pak v tenkém střevě vstřebává prostřednictvím Na+ závislého mechanismu zprostředkovaného přenašečem, který přenáší také dvě další živiny, kyselinu pantothenovou a lipoát, a proto je znám jako sodík-dependentní multivitaminový přenašeč (SMVT). Lidský gen SMVT se nachází na chromozomu 2p23. Aktivita genu SMVT je regulována hladinou biotinu; zvyšuje se při nedostatku biotinu a snižuje při jeho nadměrné suplementaci. Bakteriálně syntetizovaný biotin je přítomen v nevázané formě a v tlustém střevě se vstřebává podobným mechanismem zprostředkovaným nosičem. Kombinovaný denní výdej biotinu močí a stolicí převyšuje příjem biotinu v potravě, což naznačuje důležitou roli střevní flóry jako zdroje biotinu.
Po vstřebání se biotin stává dostupným pro různé biotinylační procesy. Biotin se váže na každou z 5 apokarboxyláz za vzniku příslušné holokarboxylázy (viz obrázek níže) působením enzymu holokarboxyláza syntetázy.
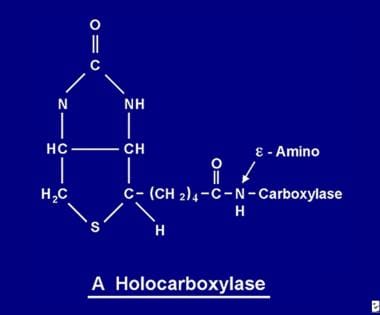 Molekula biotinu se váže na bílkovinu peptidovou vazbou na e-amino skupinu apokarboxylázy za vzniku holokarboxylázy.
Molekula biotinu se váže na bílkovinu peptidovou vazbou na e-amino skupinu apokarboxylázy za vzniku holokarboxylázy. Recyklace biotinu
Po provedení několika karboxylací je enzym holokarboxyláza zachycen buněčnými lysozomy. V lysozomech různé proteolytické enzymy degradují holokarboxylázu za vzniku biocytinu, který je zase hydrolyzován enzymem biotinidázou za vzniku biotinu a lysinu. Volný biotin je pak k dispozici pro vložení do apokarboxylázy za vzniku nové molekuly holokarboxylázy. Tento recyklační proces není stoprocentně účinný. V důsledku toho malé množství volného biotinu (a část biocytinu) uniká z cyklu a ztrácí se ve stolici a v moči. Z tohoto důvodu musí být biotin dodáván do střeva, aby se doplnil biotin ztracený z těla. Kroky zapojené do recyklace biotinu – jeho vstup do střeva, absorpce, zabudování do holokarboxyláz, které se následně rozkládají a uvolňují volný biotin – tvoří biotinový cyklus a jsou znázorněny na obrázku níže.
Enzym biotinidáza je nezbytný pro recyklaci biotinu, a proto se u jedinců s nedostatkem biotinidázy projevují známky a příznaky nedostatku biotinu.
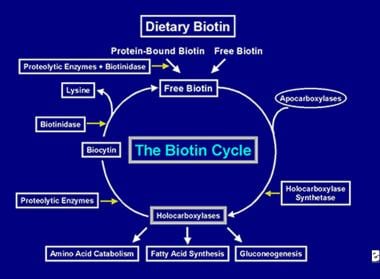 Zobrazení toku biotinu v biotinovém cyklu.
Zobrazení toku biotinu v biotinovém cyklu. Příčiny nedostatku biotinu
Jak již bylo uvedeno, biotin je široce dostupný v potravinách, je také produkován střevní flórou a v těle je ve velké míře recyklován pomocí enzymu biotinidázy; proto je nedostatek biotinu u zdravých jedinců, kteří se stravují normálně, vzácný. Níže jsou popsány stavy, které mohou vést k nedostatku biotinu:
Přemíra konzumace syrových vaječných bílků: Avidin obsažený v syrových vaječných bílcích má vysokou afinitu k biotinu, což znemožňuje jeho vstřebávání. Teplo avidin ničí, takže těm, kteří jedí vařená vejce, nedostatek biotinu nehrozí. Syrové vaječné bílky vedou k nedostatku biotinu pouze v případě, že jsou konzumovány v nadměrném množství (třeba tucet nebo více kusů denně).
Celková parenterální výživa bez suplementace biotinem: Bylo zaznamenáno několik případů nedostatku biotinu u pacientů, kteří dostávali dlouhodobou celkovou parenterální výživu (TPN) bez přídavku biotinu. Proto musí všichni pacienti dostávající TPN dostávat také biotin v doporučené denní dávce, zejména pokud se předpokládá, že léčba TPN bude trvat déle než 1 týden. Všechny nemocniční lékárny v současné době obsahují biotin v přípravcích TPN.
Používání kojenecké výživy s nedostatečným obsahem biotinu: U kojenců, kteří dostávají hypoalergenní výživu, byl hlášen nedostatek biotinu.
Chronická antikonvulzivní léčba: Dlouhodobé užívání antikonvulziv, fenobarbitalu, fenytoinu, primidonu a karbamazepinu, bylo spojeno s nedostatkem biotinu. Možné mechanismy zahrnují inhibici vychytávání biotinu přes střevní sliznici, zrychlený katabolismus biotinu a zhoršenou renální reabsorpci biotinu. Proto bylo u pacientů léčených antikonvulzivy, která jsou spojována s nedostatkem biotinu, navrženo doplňkové podávání biotinu.
Dlouhodobá perorální léčba antibiotiky: Dlouhodobé užívání perorálních antibiotik bylo spojeno s nedostatkem biotinu. Předpokládá se, že základem nedostatku biotinu je inhibice střevní flóry, která biotin produkuje. Dalším možným mechanismem by mohlo být antibiotiky vyvolané přemnožení bakterií, které biotin spotřebovávají.
Kouření a chronický alkoholismus: Studie ukázaly, že kouření může urychlit katabolismus biotinu, zejména u žen. Chronický alkoholismus může způsobit střevní malabsorpci biotinu.
Syndrom krátkého střeva a zánětlivé onemocnění střev: Jedinci se syndromem krátkého střeva a zánětlivým střevním onemocněním jsou rovněž ohroženi nedostatkem biotinu v důsledku střevní malabsorpce biotinu.
Marginální nedostatek biotinu během těhotenství a kojení: Nedávné studie prokázaly sníženou hladinu biotinu u významné části těhotných a kojících žen. Existují obavy, že marginální nedostatek biotinu během těhotenství může být teratogenní, a někteří odborníci doporučují těhotným ženám vyšší příjem biotinu.
K projevům nedostatku biotinu mohou vést také některé vrozené chyby metabolismu biotinu.
Deficit biotinidázy (BTD) se dědí autozomálně recesivně a vyskytuje se s frekvencí přibližně 1 z 60 000 živě narozených dětí; odhaduje se, že 1 ze 120 jedinců je heterozygotní. U jedinců, kteří jsou homozygoti pro tuto poruchu, je hladina biotinidázy < 30 % normální, což vede k nedostatku biotinu v důsledku nedostatečného uvolňování volného biotinu v důsledku snížené recyklace biotinu. Příznaky BTD se obvykle objevují mezi 1 týdnem a 1 rokem věku. Závažnost nedostatku enzymu se může lišit. Osoby s hlubokým nedostatkem biotinidázy mají hladinu BTD nižší než 10 % normálu, zatímco osoby s částečným nedostatkem biotinidázy mají hladinu enzymu mezi 10-30 % normálu. V USA a mnoha dalších zemích zahrnuje novorozenecký screening testy na nedostatek BTD. Bylo zaznamenáno přibližně 150 mutací v genu BTD, které způsobují nedostatek biotinidázy. Gen BTD se nachází na chromozomu 3p25. Pro studium různých aspektů této poruchy byl vyvinut myší model deficitu biotinidázy.
Deficit syntetázy holokarboxylázy (HCLS) je rovněž autozomálně recesivní porucha a může být diagnostikována prenatálně. Jak již bylo uvedeno dříve, enzym HCLS je nutný pro biotinylaci enzymů apokarboxyláz na aktivní formy holokarboxyláz; proto jeho nedostatek vede k mnohočetnému deficitu karboxyláz. Děti s touto poruchou se v prvních měsících života projevují acidózou, hyperamonémií, hypotonií, záchvaty a opožděným vývojem. Deficit HCLS způsobují mutace v genu HCLS.
Protože nedostatek biotinidázy i HCLS vede ke snížení hladin biotin-dependentních karboxyláz, byly tyto dva stavy klasifikovány také jako mnohočetný nedostatek karboxyláz. Hluboký nedostatek biotinidázy byl dříve znám jako časný nedostatek mnohočetné karboxylázy, částečný nedostatek biotinidázy jako pozdní nebo juvenilní nedostatek mnohočetné karboxylázy a nedostatek HCLS jako novorozenecký nebo časný nedostatek mnohočetné karboxylázy.
Vzácně se mohou vyskytnout také izolované deficity každé z pěti jednotlivých biotin-dependentních karboxyláz.
Byl popsán také deficit biotinu v důsledku defektu v transportu biotinu.
Bez ohledu na etiologii nedostatku biotinu jsou klinické projevy podobné. Věk nástupu, rychlost rozvoje příznaků a pořadí, v jakém se příznaky objevují, se však mohou značně lišit. Všechny mechanismy odpovědné za rozvoj projevů nebyly stanoveny.
.