történet
Az 1900-as évek elején kutatók megállapították, hogy nagy mennyiségű nyers tojásfehérje bevitele a patkányok étrendjébe a mérgezés tüneteit okozta. Boas 1926-ban ezeket a mérgezési tüneteket tojásfehérje-sérülési szindrómának nevezte. A főbb megállapítások közé tartozott a súlyos bőrgyulladás, a szőrhullás és az izomkoordináció hiánya. Boas azt is megjegyezte, hogy az élesztő, a máj és számos más élelmiszer olyan anyagot tartalmazott, amely megvédte a patkányokat a tojásfehérje-sérülés szindrómától. Ennek a védőfaktornak a keresése vezetett 1936-ban a biotin felfedezéséhez.
A tojásfehérje-sérülés szindróma biokémiai alapjait gyorsan tisztázták, amikor kiderült, hogy a nyers tojásfehérje avidin glikoproteint tartalmaz, amely figyelemre méltó affinitással rendelkezik a biotinhoz. A biotin-avidin kötés lényegében irreverzibilis; ennek következtében a biotin nem szabadul fel az ételből, és a biotin-avidin komplex a széklettel elvész. A tojásfehérje-sérülés szindróma rejtélyének megoldásához vezető utolsó lépés annak bizonyítása volt, hogy a szindróma megelőzhető a tojásfehérje melegítésével, amely folyamat denaturálja az avidint és megsemmisíti a biotin iránti affinitását.
Szerkezet
A biotin egy biciklikus molekula, amely egy tetrahidrotioféngyűrűvel fuzionált ureidógyűrűből áll.
Az ureidógyűrű részt vesz a biotin nagy affinitású kötődésében az avidinhez, a tojásfehérjében található glikoproteinhez. A tetrahidrotioféngyűrű 2 szénatomjának egyikéhez egy valeriánsav-szubsztituens kapcsolódik. Ezen a karboxilcsoporton keresztül a biotin kovalens módon kapcsolódik a lizin β-aminocsoportjához 5 karboxilázban, amelyek kritikus szerepet játszanak a köztes anyagcserében.
Biotin funkciói
A biotin karboxilációs reakciókban betöltött jól ismert kofaktor szerepén túlmenően a legújabb vizsgálatok kimutatták, hogy a biotin fontos szerepet játszik a génexpresszió és az immunműködés szabályozásában.
Biotin-függő karboxilációs reakciók
A biotin koenzimként működik a lipid-, glükóz- és aminosav-anyagcserét érintő karboxilációs reakciókban. 5 biotinfüggő karboxiláz létezik, amelyek mindegyike inaktív apoformaként létezik. A holokarboxiláz-szintetáz (HCLS ) enzim katalizálja a biotin addícióját (biotiniláció) az inaktív apoformához, ami az aktív karboxiláz kialakulásához vezet. Mind az 5 karboxilázban a biotin koenzimként vagy prosztetikus csoportként működik, amely a CO2 hordozójaként szolgál a többlépcsős reakcióban.
Az alábbiakban röviden ismertetjük az öt biotinfüggő karboxilázt és azok funkcióit:
A piruvát-karboxiláz (PC) katalizálja az oxalacetát képződését piruvátból, ami fontos lépés a TCA-ciklusban, a glükoneogenezisben és a lipogenezisben; e funkció hiánya hipoglikémiához, ketózishoz és tejsavas acidózishoz vezethet.
A propionil-CoA-karboxiláz (PCC) katalizálja a propionil-CoA átalakulását metilmalonyl-CoA-vá, amely viszont izomerizálódik szukcinil-CoA-vá, és belép a TCA (Kreb-ciklusba). A PCC fontos szerepet játszik a páratlan láncú zsírsavak, valamint az izoleucin, valin, metionin és treonin aminosavak anyagcseréjében. Ennek az enzimfunkciónak a hiánya propionsavhiányhoz vezethet. A PCC szintje a limfocitákban a biotin-státusz érzékeny indikátora.
A 3-metil-krotonoil-CoA-karboxiláz (MCC) részt vesz az elágazó láncú aminosav, a leucin katabolizmusában. A biotin hiánya a leucin katabolizmus termékeinek egy alternatív katabolikus útvonalra való átirányításához vezethet, ami 3-hidroxi-izovaleriánsav termeléséhez vezet, amely aztán a vizelettel ürül.
Acetil-CoA-karboxiláz I (ACC I) katalizálja az acetil-CoA átalakulását malonyl-CoA-vá a citoszolban, ami fontos lépés a lipidszintézisben.
Acetil-CoA-karboxiláz II (ACC II), a mitokondriumban katalizálja az azonos reakciót; a keletkező malonyl-CoA szabályozó szerepet játszik a zsírsavak oxidációjában.
Az ACC I citoszolikus enzim; a többi karboxiláz a mitokondriumokban található.
A biotinhiány klinikai megnyilvánulásai a holokarboxiláz-szintetáz enzim hiányát vagy az egyes karboxiláz enzimek hiányát okozó genetikai rendellenességek következtében is előfordulhatnak.
Génkifejeződés
Tanulmányok kimutatták, hogy a hisztonok biotinilációja szerepet játszhat a génexpresszióban. Az emberi hisztonokban több biotinhoz kötődő helyet azonosítottak. A biotin más mechanizmusok révén is befolyásolhatja a génexpressziót. Az emberi sejtekben néhány ezer biotinfüggő gén ismert. A biotin által befolyásolt gének közé tartoznak a glükóz-anyagcserében részt vevő enzimeket (pl. glükokináz), az olyan citokineket, mint az interleukin-2 és az inzulinreceptor kódoló gének.
Immunfunkció
A vizsgálatok szerint a biotin szerepet játszik az antitesttermelésben, a makrofágok működésében, a T- és B-limfociták differenciálódásában, valamint a természetes ölősejtek normális működésében. Visszatérő fertőzések, különösen gombás fertőzések gyakoriak a biotinhiányos betegeknél.
A biotin szerepe a nagy dózisú biotinra reagáló neurológiai állapotokban
A biotin-tiaminra reagáló bazális ganglion betegség (BTBGD) egy ritka neurológiai állapot, amely görcsökkel és encephalopathiával járhat, amely kómáig és halálig terjed. Nagy dózisú biotinnal ( 5-10 mg/kg/nap) sikeresen kezelték ezt az állapotot, de a hatásmechanizmus ismeretlen.
Újabban a nagy dózisú biotinkezelés (100-300 mg/nap) a sclerosis multiplexben szenvedő betegek egy alcsoportjánál javítja a tüneteket. Úgy gondolják, hogy a neurológiai tünetek javulása a nagy dózisú biotin hosszú láncú zsírsavak szintézisére gyakorolt hatásának másodlagos, javuló myelintermelésével függhet össze.
A biotin szerepe haj-, bőr- és körömrendellenességben szenvedő egyéneknél
A biotin-kiegészítőket széles körben használják azok, akik egészségesebb hajat, bőrt és körmöket szeretnének elérni. A biotin ilyen célú hatékonyságára azonban csak korlátozott bizonyítékok állnak rendelkezésre. A biotin nagy dózisban két ritka betegségben bizonyult hasznosnak: a familiáris fésületlen haj szindrómában és a törékeny köröm szindrómában. Egy 541 hajhullással jelentkező nő vizsgálata során a szérum biotinszintjét a betegek 38%-ánál alacsonynak találták. A szerző arra a következtetésre jutott, hogy a hajhullás etiológiája multifaktoriális, és a biotinpótlás megfontolandó, ha biotinhiányt mutattak ki, és más okokat kizártak.
A biotin forrásai
A biotin számos élelmiszerben (húsok, tejtermékek, zöldségek, magvak és diófélék) megtalálható, és a bélbaktériumok is termelik. Ezenkívül az egyének jelentős része biotintartalmú étrend-kiegészítőket is fogyaszthat.
Biotin élettana
A bevitt biotin szabad és fehérjéhez kötött formában van jelen. A fehérjékhez kötött formákat a gyomor-bélrendszeri proteázok és peptidázok emésztik, és így biotint és biotin-oligopeptideket képeznek. A szabad biotin a biocitinből és a biotin-oligopeptidekből a bél biotinidáz hatására szabadul fel. A szabad biotin ezután a vékonybélben egy Na+ -függő, hordozó által közvetített mechanizmuson keresztül szívódik fel, amely két másik tápanyagot, a pantoténsavat és a lipoátot is szállítja, és ezért nátriumfüggő multivitamin-transzporter (SMVT) néven ismert. Az emberi SMVT gén a 2p23 kromoszómán található. Az SMVT aktivitását a biotinszint szabályozza; biotinhiány esetén felfelé szabályozódik, biotin túladagolás esetén pedig lefelé szabályozódik. A bakteriálisan szintetizált biotin nem kötött formában van jelen, és a vastagbélben hasonló hordozó által közvetített mechanizmus révén szívódik fel. A vizeletben és a székletben a biotin együttes napi kibocsátása meghaladja a táplálékkal bevitt biotin mennyiségét, ami a bélflóra mint biotinforrás fontos szerepére utal.
A felszívódás után a biotin elérhetővé válik a különböző biotinilációs folyamatok számára. A biotin az 5 apokarboxiláz mindegyikéhez kötődik, hogy a holokarboxiláz-szintetáz enzim hatására a megfelelő holokarboxiláz (lásd az alábbi képet) alakuljon ki.
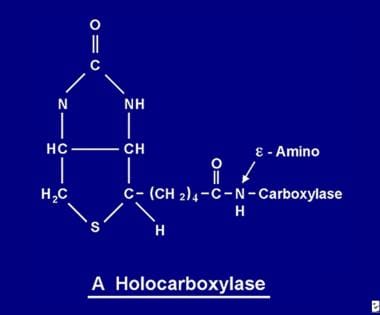 A biotin molekula egy peptidkötéssel egy apokarboxiláz e-amino-csoportjához kötődik a fehérjéhez, így alakul ki a holokarboxiláz.
A biotin molekula egy peptidkötéssel egy apokarboxiláz e-amino-csoportjához kötődik a fehérjéhez, így alakul ki a holokarboxiláz. A biotin újrahasznosítása
A holokarboxiláz enzim több karboxiláció elvégzése után a sejtes lizoszómák befogják. A lizoszómákban különböző proteolitikus enzimek lebontják a holokarboxilázt biocitinné, amelyet viszont a biotinidáz enzim biotinná és lizinné hidrolizál. A szabad biotin ezután rendelkezésre áll az apokarboxilázba való beépüléshez, hogy új holokarboxilázmolekulát képezzen. Ez az újrahasznosítási folyamat nem 100%-os hatékonyságú. Ennek eredményeként kis mennyiségű szabad biotin (és némi biocitin) kikerül a ciklusból, és a széklettel és a vizelettel elvész. Emiatt a biotint a bélbe kell juttatni, hogy a szervezetből elveszett biotint pótolni lehessen. A biotin újrahasznosításának lépései – a bélbe való bejutása, felszívódása, beépülése a holokarboxilázokba, amelyek viszont lebomlanak, hogy szabad biotint szabadítsanak fel – alkotják a biotin-ciklust, amelyet az alábbi képen ábrázolunk.
A biotinidáz enzim nélkülözhetetlen a biotin újrahasznosításához, ezért a biotinidázhiányos egyéneknél a biotinhiány jelei és tünetei jelentkeznek.
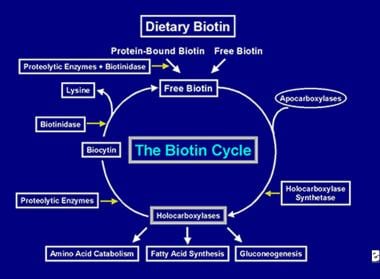 A biotin áramlásának ábrázolása a biotinciklusban.
A biotin áramlásának ábrázolása a biotinciklusban. Biotinhiány okai
Amint korábban említettük, a biotin széles körben elérhető az élelmiszerekben, a bélflóra is termeli, és a szervezetben a biotinidáz enzim segítségével nagymértékben újrahasznosul, ezért a biotinhiány egészséges, normális étrenden élő egyéneknél ritka. A biotinhiányhoz vezető állapotokat az alábbiakban ismertetjük:
A nyers tojásfehérje túlzott fogyasztása: A nyers tojásfehérjében lévő avidin nagy affinitással rendelkezik a biotinhoz, így az nem áll rendelkezésre a felszívódáshoz. A hő elpusztítja az avidint, így aki főtt tojást fogyaszt, azt nem fenyegeti a biotinhiány veszélye. A nyers tojásfehérje csak akkor vezet biotinhiányhoz, ha túlzott mennyiségben fogyasztják (talán napi egy tucat vagy több).
Teljes parenterális táplálás biotinpótlás nélkül: Számos esetben számoltak be biotinhiányról olyan betegeknél, akik hosszan tartó teljes parenterális táplálást (TPN) kaptak hozzáadott biotin nélkül. Ezért minden TPN-ben részesülő betegnek biotint is kell kapnia az ajánlott napi adagban, különösen, ha a TPN-terápia várhatóan 1 hétnél tovább tart. Jelenleg minden kórházi gyógyszertár tartalmaz biotint a TPN-készítményekben.
Nem megfelelő biotint tartalmazó csecsemőtápszerek használata: Hipoallergén tápszereket kapó csecsemőknél biotinhiányról számoltak be.
Krónikus görcsoldó kezelés: Az antikonvulzívumok, fenobarbitál, fenitoin, primidon és karbamazepin tartós alkalmazása összefüggésbe hozható a biotinhiánnyal. A lehetséges mechanizmusok közé tartozik a biotin felvételének gátlása a bélnyálkahártyán keresztül, a felgyorsult biotin-katabolizmus és a biotin károsodott vese-visszaszívódása. Ezért a biotinhiánnyal összefüggésbe hozott görcsoldókkal kezelt betegek számára biotinpótlás javasolt.
Hosszan tartó orális antibiotikumterápia: A szájon át szedett antibiotikumok hosszan tartó alkalmazását összefüggésbe hozták a biotinhiánnyal. A biotint termelő bélflóra gátlása feltehetően a biotinhiány alapja. Egy másik lehetséges mechanizmus lehet a biotint fogyasztó baktériumok antibiotikum okozta túlszaporodása.
Dohányzás és krónikus alkoholizmus: Vizsgálatok kimutatták, hogy a dohányzás felgyorsíthatja a biotin katabolizmust, különösen a nőknél. A krónikus alkoholizmus a biotin bélrendszeri felszívódási zavarát okozhatja.
Kurta bél szindróma és gyulladásos bélbetegség: A rövidbél szindrómában és gyulladásos bélbetegségben szenvedő egyének szintén ki vannak téve a biotinhiány kockázatának a biotin bélrendszeri malabszorpciója következtében.
Marginalis biotinhiány terhesség és szoptatás alatt: A közelmúltban végzett vizsgálatok a terhes és szoptató nők jelentős részénél csökkent biotinszintet mutattak ki. Aggodalomra ad okot, hogy a terhesség alatti marginális biotinhiány teratogén lehet, és egyes szakértők magasabb biotinbevitelt javasolnak a terhes nőknek.
A biotin metabolizmus bizonyos veleszületett hibái szintén a biotinhiány megnyilvánulásához vezethetnek.
A biotinidáz-hiány (BTD) autoszomális recesszív módon öröklődik, és körülbelül 60 000 élveszületésből 1-szer fordul elő; becslések szerint 120-ból 1 egyén heterozigóta az állapotra. A rendellenességre homozigóta egyéneknél a biotinidáz szintje < 30%-ban normális, ami biotinhiányhoz vezet, mivel a biotin csökkent újrahasznosítása miatt nem szabadul fel elegendő szabad biotin. A BTD tünetei jellemzően 1 hetes és 1 éves kor között alakulnak ki. Az enzimhiány súlyossága változó lehet. A mély biotinidázhiányban szenvedőknél a BTD szintje kevesebb, mint 10% a normális, míg a részleges biotinidázhiányban szenvedőknél az enzim szintje 10-30% között van. Az Egyesült Államokban és számos más országban az újszülöttkori szűrés magában foglalja a BTD-hiány vizsgálatát. A BTD gén körülbelül 150 mutációjáról számoltak be, amelyek biotinidázhiányt okoznak. A BTD gén a 3p25 kromoszómán található. A biotinidázhiány egérmodelljét fejlesztették ki a rendellenesség különböző aspektusainak tanulmányozására.
Aholokarboxiláz-szintetáz (HCLS) hiány szintén autoszomális recesszív rendellenesség, és prenatálisan diagnosztizálható. Mint korábban tárgyaltuk, a HCLS enzim szükséges az apokarboxiláz enzimek biotinilálásához az aktív holokarboxiláz formákká; ezért hiánya többszörös karboxilázhiányhoz vezet. Az ebben a rendellenességben szenvedő csecsemők az élet első néhány hónapjában acidózissal, hiperammonémiával, hipotóniával, görcsökkel és fejlődési késéssel jelentkeznek. A HCLS gén mutációi HCLS-hiányt okoznak.
Mivel mind a biotinidáz-, mind a HCLS-hiány a biotinfüggő karboxilázok csökkent szintjéhez vezet, a két állapotot többszörös karboxilázhiánynak is nevezik. A súlyos biotinidázhiányt korábban korai kezdetű multiplex karboxilázhiányként, a részleges biotinidázhiányt késői vagy juvenilis kezdetű multiplex karboxilázhiányként, a HCLS-hiányt pedig újszülöttkori vagy korai kezdetű multiplex karboxilázhiányként ismerték.
Ritkán az öt egyes biotinfüggő karboxiláz mindegyikének izolált hiánya is előfordulhat.
A biotintranszport hibájából eredő biotinhiányt is leírtak.
A biotinhiány etiológiájától függetlenül a klinikai tünetek hasonlóak. A tünetek megjelenésének kora, a tünetek kialakulásának üteme és a tünetek megjelenésének sorrendje azonban nagymértékben eltérhet egymástól. A megnyilvánulások kialakulásáért felelős mechanizmusok mindegyike nem bizonyított.