Diabetes mellitus er dyrt, men de fleste af omkostningerne skyldes komplikationer og hospitalsbehandling.1 Ifølge American Diabetes Association (ADA) var de samlede anslåede udgifter til diabetes i 2012 på 245 milliarder dollars.1 Det anslås, at 43 % af udgifterne til hospitalsindlæggelser og yderligere 18 % til recepter til håndtering af komplikationer til diabetes.1
De fleste af disse komplikationer kan forebygges med målrettet glukosekontrol. Epidemiologiske data viser, at for hvert procentpoint fald i hæmoglobin A1c (HbA1c) sker der en risikoreduktion på 35 % for mikrovaskulære komplikationer.2 Den gode nyhed er, at komplikationsraten for diabetes er blevet reduceret,3 men dette er blevet overhalet af den blotte stigning i antallet af personer med diabetes, der udvikler sig med komplikationer.
Mange personer med type 2-diabetes kan have en diabetesrelateret komplikation på diagnosetidspunktet. Ved både type 1- og type 2-diabetes er nogle af komplikationerne, som f.eks. retinopati og nefropati, tavse. Dette kræver en aggressiv målrettet tilgang, fordi det vil være for sent at vente på symptomer. Selv diabetisk neuropati vil være asymptomatisk hos op til 50 % af de personer med målbare abnormiteter4 .
Denne artikel vil gennemgå anbefalingerne fra ADA 2017 Standards of Care for mikrovaskulære komplikationer og relevante standpunktsudtalelser og vil fremhæve forebyggende screening og kliniske perler til den primære læge, der behandler patienter med diabetes.
- Diabetisk retinopati
- Tabel 1. Retinopatistadier med beskrivelse
- Kliniske perler
- Diabetes nyresygdom
- Tabel 2. Udvalgte skelsættende undersøgelser, der påviser glykæmisk kontrol med A1c under 7 %
- Tabel 3. Estimeret GFR med stadie og beskrivelse
- Tabel 4. Albuminuriekategorier i CKD
- Figur 1. Foreslået evalueringshyppighed (antal gange om året) efter eGFR- og albuminuriekategori
- Tabel 5. Røde flag, der tyder på ikke-diabetisk glomerulær sygdom
- Tabel 6. Dosisjusteringer og anbefalinger for glukosesænkende midler hos patienter med nedsat nyrefunktion
- Klasse
- Medicinering
- Kliniske perler
- Diabetisk perifer neuropati
- Tabel 7. Andre årsager til neuropati67
- Tabel 8. Almindeligt anvendte farmakologiske midler til DPN4,69
- Kliniske perler
- Gastroparese
- Kliniske perler
- Diabetisk cheiroarthropati
- Konklusion
Diabetisk retinopati
Diabetisk retinopati er en almindelig mikrovaskulær komplikation ved type 1- og type 2-diabetes. Det anslås, at 3,7 millioner mennesker på verdensplan er moderat til alvorligt synshandicappede på grund af diabetisk retinopati, og mere end 800.000 mennesker på verdensplan er blinde på grund af diabetisk retinopati.5 Det er den hyppigste årsag til nyopstået blindhed hos voksne mellem 20-74 år.6 Der er blevet foretaget stærke korrelationer til glykæmisk kontrol, blodtrykskontrol og sygdomsvarighed. Gennem tidlig, regelmæssig screening og kontrol af disse risikofaktorer kan diabetisk retinopati opdages og behandles for at forebygge synsforringelse.
Duration af diabetes er den største risikofaktor for diabetisk retinopatis progression. Ved type 1-diabetes er retinopati sjælden i de første 3-5 år eller før puberteten.7 I de følgende 20 år vil næsten alle patienter med type 1-diabetes udvikle diabetisk retinopati.7 Hos patienter med type 2-diabetes vil helt op til 21 % have en vis grad af retinopati på diagnosetidspunktet.7 Kronisk hyperglykæmi, nefropati, hypertension og dyslipidæmi er andre faktorer, der øger risikoen for eller er associeret med diabetisk retinopati.8 Op til 50 % af patienter med albuminuri (uanset niveauet for den estimerede glomerulære filtrationshastighed) vil have retinopati.9 Tabel 1 beskriver de forskellige stadier af retinopati.
Tabel 1. Retinopatistadier med beskrivelse |
|
|
Stadie |
Beskrivelse |
|
Mild IkkeProliferativ diabetisk retinopati |
Mikroaneurismer til stede |
|
Moderat ikke-proliferativ diabetisk retinopati |
Mikroaneurismer, retinale punkt- eller pletblødninger, hårde eksudater, eller vatpletter kan være til stede |
|
Svær ikke-proliferativ diabetisk retinopati |
Intraretinale blødninger, venøse perler, eller intraretinale mikrovaskulære abnormiteter kan være til stede |
|
Proliferativ diabetisk retinopati |
Neovaskularisering, vitreøse eller præretinale blødninger til stede |
Patofysiologi. Milde, ikke-proliferative abnormiteter karakteriseret ved øget vaskulær permeabilitet kan udvikle sig til moderat til svær ikke-proliferativ diabetisk retinopati (NPDR).7 Proliferativ diabetisk retinopati er karakteriseret ved proliferation af nye retinale blodkar.7 Makulaødem, som er en central fortykkelse af nethinden med eksudation og ødem, kan forekomme på alle stadier af retinopati.7 Diabetisk retinopati kan fremskyndes af graviditet, pubertet, manglende glykæmisk kontrol, hypertension og kataraktoperation.7
Forebyggelse af diabetisk retinopati. Glykæmisk kontrol er nøglen til forebyggelse af diabetisk retinopati. I Diabetes Control and Complications Trial (DCCT) evaluerede forskerne effekten af stram glykæmisk kontrol og progression fra ingen eller minimal retinopati ved baseline til moderat NPDR.10 For patienter i den intensive behandlingsgruppe uden retinopati ved baseline blev den gennemsnitlige risiko for retinopati reduceret med 76 % i løbet af 36 måneder.10 Blandt patienter i gruppen med intensiv behandling, som allerede havde minimal til moderat NPDR, blev risikoen for progression reduceret med 54 % i forhold til patienter med konventionel behandling.10 I det oprindelige ACCORD-forsøg (Action to Control Cardiovascular Risk in Diabetes) blev deltagere med type 2-diabetes i 10 år og kendt kardiovaskulær sygdom randomiseret til intensiv behandling eller standardbehandling for glykæmi, systolisk blodtryk og dyslipidæmi. Fire år senere blev retinopati-progressionen reduceret hos dem med tidligere intensiv glykæmisk kontrol, uanset lignende aktuelle HbA1c-niveauer.11 Lignende arveeffekter blev ikke set i de grupper med intensiv blodtrykskontrol eller på fenofibrat for dyslipidæmi.11
Screening. Da makulaødem og proliferativ diabetisk retinopati kan være asymptomatiske, er screening afgørende for tidlig påvisning og behandling. For patienter med type 1-diabetes bør screening påbegyndes fem år efter diagnosen.8 For patienter med type 2-diabetes bør screening påbegyndes ved diagnosen.8 Screening bør gennemføres af en øjenlæge eller optometrist, der har erfaring med diabetisk retinopati. Screeningen bør gennemføres med udvidede øjne. Hvis der allerede er retinopati, anbefales henvisning til en øjenlæge.8 Der bør foretages en gentagelse af evalueringen hvert år, hvis der findes minimal eller ingen sygdom.8
Graviditet er et højrisikotidspunkt for proliferativ retinopati. Hos gravide kvinder med præeksisterende type 1- eller type 2-diabetes bør der foretages øjenundersøgelser før undfangelsen eller i første trimester. Undersøgelserne bør gentages hvert trimester og i et år efter fødslen.8 For personer med gestationel diabetes er det ikke nødvendigt med yderligere øjenundersøgelser efter fødslen.
Graviditet hos patienter med præeksisterende type 1- eller type 2-diabetes kan resultere i hurtig progression af diabetisk retinopati. Dette gælder især, hvis der er dårlig glykæmisk kontrol på befrugtningstidspunktet.14 Kvinder med diabetes, som er gravide eller planlægger at blive gravide, bør rådgives om risikoen for udvikling eller progression af diabetisk retinopati og behovet for glykæmisk kontrol før befrugtningen.8 Der kan dog ske en tidlig forværring af retinopati ved hurtig gennemførelse af intensiv glykæmisk behandling, hvis retinopati allerede er til stede.8 Gestationsdiabetes synes ikke at give den samme risiko for udvikling af diabetisk retinopati under graviditeten.8
Behandling. Ud over glykæmisk kontrol har blodtrykskontrol (< 140 mmHg systolisk) også vist sig at mindske udviklingen af diabetisk retinopati, men der er ingen yderligere fordel ved stram kontrol af systolisk blodtryk < 120 mmHg.12 Fenofibrat kan også bremse udviklingen af diabetisk retinopati, især ved meget mild NPDR, hos patienter med dyslipidæmi.13 Aspirin viste sig ikke at have nogen effekt på progression af retinopati, udvikling af glaslegemeblødning eller varighed af glaslegemeblødning, og det kan anvendes sikkert til andre medicinske indikationer uden okulær kompromittering.7
Behandlingen af patienter med diabetes bør omfatte anbefalinger om motion. Personer med let nonproliferativ retinopati kan begynde fysisk aktivitet uden risiko. Patienter med moderat nonproliferativ retinopati bør dog undgå aktiviteter, der i høj grad øger blodtrykket, f.eks. styrkeløft.15 Patienter med svær nonproliferativ eller ustabil retinopati bør undgå enhver fysisk aktivitet, der er kraftig (spring, rystelser), enhver aktivitet med hovedet nedad og åndedrætsstop.15 I tilfælde af glaslegemsblødning bør der ikke dyrkes motion.15
Den tidlige påvisning af diabetisk retinopati er vigtig, fordi behandling kan forhindre eller vende synstab. I Diabetic Retinopathy Study (DRS) fandt forskerne, at fotokoagulationskirurgi var en effektiv behandling af diabetisk retinopati. Early Treatment Diabetic Retinopathy Study og DRS viste, at fotokoagulation mindskede risikoen for synstab, med størst fordel hos patienter, der havde mere fremskreden grundsygdom.16,17 Aktuelle data giver beviser for, at intravitreale antivaskulære endotheliale vækstfaktorer (anti-VEGF) er mere effektive til behandling af makulaødem end monoterapi eller kombinationsbehandling med laserkoagulation.8 Desuden kan anti-VEGF forbedre synet, hvorimod fotokoagulation kun forhindrer yderligere synstab.18,19 En ulempe ved anti-VEGF er, at det kræver månedlig intravitreal behandling i de første 12 måneder.
Kliniske perler
- Der er ingen specifikke tegn eller symptomer på tidlig diabetisk retinopati.
- Screening for diabetisk retinopati bør finde sted hos patienter:
– med type 1-diabetes fem år efter diagnosen.
– hos patienter med type 2-diabetes ved diagnosen.
- Rådgivning og øgede undersøgelser bør tilbydes diabetiske kvinder, der planlægger at blive eller bliver gravide, da diabetisk retinopati kan accelereres hurtigt under graviditet.
- Streng glykæmisk kontrol og blodtrykskontrol (< 140 mmHg systolisk) kan forebygge udviklingen af diabetisk retinopati.
- Op til 50 % af patienter med albuminuri (uanset eGFR-niveau) vil have retinopati.9
- Behandling med fotokoagulation kan forhindre progression af sygdommen, og anti-VEGF-behandling kan vende synstab som følge af makulaødem.
Diabetes nyresygdom
Diabetes nyresygdom (DKD), som er den foretrukne terminologi af ADA, er den førende årsag til kronisk nyresygdom (CKD) i USA.20,21 DKD har betydelige langsigtede virkninger på livskvaliteten hos patienter med diabetes og er ansvarlig for op til 40 % af endestadiet af nyresygdom (ESRD).20 Baseret på National Kidney Foundation’s Kidney Disease Outcomes Quality Initiative (KDOQI) og ADA 2017 Standards of Care vil dette afsnit give vejledning om mål HbA1c-niveauer, medicinhåndtering og terapeutisk behandling til patienter med DKD.
KDOQI stratificerer mål HbA1c-niveauet efter patientens risiko for hypoglykæmi og komorbiditeter. Dette initiativ er baseret på tre publikationer, der viser, at glykæmisk kontrol med HbA1c under 7 % vil forebygge eller mindske progressionen af nyresygdom hos patienter med type 2-diabetes.22,23,24 Disse undersøgelser er opsummeret i tabel 2. ADA anbefaler, at hos patienter med større risiko for hypoglykæmi bør målet for HbA1c hæves til over 7 %.8 KDOQI anbefaler, at patienter med CKD stadie 4 og 5, der har begrænset forventet levetid, opretholder et HbA1c på over 7 %.25
Tabel 2. Udvalgte skelsættende undersøgelser, der påviser glykæmisk kontrol med A1c under 7 % |
|
|
Vejledning |
Resultater |
|
Action in Diabetes and Vascular Disease: Preterax and Diamicron Modified Release Controlled Evaluation (ADVANCE) Trial22 |
21% reduktion ny makroalbuminuri og nyresubstitutionsbehandling med A1c under 7% |
|
Veterans Affairs Diabetes Trial (VADT)23 |
37% reduktion i makroalbuminuri og 32 % reduktion i mikroalbuminuri med A1c under 7 % |
|
The Action to Control Cardiovascular Risk in Diabetes (ACCORD)-undersøgelsen24 |
2 % reduktion i makroalbuminuri og 21 % reduktion i mikroalbuminuri med A1c under 7 % |
Epidemiologi. Mænd og kvinder rammes lige meget af DKD.20 Den højeste incidens for udvikling af DKD er 15 år efter diagnosen.21 Afroamerikanere har tre til fem gange større risiko for at udvikle diabetisk nefropati end kaukasiere.20 Mexikanske amerikanere og Pima-indianere har også en højere risiko for at udvikle DKD.20
Proteinuri er en prædiktor for kardiovaskulær morbiditet og dødelighed af alle årsager ved diabetes.21 Tilstedeværelsen af DKD er en faktor for øget risiko for kardiovaskulær sygdom. Patienter med DKD har konsekvent højere dødelighed af hjerte-kar-sygdomme.26 Desuden er dødeligheden af alle årsager højere hos patienter med DKD.21
I type 1-diabetes begynder mikrovaskulære komplikationer som DKD at udvikle sig ca. 10-20 år efter diagnosen; i type 2-diabetes er den nøjagtige begyndelse ofte ukendt og berettiger derfor til tidligere screening.27
Patofysiologi og patogenese. Hyperglykæmi menes at inducere tre vigtige histologiske ændringer i glomeruli, der fører til DKD: 1) mesangial ekspansion, 2) fortykkelse af glomerulær basalmembran og 3) glomerulær sklerose.28 Selv om den nøjagtige patogenese for, hvorfor DKD opstår, er ukendt, men det menes, at hyperglykæmi i første omgang forårsager hyperfiltrering og nyreskade som følge af histologiske ændringer og aktivering af cytokiner.20 Typisk kan albuminuri være det første tegn på DKD.29
Dette forværres yderligere som følge af komorbide tilstande som hyperlipidæmi, arteriosklerose, hypertension og fedme, som alle bidrager til nyreskader og efterfølgende funktionsnedgang. Central fedme fører til hypertension gennem hyperaktivering af renin-angiotensin-aldosteron-systemet og det sympatiske nervesystem.20 Endvidere sker der en øget progression af diabetisk nefropati, efterhånden som nyrernes vaskulatur bliver arteriosklerotisk. Et vigtigt kendetegn ved diabetisk nefropati sammenlignet med andre former for CKD er, at glomeruli og nyrer normalt er normale eller øgede i størrelse i begyndelsen.20
Klassifikation. Både eGFR og tilstedeværelsen af albuminuri anvendes til at stadieinddele CKD.30,31 eGFR er baseret på race, alder, køn, vægt og serumkreatininniveauer. (Se tabel 3.) Historisk set blev udtrykket mikroalbuminuri anvendt til at definere moderat forhøjede albuminniveauer. National Kidney Foundation anbefaler nu at bruge udtrykkene “mild”, “moderat” eller “stærkt forhøjet” til at beskrive albuminuri-niveauer baseret på de niveauer, der er vist i tabel 4.31 Albumin/kreatinin-forholdet er den første test, der bruges til at påvise albuminuri.
Tabel 3. Estimeret GFR med stadie og beskrivelse |
|||
|
Stadie |
GFR (mL/min pr. 1.73 m2) |
Beskrivelse |
|
|
90+ |
Glomerulær hyperfiltrering |
||
|
Mildt nedsat nyrefunktion |
|||
|
3A |
Moderat nedsat nyrefunktion |
||
|
3B |
|||
|
Svært nedsat nyrefunktion |
|||
|
< 15 eller på dialyse |
End-stadium nyresvigt |
||
Tabel 4. Albuminuriekategorier i CKD |
|||
|
Kategori |
Albumin-tilKreatininniveauer |
Beskrivelse |
|
|
A1 |
< 30 |
Normal til let forhøjet |
|
|
A2 |
Mådeligt øget |
||
|
A3 |
> 300 |
Svært øget |
|
De to klassifikationsskemaer repræsenterer den dobbelte vej til udvikling af CKD. Den ene er gennem forhøjelse af kreatinin og forværring af GFR. Den anden er gennem udvikling af albuminuri. Øget albuminuri følges ofte af et fald i eGFR;32 dette kan dog afværges ved brug af angiotensin-konverterende enzym (ACE)-hæmmere eller angiotensin-receptorblokkere (ARB’er) og glykæmisk kontrol. (Se figur 1.)
Figur 1. Foreslået evalueringshyppighed (antal gange om året) efter eGFR- og albuminuriekategori
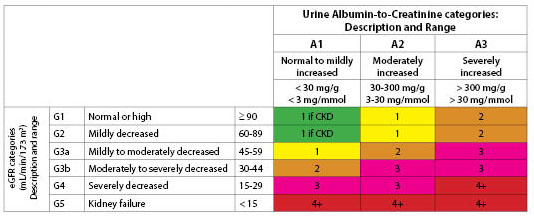
Udtrykt med tilladelse fra Kidney Disease: Forbedring af globale resultater (KDIGO).
Fælles symptomer. De fleste mennesker har ingen symptomer fra diabetisk nefropati. Ofte kan patienterne have tegn på eller diagnose af andre mikrovaskulære komplikationer.20 Tidlig DKD er typisk asymptomatisk. Et sent fund af DKD er skummende urin. Hvis en patient desuden er alvorligt hypoalbuminæmisk, kan han eller hun præsentere sig med pedalødem og træthed.20 Patienter med DKD har typisk systemisk hypertension. Patienter med diabetisk nefropati vil typisk også præsentere sig med retinopati og neuropati.8
Diagnostiske muligheder. Da der ikke er nogen symptomer, er rutinemæssig screening afgørende. ADA anbefaler årlig screening af et urinalbumin/kreatinin-forhold.8 Desuden bør eGFR testes mindst en gang om året hos patienter med type 1-diabetes med en varighed på fem år og blandt alle patienter med type 2-diabetes eller patienter med komorbid hypertension og diabetes.8 Der er ingen klar anbefaling for indhentning af billeddannelse, såsom ultralyd, til diagnosticering af DKD.
Differentialdiagnostik. Nogle røde flag kan tyde på, at diabetes ikke er den eneste årsag til CKD. Hvis en person har fremskreden CKD uden tegn på andre mikrovaskulære komplikationer, er dette en advarsel. Overtstående proteinuri med pludselig opstået (mindre end fem år efter indtræden af diabetes) af urinsediment med dysmorfiske røde blodlegemer og afstøbninger eller et pludseligt fald i GFR tyder på en nyresygdom af ikke-diabetisk ætiologi.20 Der kan foretages serum- eller urinelektroforese, hvis der er bekymring for multipel myelom. Fravær af albuminuri med nedsat eGFR og diabetes kræver undersøgelse for andre årsager til CKD end DKD.21 Tabel 5 indeholder en liste over røde flag, der tyder på en ikke-diabetisk glomerulær sygdom.
Tabel 5. Røde flag, der tyder på ikke-diabetisk glomerulær sygdom
- Debut af proteinuri < 5 år fra dokumenteret debut af type 1-diabetes eller akut debut af nyresygdom
- Akut fald i eGFR; diabetisk nefropati
- Urinsediment indeholdende dysmorfiske røde blodlegemer eller celleafstøbninger
- Afhængighed af andre mikrovaskulære komplikationer såsom neuropati eller retinopati
- Tegn på og/eller symptomer på en anden systemisk sygdom
Behandling. Et kendetegn ved diabetes nefropati er håndtering af glukose, saltreduktion, blodtryk og dyslipidæmi. Desuden bør patienterne undgå nefrotoksiske lægemidler og kosttilskud som f.eks. aminoglykosider og ikke-steroide antiinflammatoriske midler. Patienterne bør henvises til en nefrolog ved nyresygdom i stadie IV eller ved hurtigt faldende nyrefunktion. Andre indikationer for henvisning afhænger af sagens kompleksitet. Nyere orale lægemidler mod diabetes kan være med til at forebygge progressionen af nyresvigt.
Glykæmisk kontrol. Medicinvalg, overvågning og farmakologi er alle påvirket hos patienter med diabetisk nefropati. Efterhånden som en patients eGFR falder, vil nogle orale midler kræve dosisjustering. Insulin er fortsat den centrale behandling til glukosekontrol hos patienter med diabetes og fremskreden CKD.31 Tabel 6 viser de anbefalede dosisjusteringer for antiglykæmiske lægemidler hos patienter med nyresygdom. I 2016 blev det vist, at både empagliflozin og canagliflozin reducerede progression af CKD og mikroalbuminuri.33,34 Empagliflozin sænkede raterne af nefropatiprogression og reducerede risikoen for større negative kardiovaskulære hændelser sammenlignet med placebo, når det blev tilføjet til standardbehandling af type 2-diabetes i den skelsættende Empaglifliflozin Cardiovascular Outcome Event Trial in Type 2 Diabetes Mellitus Patients (EMPA-REG) outcome study.33
Tabel 6. Dosisjusteringer og anbefalinger for glukosesænkende midler hos patienter med nedsat nyrefunktion |
||
|
Glukose-sænkende midler |
Doseringsjusteringer ved nedsat nyrefunktion |
|
Klasse |
Medicinering |
|
|
Biguanider |
Metformin |
eGFR 30 til 45 mL/min/1.73 m2: Anbefales ikke til at indlede behandling. Hvis efter igangsættelse, vurder fordele/risici ved fortsat behandling. eGFR < 30 mL/min/1,73 m2: Anvendelse er kontraindiceret |
|
Sulfonylurinstoffer |
Glimepirid |
Mild til moderat nedsat funktionsevne: Indledes med 1 mg en gang dagligt Svært nedsat funktionsevne: Anvendelse er kontraindiceret |
|
Glipizid |
Glipizid |
Tilskud med forlænget frigivelse: Indledes med 2,5 mg en gang dagligt |
|
Glyburid |
eGFR < 60 mL/min/1,73 m2: Anvendelse anbefales ikke |
|
|
Meglitinider |
Nateglinid |
Nej dosisjustering nødvendig |
|
Repaglinid |
CrCl 20 til 40 mL/min: Indledes ved 0.5 mg med måltider CrCl < 20 mL/min: Ingen oplysninger |
|
|
Thiazolidinedioner |
Pioglitazon |
Ingen dosisjustering nødvendig |
|
Rosiglitazon |
Ingen dosisjustering nødvendig |
|
|
α-Glucosidasehæmmere |
Acarbose |
SCr > 2.0 mg/dL: Anvendelse anbefales ikke |
|
Miglitol |
CrCl < 25 mL/min eller SCr >2.0 mg/dL: Anvendelse anbefales ikke |
|
|
DPP-4-hæmmere |
Alogliptin |
CrCl 30 til 60 mL/min: 12.5 mg en gang dagligt CrCl < 30 mL/min: 6,25 mg en gang dagligt ESRD, der kræver hæmodialyse: 6.25 mg en gang dagligt og administreres uden hensyntagen til tidspunktet for hæmodialyse |
|
Linagliptin |
Ingen dosisjustering nødvendig |
|
|
Saxagliptin |
CrCl ≤ 50 mL/min: 2.5 mg en gang dagligt ESRD, der kræver hæmodialyse: 2.5 mg en gang dagligt og administreres efter hæmodialyse |
|
|
Sitagliptin |
CrCl 30 til 50 mL/min: 50 mg en gang dagligt CrCl < 30 mL/min: 25 mg en gang dagligt ESRD, der kræver hæmodialyse eller peritonealdialyse: 25 mg en gang dagligt og administreres uden hensyntagen til tidspunktet for hæmodialyse |
|
|
Vildagliptin |
CrCl < 50 mL/min: 50 mg en gang dagligt |
|
|
Galdesyre-sekvestranter |
Colesevelam |
Ingen dosisjusteringer nødvendige |
|
Dopamin-2-agonister |
Bromocriptin |
Ingen oplysninger |
|
SGLT-2-hæmmere |
Canagliflozin |
eGFR 45 til 60 mL/min/1.73 m2: Må ikke overskride 100 mg én gang dagligt eGFR < 45 mL/min/1,73 m2: Ikke anbefalet at indlede behandling. Hvis efter initiering, seponeres behandlingen for patienter med eGFR vedvarende < 45 mL/min/1,73 m2. eGFR < 30 mL/min/1,73 m2/ESRD/Hemodialyse: Anvendelse er kontraindiceret |
|
Dapagliflozin |
eGFR < 60 mL/min/1,73 m2: Anbefales ikke til at indlede behandling. Hvis efter initiering, seponeres behandlingen for patienter med eGFR vedvarende mellem 30 og < 60 mL/min/1,73 m2. eGFR < 30 mL/min/1,73 m2/ESRD/Hemodialyse: Anvendelse er kontraindiceret |
|
|
Empagliflozin |
eGFR < 45 mL/min/1,73 m2: Anbefales ikke til at indlede behandling. Hvis efter initiering, seponeres behandlingen for patienter med eGFR vedvarende < 45 mL/min/1,73 m2. eGFR < 30 mL/min/1,73 m2. ESRD/ hæmodialyse: Anvendelse er kontraindiceret |
|
|
GLP-1-receptoragonister |
Albiglutid |
Ingen dosisjustering nødvendig |
|
Dulaglutid |
Ingen dosisjustering nødvendig |
|
|
Exenatid |
CrCl 30 til 50 mL/min: Ingen oplysninger. Anvendes med forsigtighed. CrCl < 30 mL/min/ ESRD: Anvendelse anbefales ikke |
|
|
Liraglutid |
Ingen oplysninger |
|
|
Lixisenatid |
eGFR 15 til 29 mL/min/1.73 m2: Ingen oplysninger. Overvåg for øgede negative GI-effekter, som kan føre til dehydrering og forværring af nyrefunktionen. eGFR <15 mL/min/1.73 m2/ ESRD: Anvendelse anbefales ikke |
|
|
Amylin-mimetika |
Pramlintid |
CrCl ≥15 mL/min: Ingen dosisjustering nødvendig ESRD: Ingen oplysninger |
|
Insuliner |
Rapid-virkende analoger
Kortvirkende
Intermediær-virkende
Basale insulinanaloger
|
Insulinbehovet kan være reduceret på grund af ændringer i insulinclearance eller metabolisme. Overvåg blodglukose nøje. |
Blodtryk. Behandlingen af blodtrykket bør begynde ved 140/90 mmHg for patienter med diabetes og diabetisk nyresygdom.37 I United Kingdom Prospective Diabetes Study (UKPDS) blev der fundet en reduktion på 12 % af risikoen for diabetiske komplikationer for hvert fald på 10 mmHg i systolisk tryk, indtil trykket var 120 mmHg.38 De foretrukne lægemidler er fortsat ACE-hæmmere eller ARB’er til personer med hypertension og diabetes, DKD og CKD. ACE-hæmning har vist sig at forsinke udviklingen af DKD, når den iværksættes hos patienter med let forhøjet albuminuria. Kreatinin kan stige med op til 30 % ved iværksættelse af en ACE-hæmmer eller ARB.39 Overvej at evaluere for andre underliggende nyresygdomme, hvis kreatininen stiger mere end dette.
KDOQI anbefaler ikke at give ACE/ARB’er til type 2-diabetespatienter, som er normotensive og normoalbuminuriske patienter.40,41,42 ACE-hæmmere eller ARB’er anbefales til diabetespatienter, der er normotensive med mikroalbuminuri.31,37 Der er ingen specifik dosis eller titrering for disse personer. Dobbelt blokade af renin-angiotensinsystemet med både ACE og ARB’er anbefales ikke på grund af den øgede risiko for hyperkaliæmi, nedsat nyrefunktion og hypotension.43
Saltreduktion. 2012 Reduction of Endpoints in Non-insulin-dependent diabetes mellitus with the Angiotensin II Antagonist Losartan (RENAAL) Trial (2012) og Irbesartan Diabetic Nephropathy Trial (IDNT) viste, at diæter med lavt natriumindhold øgede de nefrobeskyttende og kardioprotektive virkninger af ARB’er hos patienter med type 2-diabetes og diabetisk nefropati.44,45
Renaldialyse og nyretransplantation. Patienter med ESRD bør henvises til nefrologi. Mulighederne for behandling omfatter peritonealdialyse eller hæmodialyse, nyretransport eller muligheden for at stoppe behandlingen og påbegynde palliativ eller hospicepleje. En observationsundersøgelse viste, at patienter, der påbegyndte dialyse i en yngre alder (< 60 år), havde dårligere overlevelse.46
Overvisning. Figur 1 omfatter indikationer for henvisning baseret på GFR- og albuminuria-klassifikation. Overvej andre årsager til nyresygdom, der ikke er relateret til diabetes, især hos patienter med type 1-diabetes, hvor indtræden af retinopati ikke går forud for udvikling af nefropati.21 Nefrologer kan hjælpe med at afklare diagnosen, kontrollere resistent hypertension og hyperkaliæmi og forberede patienterne til dialyse.8
Man skal også overveje, at udviklingen af nefropati måske ikke er relateret til selve diabetessygdommen. Hos patienter med type 1-diabetes går retinopati normalt forud for udviklingen af nefropati.47 En person, der præsenterer sig med nefropati, men ingen retinopati, bør få foretaget en vurdering for andre årsager. Der bør henvises til en nefrolog for at fastslå årsagen til nefropati, når det er usikkert, eller når der er svært håndterbare, DKD-relaterede problemer, herunder anæmi, hyperparathyroidisme og fremadskridende nyresygdom med en eGFR < 30 mL/min/1,73 m2.8 At have en rådgivende nefrolog, når der udvikles CKD i fase 4 (eGFR < 30 mL/min/1,73 m2), er forbundet med mindre sygelighed, færre sundhedsudgifter og forsinket dialyse.48 Overvej en henvisning ved stadie 3B for at forberede patienterne tidligere og for at nefrologien kan behandle maksimalt medicinsk.
Kliniske perler
- Årlig DKD-screening for DKD bør ske gennem urinalbumintest og en måling af eGFR.
- Blodtryks- og glukosekontrol kan give forebyggelse af nefropathiprogression. Oprethold blodtrykket < 140/90 mmHg hos patienter med diabetes og CKD. ACE-hæmmere eller ARB’er bør være den foretrukne behandling.
- ACE-hæmmere og ARB’er bør ikke anvendes til at forebygge nefropati, hvis blodtryk og proteinudskillelse er normale. ACE-hæmmere og ARB’er bør ikke anvendes i kombination.
- Patienter med CKD stadie 3-5 har en øget risiko for hypoglykæmi. Der bør udvises forsigtighed med orale midler som f.eks. sulfonylurinstoffer.
- I nogle patienter med CKD er det hensigtsmæssigt at fastsætte målet for HbA1c > 7%, især når risikoen for hypoglykæmi er stor.
Diabetisk perifer neuropati
En bredt accepteret definition af diabetisk perifer neuropati (DPN) i klinisk praksis er “tilstedeværelsen af symptomer og/eller tegn på perifer nervedysfunktion hos personer med diabetes efter udelukkelse af andre årsager”.”49 ADA-klassifikationen af distal symmetrisk polyneuropati er: 1) primært småfibret neuropati, 2) primært storfibret neuropati og 3) blandet små- og storfibret neuropati (mest almindeligt).
Patofysiologi og patogenese. Udviklingen og progressionen af DPN skyldes de komplekse forhold mellem nerverne og de omkringliggende celler.50 Både vaskulære faktorer og metaboliske interaktioner bidrager til alle stadier af DPN.51 Den generelt accepterede forståelse i human diabetes, der fører til udvikling af DPN, er det komplekse samspil mellem hyperglykæmi, diabetesens varighed, aldersrelaterede neuronale skader, graden af blodtryks- og blodlipidkontrol og vægt.52,53,54,55 Hyperglykæmi aktiverer adskillige biokemiske veje, der bestemmer en nervecelles metaboliske tilstand og kombineres med nedsat nerveperfusion, hvilket bidrager til progressionen af neuropatier. Et skelsættende forsøg, DCCT, understøtter betydningen af hyperglykæmi i patogenesen af neuropati.10,56,57 En anden hyperglykæmi-relateret mekanisme, der fører til DPN, er hyperglykæmi-induceret oxidativ og nitrosativ stress med en stigning i produktionen af frie radikaler.58,59
I tillæg til hyperglykæmi er det for nylig blevet foreslået, at lavgradsinflammation muligvis spiller en vigtig rolle i patogenesen af diabetiske neuropatier, hvilket fører til underskud i perifere og autonome nervefibre.51,60 Den komplekse række af metaboliske og vaskulære faktorer udløser ubalancen mellem skader og reparationer i nervefibre, hvilket specifikt påvirker distale sensoriske fibre og bidrager til det gradvise tab af følelse, der manifesterer de kliniske symptomer på diabetisk polyneuropati.58,61
Fælles symptomer. Når man spørger om de oplevede symptomer på DPN, skal man notere sig placeringen (mest sandsynligt mærket i hænder og fødder), udløsende faktorer, karakteristika ved generne samt indtræden og hyppighed af natlig forværring, da symptomerne er patientspecifikke.4 Både små og store fibre påvirkes af forhøjet blodglukose, og de oplevede symptomer varierer afhængigt af den klasse af sensoriske fibre, der er påvirket. Når de påvirkede nervefibre overvejende er små, er de udløste symptomer normalt smerter (stikkende, lancinerende, prikkende, brændende, smertende, kedelige og overdrevent følsomme), dysæstesier (ubehagelige fornemmelser af brændende, prikkende, prikkende og stikkende) og følelsesløshed4 .
Intensiteten af ubehaget kan variere fra at føle mindre unormale fornemmelser til at være handicappet af smerterne, der kan forværres om natten og forstyrre søvnen, hvilket har vist sig at være forbundet med depression på grund af en opfattelse af nedsat livskvalitet4 .
På den anden side kan patienterne, når de store fibre overvejende er påvirket, føle følelsesløshed og prikken i deres ekstremiteter, opleve ustabil gang og miste balancen (hvilket fører til potentielle fald).4 Nogle patienter kan opleve en forværring af symptomerne, når deres blodsukkerniveau falder som følge af intensiveret terapeutisk behandling af diabetes. Patienterne kan være asymptomatiske, men med forskellige grader af sensorisk tab; et uønsket resultat af alvorligt sensorisk tab som følge af diabetisk neuropati kan være smertefri skade, hvilket fører til en øget risiko for fodsår eller i alvorlige tilfælde til amputation.62
Den mest almindelige form for diabetisk perifer neuropati er distal symmetrisk polyneuropati med et progressivt tab af sensoriske nervefibre.4 Det typiske “strømpe”-mønster bilateralt skabes af de skader, der opstår på de mest distale dele af de længste nerver (som rammes først).63,64,65 Efterhånden som tiden skrider frem, opstår der et “strømpehandske”-mønster, der fremmer sensorisk tab og typiske symptomer på DNP, fra proximalt forløb af nerveunderskud.4
Klinisk diagnose. En klinisk diagnose af DPN kan stilles på baggrund af neuropatiske tegn og symptomer hos en patient med diabetes efter udelukkelse af andre årsager til neuropati.66 Asymptomatisk diabetisk perifer neuropati kan forekomme hos op til 50 % af dem, der har denne komplikation; derfor er det vigtigt at gennemføre forebyggende fodpleje, især for dem, der er i høj risiko for skader på grund af følelsesløse fødder.4 Årlig screening for DPN bør udføres hos alle patienter med diabetes ved hjælp af pinprick, temperatur, vibrationsfornemmelse (ved hjælp af en 128 Hz-stemmegaffel), 10-g monofilament trykfornemmelse og ankel dybe senereflekser; potentielle fodsår kan forudsiges ved et tab af 10-g monofilament fornemmelse (tab af beskyttende fornemmelse) og en reduceret vibrationsfornemmelse.63 ADA’s Standards of Medical Care in Diabetes-2017 anbefaler fortsat en årlig 10-g monofilamenttest med henblik på at identificere patienter med risiko for udvikling af sårdannelse og amputation.8 Desuden anbefaler ADA’s 2017-retningslinjerne screening for DPN ved diagnosticering af type 2-diabetes og fem år efter diagnosticering af type 1-diabetes.8
I 2009 opdaterede Toronto Consensus Panel on Diabetic Neuropathies de diagnostiske kriterier for at give diagnostiske kategorier. Derudover kan flere velvaliderede screeningsinstrumenter inddrages af sundhedspersoner i diagnosticeringsprocessen, herunder Michigan Neuropathy Screening Instrument (MNSI), Toronto Clinical Neuropathy Score og Utah Neuropathy Scale. Tabel 7 beskriver andre årsager til neuropati, der bør udelukkes.
Tabel 7. Andre årsager til neuropati67
- Alkohol eller andre toksiner
- Neurotoksiske lægemidler, især kemoterapi
- Vitamin B12-mangel
- Hypothyroidisme
- Renal sygdom
- Maligniteter (multipel myelom, bronkogenisk karcinom)
- Human immundefektvirus (HIV)
- Kronisk inflammatorisk demyeliniserende neuropati, arvelige neuropatier og vaskulitis
Diagnostiske undersøgelser. Der findes flere diagnostiske undersøgelser til at bekræfte tilstedeværelsen af DPN. Nerveledningsundersøgelser har i årevis været anset for at være den diagnostiske guldstandardtest for DPN på grund af deres objektive målinger uden patienternes reaktioner, hvilket fører til høj pålidelighed.4 Kvantitativ sensorisk testning evaluerer patienternes evne til at registrere let berøring, vibrationer og temperaturdiskrimination, hvilket indebærer en vis grad af subjektivitet.4 Andre metoder, herunder hudbiopsi og intraepidermal nervefiberdensitet og korneal konfokal mikroskopi, er ikke blevet anvendt rutinemæssigt i klinisk praksis, men kan anvendes i kliniske forsøg.4
Behandlingsmuligheder: Farmakologisk behandling. Den farmakologiske behandling af DPN er til symptomatisk forbedring, så den anvendte medicin har ikke til formål at forhindre progression. Tabel 8 opsummerer medicin fra de tre mest almindeligt anvendte klasser (antikonvulsiva, antidepressiva og opioider) til at kontrollere neuropatiske symptomer. Selv om flere midler almindeligvis anvendes som den indledende tilgang til DPN-behandling, er kun pregabalin og duloxetin blevet FDA-godkendt til behandling af denne tilstand; derfor anbefales et af disse midler som det indledende valg til symptomatiske neuropatiske smerter.4 Gabapentin, selv om det ikke er FDA-godkendt til brug i forbindelse med DPN-behandling, anvendes ofte som en indledende tilgang, som har en sammenlignelig effektivitet med de FDA-godkendte midler. Tricykliske antidepressiva (f.eks. amitriptylin) – ikke-FDA-godkendte DPN-midler – er effektive til håndtering af DPN, men de bør anvendes med forsigtighed på grund af en højere risiko for bivirkninger.
Tabel 8. Almindeligt anvendte farmakologiske midler til DPN4,69 |
|||||
|
Farmaceutisk middel (NNT-interval 30-50 % forbedring*) |
Maksimal daglig dosis for DNP (mg/dag) |
Falmindelige bivirkninger |
Nødvendig dosisjustering? |
Kontraindikationer |
Overvejelser i forbindelse med ordination |
|
Anticonvulsiva
|
|||||
|
Pregabalin (3.3-8.3) |
Svimmelhed Somnolens Vægtøgning Perifere ødemer Sløret syn Forstoppelse |
Renalt: Ja Hepatisk: Nej |
Overfølsomhed over for pregabalin |
Stærk evidens; FDA godkendt; kontrolleret stof |
|
|
Gabapentin (3.3-7.2) |
3,600 |
Svimmelhed Ataxi Somnolens Hovedpine Nausea Diarré Vægtøgning |
Renal: Ja Hepatisk: Nej |
Overfølsomhed over for gabapentin |
Moderat evidens; ikke FDA-godkendt |
|
Antidepressiva
|
|||||
|
Amitriptylin (2.1-4.2) |
Svær sedation; konfusion; anticholinergiske virkninger (obstipation, sløret syn) |
Renal: Nej Hepatisk: Nej Lavere doser anbefales til ældre patienter |
Hypersensitivitet over for amitriptylin; samtidig administration sammen med eller inden for 14 dage efter MAO’er; samtidig administration sammen med cisaprid; akut genopretningsfase efter myokardieinfarkt |
Moderat evidens; ikke FDA-godkendt; anvendes med forsigtighed til personer med en fortid med kardiovaskulær sygdom |
|
|
Duloxetin (3.8-11) |
(U.S.A.) |
Nausea; sedation; generaliseret søvnighed |
Renal: Ja Hepatisk: Undgå brug ved leverinsufficiens |
Hypersensitivitet; samtidig administration sammen med eller inden for 14 dage efter MAO’er; iværksættelse hos dem, der modtager linezolid eller IV methylenblåt |
Moderat evidens; FDA godkendt; må tilsættes til pregabalin eller gabapentin |
|
Venlafaxin (5.2-8.4) |
Nausea; sedation; generaliseret søvnighed |
Renal: Ja Hepatisk: Ja |
svag evidens; ikke FDA-godkendt; kan tilføjes til gabapentin |
||
|
Opioider
|
|||||
|
Tramadol (2.1-6.4) |
Somnolens Nausea Opkastninger Konstipation Let hovedløshed Svimmelhed Svimmelhed Hovedpine |
Renal: Ja Hepatisk: Ja Hepatisk: Nej |
Overfølsomhed over for tramadol, opioider eller nogen komponent i formuleringen; ER-formulering: Betydelig åndedrætsdepression og akut eller alvorlig astma; IR-formulering: Akut forgiftning med alkohol, hypnotika, narkotiske midler, centralt virkende analgetika, opioider eller psykotrope lægemidler |
Mindre potentiale for misbrug (Schedule IV kontrolleret stof); ikke anbefalet til brug som første- eller andenlinjemiddel |
|
|
Tapentadol (N/A) |
Immedieret frigivelse: Forlænget frigivelse: |
Somnolens Nausea Kaster op Konstipation Svimmelhed |
Renal: Anvendelse anbefales ikke, når Hepatisk: Nej |
Overfølsomhed over for tapentadol; betydelig respirationsdepression; akut eller svær astma; paralytisk ileus; inden for 14 dage efter brug af MAO-hæmmere |
FDA godkendt; kontrolleret stof i liste II; ikke anbefalet til brug som første- eller andenlinjemiddel |
|
Informationer vedrører farmaceutiske midler hentet fra respektive indlægssedler (refereret ved handelsnavne) |
|||||
Den amerikanske akademi for neurologi (AAN) guideline anbefaler følgende topiske midler: capsaicin og isosorbiddinitrat spray (moderat evidens) og Lidoderm plaster (svag evidens).69 Oxcarbazepin, lamotrigin, lacosamid, clonidin, pentoxifyllin og mexiletin anbefales ikke i AAN-retningslinjen til behandling af DPN.69
Dertil kommer, at opioider af nogle er blevet anbefalet til brug ved refraktær DPN. De opioider, der anbefales i AAN-retningslinjen, omfatter dextromethorphan (400 mg/dag), morfin sulfat (titreret til 120 mg/dag) og oxycodon (gennemsnit 37 mg/dag, max 120 mg/dag); der er dog ikke tilstrækkelige data til at foreslå brug af det ene middel frem for det andet.69 Forfatterne til denne artikel anbefaler kun brug af opioider i alvorlige refraktære tilfælde med nøje overvågning af patienter, der opnår en reel funktionel forbedring af opioider. Forfatterne følger den positionserklæring fra 2016 fra Centers for Disease Control and Prevention om, at opioider har begrænset langtidsbrug ved smerter af ikke-cancertypen.70
En af udfordringerne ved farmakologisk behandling af DPN er utilstrækkelige head-to-head-undersøgelser, der inddrager livskvalitetsresultater.4 En nylig undersøgelse, der sammenlignede en otte ugers behandling blandt højdosis pregabalin, højdosis duloxetin eller i en kombination, fandt ingen signifikante forskelle i den gennemsnitlige smerteændring mellem monoterapi og kombinationsbehandling.71 Der er behov for flere undersøgelser, der sammenligner to aktive midler, for at give indsigt i at forbedre behandlingen af dem, der lider af diabetisk perifer neuropati.
Nonfarmakologisk behandling. Procedurer. ANN-retningslinjen foreslår, at man overvejer perkutan elektrisk nervestimulering i tre til fire uger til behandling af DPN.69 Et pilotforsøg med to akupunkturformer, randomiseret, kontrolleret forsøg72 og et enkeltblindet, placebokontrolleret, randomiseret forsøg73 , der evaluerede effektiviteten af akupunktur i DPN, viste begge forbedringer i resultatmål i forbindelse med smerte. Der er dog behov for yderligere undersøgelser for at bekræfte akupunkturens rolle i behandlingen af DPN.
Alpha-liponsyre. Noget tyder på, at brugen af antioxidanten alfa-liponsyre kan bidrage til at reducere fritradikalmedieret oxidativt stress og give følgende fordele: målretning af patogenesen, bremsning af udviklingen og forbedring af symptomerne på DPN.74,75
Forebyggelse. Livsstilsændringer, med fokus på sund kost og fysisk aktivitet, har løbende vist sig at mindske forekomsten af diabetes og dens komplikationer, herunder diabetisk perifer neuropati.68 Intensiv glykæmisk kontrol har vist sig at bidrage til at sænke risikoen for diabetisk neuropati hos patienter med diabetes ved at forbedre nervefunktionen.61,76,77 DCCT fastslog den rolle, som glykæmisk kontrol spiller for forebyggelse og ophør af diabetisk neuropatiprogression ved type 1-diabetes.10,56
Kliniske perler
- Op til 50 % af patienterne kan have smertefri eller asymptomatisk perifer neuropati.
- Patienter med neuropati anbefales at modtage fodplejeuddannelse (daglig selvinspektion af fødderne) og regelmæssig fodterapeutisk pleje for udvalgte patienter.
- Patienter med DPN, der udviser tegn på tab af beskyttende fornemmelse med eller uden deformitet, bør rådes til at følge op hos en læge hver tredje til sjette måned med henblik på forebyggende foranstaltninger.64
- For effektivt at håndtere symptomer på DPN bliver en tværfaglig tilgang afgørende; denne omfattende tilgang kan omfatte farmakologisk, psykologisk og/eller fysisk terapi.
- En ny udtalelse om diabetisk neuropati, der er offentliggjort af ADA, anbefaler screening for DPN hos patienter med prædiabetes, der udviser symptomer på perifer neuropati.4
- Specialiseret pleje er nødvendig for personer med perifer sygdom, ikke-sensorisk neuropati eller Charcot-fod.
Gastroparese
En anden form for diabetesneuropati er gastroparese. Denne tilstand er forbundet med øvre gastrointestinale symptomer, herunder kvalme, opkastning, tidlig mæthed eller postprandial mæthed, mavesmerter og oppustethed, men i fravær af udgangsobstruktion. Selv om der er en række årsager til gastroparese, er det blevet anslået, at diabetes tegner sig for omkring en tredjedel af alle tilfælde.78
Patofysiologi. Foreslåede patofysiologiske mekanismer for diabetisk gastroparese omfatter nedsat glykæmisk kontrol, vagal eller prævertebral sympatiske ganglier neuropati, abnormiteter i interstitielle celler af Cajal, tab af nitrogenoxidsyntase og muligvis myopati.79,80
Klinisk præsentation. Tidligt i denne tilstand er patienterne normalt asymptomatiske. Der er ikke et lineært forhold mellem symptomer og neuropatiens sværhedsgrad. Den store variation i symptomerne gør det svært at diagnosticere tilstanden. Andre kliniske præsentationer omfatter anoreksi, underernæring, vægttab og hypoglykæmi som følge af misforholdet mellem absorption af mad og insulin. Smerter kan faktisk være underrapporterede, men betydelige for mange mennesker. I et NIH-finansieret konsortium havde 72 % af patienterne med gastroparese abdominalsmerter.81 Dette var det dominerende symptom hos 18 % af disse patienter. Smerter blev fremkaldt af at spise (72 %), var natlige (74 %) og forstyrrede søvnen (66 %) for disse patienter.81
Hvor almindeligt er diabetes gastroparese? Den kumulative 10-årige forekomst af gastroparese er blevet anslået til 5,2 % ved type 1-diabetes og 1 % ved type 2-diabetes blandt samfundspatienter med diabetes82 . Andre undersøgelser har fundet rater på mellem 5-12 %.83,84 Raterne er dog meget højere, når diagnosen er baseret på symptomer snarere end på mavetømningsundersøgelsen.
Gastroparese er mere almindelig ved type 1-diabetes end type 2-diabetes, og den ses oftest, efter at personen har haft diabetes i mere end 10 år og har udviklet de andre mikrovaskulære komplikationer retinopati, nefropati og perifer neuropati. Hvis en patient præsenterer gastroparese tidligere end forventet, bør andre ætiologier undersøges, oftest perioperativ vagal nerveskade eller farmakologiske virkninger af inkretinbaserede midler – glukagonlignende peptid-1-receptoragonister (GLP-1RA) og dipeptidyl-peptidase 4-hæmmere (DPP-4-hæmmere).
Når en patient udvikler symptomer fra gastroparese, fortsætter symptomerne typisk og er stabile i løbet af 12-25 år. Dette gælder, selv om der sker en forbedret glukosekontrol,85 undtagen i tilfælde af en bugspytkirtel- og nyretransplantation.86 Selv om der ikke er nogen klare beviser for, at gastroparese i sig selv øger dødeligheden, reducerer den væsentligt alle aspekter af livskvaliteten.87
Diagnostik. En række tests kan hjælpe med at stille diagnosen. Guldstandarden til denne diagnose er gastroøsofageal scintigrafi. Den er ikke-invasiv, tester fysiologien og giver kvantitative resultater. Gastroparese kan diagnosticeres, hvis der er mindst 35 % tilbageholdelse af et standardmåltid med lavt fedtindhold fire timer efter indtagelse.80
For at give de mest nøjagtige testresultater bør protokollen før testen omfatte ophør af alle motilitetsændrende medicin i mindst to til tre dage før testen, herunder prokinetika, opiater og anticholinergika. Inkretinstoffer, såsom GLP-1-agonister og DPP-4-hæmmere, bør også stoppes, da de er kendt for at forsinke gastrisk tømning. Hyperglykæmi har også vist sig at forsinke gastrisk tømning, og glukosen bør være under 275 mg/dL, inden undersøgelsen påbegyndes.79,88
Patienterne bør afholde sig fra at ryge og indtage alkohol på testdagen, da begge dele kan forsinke den gastroøsofageale tømning.89 Desuden kan GLP-1RA’er forværre gastroparese, fordi de forsinker gastrisk tømning. Endvidere kan nogle personer have subklinisk gastroparese, som afdækkes, når der startes med et GLP-1RA.
Behandling. Behandlingen af gastroparese afhænger i høj grad af symptomernes sværhedsgrad. De generelle principper for behandling omfatter understøttende behandlinger (væske, elektrolytter, glukosekontrol og ernæring), medicinske behandlinger (prokinetika, antiemetika og smertelindring) og invasive behandlinger (kirurgi, Botox-injektioner, gastric pacing eller elektrisk stimulering).79
Supportiv behandling påbegyndes normalt på hospitalet og fokuserer på normalisering af væske-, elektrolyt- og ernæringsforstyrrelser. Når der gives ernæringsmæssig støtte, foretrækkes enteral ernæring frem for parenteral ernæring, da det er mere fysiologisk og kan bidrage til at opretholde tarmfloraen. Endvidere kan kostændringer være meget nyttige ved gastroparese. Fiberfattige, fedtfattige og residufattige diæter anbefales til patienter med gastroparese.85 Fiberrige diæter kan øge symptomerne, da de kræver mere fordøjelse.
Medicinering. Prokinetika: I USA er metoclopramid og erythromycin de mest almindeligt anvendte lægemidler til behandling af gastroparese. Metoclopramid har dog en sort boks advarsel på grund af risikoen for tardive dyskinesi. Udviklingen af denne tilstand er direkte relateret til varigheden af brugen af metoclopramid og antallet af indtagne doser. Når man bruger denne medicin, er det bedst kun at bruge den til symptomatiske patienter og starte med den laveste effektive dosis 15 minutter før måltider. Medicinferier kan undertiden bidrage til at forlænge varigheden af virkningerne.90
Domperidon er en mere selektiv dopaminagonist, som er lige så effektiv som metoclopramid, men har færre bivirkninger ved centralnervesystemet.91
Antiemetika: Antiemetika kan bruges til at hjælpe med symptomerne. Risikoen for lægemiddelinteraktioner er dog betydelig og bør overvåges nøje.
Smertebehandling kan være en udfordring hos patienter med gastroparese. Tricykliske antidepressiva anvendes ofte som førstevalg til behandling af smerter ved gastroparese. Andetlinjestrategier er den svage mu-opioidreceptoragonist, tramadol, som også frigiver serotonin og hæmmer genoptagelsen af noradrenalin, og gamma-aminobuttersyreanalogen, gabapentin. Det anbefales dog ikke at bruge narkotiske midler ved gastroparese, da det kan bidrage til forstoppelse og forværring af symptomerne.
Invasive behandlinger: Botox-injektioner anvendes almindeligvis til behandling af gastroparese, men brugen af dem er ikke understøttet af kliniske forsøg.92,93
Den gastriske elektriske stimuleringsanordning blev FDA-godkendt under en humanitær anordningsundtagelse i 2000.94 Den gastriske elektriske stimuleringsanordning leverer højfrekvent, lav-energi elektrisk stimulering til maven. Den er mere nyttig ved diabetisk gastroparese end ved idiopatisk gastroparese. En metaanalyse viste betydelige fordele med hensyn til patienternes symptomer. Den nøjagtige mekanisme for fordelene er stadig ukendt.95 Det er blevet foreslået, at elektrisk stimulering af maven resulterer i ændringer i de centrale mekanismer, der kontrollerer kvalme og opkastning, øger den vagale funktion og resulterer i nedsat følsomhed over for distension.97 Patienter, der reagerer godt, reagerer typisk hurtigt. Dette har fået nogle til at anbefale et forsøg med midlertidig elektrodeplacering først før langtidsimplementering.
Kliniske perler
- Diabetisk gastroparese er mere almindelig hos personer med langvarig diabetes og personer med andre mikrovaskulære komplikationer.
- Guldstandarddiagnosen for gastroparese er gastroøsofageal scintigrafi.
- Der anbefales fiberfattig, fedtfattig og residufattig diæt ved diabetisk gastroparese.
- Pharmakologiske og interventionelle behandlinger har begrænsede fordele og betydelig risiko på lang sigt.
Diabetisk cheiroarthropati
En af de mindre kendte diabeteskomplikationer er cheiroarthropati. Denne tilstand er karakteriseret ved begrænset ledbevægelighed på grund af fortykkelse af huden hos personer med langvarig diabetes. Det var sandsynligvis den første komplikation, der blev identificeret i forbindelse med type 1-diabetes. Prævalensen varierer meget fra 8-50 %.98
Cheiroarthropati menes at være forårsaget af glykosylering og krydsbinding af kollagen. Den kan påvirke huden og senerne og kan resultere i begrænset ledbevægelighed, oftest forlængelse af fingrene, stivhed og smerter. Det klassiske tegn ved fysisk undersøgelse for diabetisk cheiropati er “bedetegn”. Ved denne tilstand er en person ikke i stand til at flade sine hænder helt ud for at “bede”, hvilket efterlader et hul mellem fingrene i venstre og højre hånd. Der er dokumentation for, at personer, der udvikler cheiropati, har en tre gange større risiko for mikrovaskulære komplikationer.99
Diabetisk cheiropati er typisk værre hos personer med langvarig eller dårligt kontrolleret glykæmi. Heldigvis oplever mange mennesker lindring af symptomer og forbedret mobilitet, når glukosekontrollen forbedres.100
Konklusion
Håndtering af diabeteskomplikationer kræver et tværfagligt team. Tidlig screening af retinopati, nefropati og neuropati er vigtig på grund af sygdommens asymptomatiske karakter. Kendetegnende for diabetesbehandling for alle komplikationer er fortsat glykæmisk kontrol og blodtrykskontrol.
- American Diabetes Association. Omkostninger ved diabetes. Tilgængelig på: http://www.diabetes.org/advocacy/news-events/cost-of-diabetes.html?referrer=https://www.google.com/. Opdateret den 22. juni 2015. Tilgået den 8. februar 2017.
- UK Prospective Diabetes Study Group. Intensiv blodglukosekontrol med sulfonylurinstoffer eller insulin sammenlignet med konventionel behandling og risiko for komplikationer hos patienter med type 2-diabetes. Lancet 1998;352;352:837-853.
- Gregg EW, Yanfed L, Wang J. Changes in diabetes-related complications in the United States, 1990-2010. N Engl J Med 2014;370;370:1514-1523.
- Pop-Busui R, Boulton A, Feldman E, et al. Diabetes neuropati: En udtalelse fra den amerikanske diabetesforening. Diabetes Care 2017;40:136-154.
- Leasher JL, Bourne RR, Flaxman SR, et al. Globale skøn over antallet af personer, der er blinde eller synshandicappede på grund af diabetisk retinopati: En metaanalyse fra 1990 til 2010. Diabetes Care 2016;39;39:1643-1649.
- National Eye Institute. Fakta om diabetisk øjensygdom. Tilgængelig på: https://nei.nih.gov/health/diabetic/retinopathy. Opdateret sept. 2015. Tilgået 8. februar 2017.
- Fong, DS, Aiello L, Gardner TW, et al. Retinopathy in diabetes. Diabetes Care 2004;27(Suppl 1):S84-S87.
- American Diabetes Association. Standards of Medical Care in Diabetes-2017. Diabetes Care 2017;40:(Suppl 1):S4-S5.
- Doggen K, Nobels F, Scheen AJ, et al. Kardiovaskulære risikofaktorer og komplikationer forbundet med albuminuri og nedsat nyrefunktion ved insulinbehandlet diabetes. J Diabetes Complications 2013;27;27:370-375.
- The Diabetes Control and Complications Trial Research Group. Effekten af intensiv behandling af diabetes på udvikling og progression af langtidskomplikationer hos insulinafhængig diabetes mellitus. N Engl J Med 1993;329:977-986.
- Action to Control Cardiovascular Risk in Diabetes Follow-On (ACCORDION) Eye Study Group og the Action to Control Cardiovascular Risk in Diabetes Follow-On (ACCORDION) Study Group. Vedvarende virkninger af intensiv glykæmisk kontrol på retinopati ved type 2-diabetes i Action to Control Cardiovascular Risk in Diabetes (ACCORDORD) follow-on study. Diabetes Care 2016;39:1089-1100.
- ACCORD Study Group, ACCORD Eye Study Group, Chew EY, et al. Effekter af medicinske behandlinger på retinopati-progressionen i type 2-diabetes. N Engl J Med 2010;363:233-244.
- Chew EY, Davis MD, Danis RP, et al. Virkningerne af medicinsk behandling på progressionen af diabetisk retinopati hos personer med type 2-diabetes: Action to Control Cardiovascular Risk in Diabetes (ACCORD) Eye Study. Ophthalmology 2014;121;121:2443-2451.
- Diabetes Control and Complications Trial Research Group. Effekt af graviditet på mikrovaskulære komplikationer i Diabetes Control and Complications Trial. Diabetes Care 2000;23:1084-1091.
- Colberg SR, Sigal RJ, Yardley JE, et al. Fysisk aktivitet/motion og diabetes: En udtalelse fra den amerikanske diabetesforening. Diabetes Care 2016;39;39:2065-2079.
- The Diabetic Retinopathy Study Research Group. Foreløbig rapport om virkningerne af fotokoagulationsbehandling. Am J Ophthalmol 1976;81:383-396.
- Early Treatment Diabetic Retinopathy Study Research Group. Fotokoagulation ved diabetisk makulaødem: Early Treatment Diabetic Retinopathy Study report number 1. Arch Ophthalmol 1985;103:1796-1806.
- Nguyen QD, Brown DM, Marcus DM, et al. Ranibizumab for diabetic macular edema: Resultater fra 2 randomiserede fase III-forsøg: RISE og RIDE. Ophthalmology 2012;119;119:789-801.
- Wong TY, Cheung CMG, Larsen M, et al. diabetisk retinopati. Nat Rev Disease Prim doi:10.1038/nrdp.2016.12; offentliggjort online 17. marts 2016.
- Batuman V, Soman AS, Schmidt RJ, Soman SS. Diabetes nephropathy. Medscape Tilgængelig på: http://emedicine.medscape.com/article/238946-overview. Opdateret 30. september 2016. Tilgået den 12. februar 2017.
- Tuttle KR, Bakris GL, Bilous RW, et al. Diabetisk nyresygdom: En rapport fra en ADA-konsensuskonference. Diabetes Care 2014;37;37:2864-2883. https://doi.org/10.2337/dc14-1296
- Patel A, MacMahon S, Chalmers J, et al. Intensiv blodglukosekontrol og vaskulære resultater hos patienter med type 2-diabetes. N Engl J Med 2008;358:2560-2572.
- Duckworth W, Abraira C, Moritz T, et al. Glukosekontrol og vaskulære komplikationer hos veteraner med type 2-diabetes. N Engl J Med 2009;360:129-139.
- Ismail-Beigi F, Craven T, Banerji MA, et al. Effekt af intensiv behandling af hyperglykæmi på mikrovaskulære resultater ved type 2-diabetes: En analyse af det randomiserede ACCORD-forsøg. Lancet 2010;376;376:419-430.
- National Kidney Foundation. KDOQI-retningslinje for klinisk praksis for diabetes og CKD: 2012 opdatering. Am J Kidney Dis 2012;60:850-886.
- Fox CS, Matsushita K, Woodward M, et al. Chronic Kidney Disease Prognosis Consortium. Sammenhængen mellem nyresygdomsmålinger og dødelighed og endestadiet af nyresygdom hos personer med og uden diabetes: En meta-analyse. Lancet 2012;380:1662-1673.
- Hahr AJ, Molitch ME. Håndtering af diabetes mellitus hos patienter med kronisk nyresygdom. Clin Diabetes Endocrinol 2015. doi: 10.1186/s40842-015-0001-9.
- Alsaad KO, Herzenberg AM. Adskillelse af diabetisk nefropati fra andre tilfælde af glomerulosklerose: En opdatering. J Clin Pathol 2007;60:18-26.
- Narva AS, Bilous RW. Laboratorievurdering af diabetisk nyresygdom. Diabetes Spectr 2015;28:162-166.
- Levey AS, Stevens LA, Schmid CH, et al. En ny ligning til vurdering af den glomerulære filtrationshastighed. Ann Intern Med 2009;150;150:604-612.
- National Kidney Foundation. KDOQI-retningslinjer for klinisk praksis for kronisk nyresygdom: Evaluering, klassificering og stratificering. Am J Kidney Dis 2002;39(2 Suppl 1):S1-S266.
- de Boer IH, Rue TC, Cleary PA, et al. Long-term renal outcomes of patients with type 1 diabetes mellitus and microalbuminuria: En analyse af Diabetes Control and Complications Trial/Epidemiology of Diabetes Interventions and Complications-kohorten. Arch Intern Med 2011;171;171:412-420.
- Wanner C, Inzucchi SE, Lachin JM, et al. Empagliflozin og progression af nyresygdom ved type 2-diabetes. N Engl J Med 2016;375;375:323-334.
- Heerspink HJL, Desai M, Jardine M, et al. Canagliflozin bremser progressionen af nedsat nyrefunktion uafhængigt af glykæmiske virkninger. J Am Soc Nephrol 2016;28:1-8.
- Lexi-Drugs. Lexicomp. Wolters Kluwer Health, Inc. Riverwoods, IL. Tilgængelig på: http://online.lexi.com. Besøgt 31. oktober 2016.
- Micromedex Solutions. Truven Health Analytics, Inc. Ann Arbor, MI. Tilgængelig på: : http://www.micromedexsolutions.com. Tilgået 31. oktober 2016.
- James PA, Oparil S, Carter BL, et al. 2014 evidence-based guideline for the management of high blood pressure in adults (2014 evidensbaseret retningslinje for behandling af højt blodtryk hos voksne). JAMA 2014;311;311:507-520.
- King P, Peacock I, Donnelly R. The United Kingdom Prospective Diabetes Study (UKPDS): Kliniske og terapeutiske konsekvenser for type 2-diabetes. Br J Clin Pharmacol 1999;48:643-648.
- Jackevicius CA, Wong J, Aroustamian I, et al. Rater og prædiktorer for afbrydelse af ACE-hæmmere efter forhøjet serumkreatinin: En retrospektiv kohorteundersøgelse. BMJ Open 2014;4:e005181.
- Mauer M, Zinman B, Gardiner R, et al. Renale og retinale virkninger af enalapril og losartan ved type 1-diabetes. N Engl J Med 2009;361:40-51.
- Bilous R, Chaturvedi N, Sjølie AK, et al. Effekt af candesartan på mikroalbuminuria og albuminudskillelseshastighed ved diabetes: Tre randomiserede forsøg. Ann Intern Med 2009;151;151:11-20.
- Haller H, Ito S, Izzo JL Jr, et al. Olmesartan til forsinkelse eller forebyggelse af mikroalbuminuri ved type 2-diabetes. N Engl J Med 2011;364:907-917.
- Makani H, Bangalore S, Desouza KA, et al. Efficacy and safety of dual blockade of the renin-angiotensin system: Metaanalyse af randomiserede forsøg. BMJ 2013;346:f360.
- Miao Y, Ottenbros SA, Laverman GD, et al. Effekt af en reduktion i urinsyre på nyreudfald under losartanbehandling: En post-hoc-analyse af reduktionen af endepunkter i ikke-insulinafhængig diabetes mellitus med angiotensin II-antagonist Losartan Trial. Hypertension 2011;58:2-7.
- Lewis EJ, Hunsicker LG, Clarke WR, et al. Renoprotektiv effekt af angiotensin-receptorantagonisten irbesartan hos patienter med nefropati som følge af type 2-diabetes. N Eng J Med 2001;354:851-860.
- Adler A, Casula A, Steenkamp R, et al. Association between glycemia and mortality in diabetic individuals on renal replacement therapy in the U.K. Diabetes Care 2014;37:1304-1311.
- Sharma SG, Bomback AS, Radhakrishnan J, et al. The modern spectrum of renal biopsy findings in patients with diabetes. Clin J Am Soc Nephrol 2013;8:1718-1724.
- Smart NA, Dieberg G, Ladhani M, Titus T. Early referral to specialist nephrology services for preventing the progression to end-stage kidney disease. Cochrane Database Syst Rev 2014;6:CD007333.
- Boulton AJM, Gries FA, Jervell JA. Retningslinjer for diagnosticering og ambulant behandling af diabetisk perifer neuropati. Diabet Med 1998;15:508-514.
- O’Brien PD, Hinder LM, Sakowski SA, Feldman EL. ER-stress i diabetisk perifer neuropati: Et nyt terapeutisk mål. Antioxid Redox Signal 2014;21:621-633.
- Cameron NE, Cotter MA. Pro-inflammatoriske mekanismer i diabetisk neuropati: Fokus på kernefaktor kappa B-vejen. Curr Drug Targets 2008;9:60-67.
- Tesfaye S, Chaturvedi N, Eaton SE, et al. Vaskulære risikofaktorer og diabetisk neuropati. N Engl J Med 2005;352:341-350.
- Wiggin TD, Sullivan KA, Pop-Busui R, et al. Forhøjede triglycerider korreleret med progression af diabetisk neuropati. Diabetes 2009;58;58:1634-1640.
- Stella P, Ellis D, Maser RE, Orchard TJ. Kardiovaskulær autonom neuropati (udåndings- og inspirationsforhold) ved type 1-diabetes. Forekomst og prædiktorer. J Diabetes Complications 2000;14:1-6.
- Witten DR, Tesfaye S, Chaturvedi N, et al. Risikofaktorer for kardiel autonom neuropati ved type 1-diabetes mellitus. Diabetologia 2005;48;48:164-171.
- Diabetes Control and Complication Trial (DCCT) Research Group. Effekten af intensiv diabetesbehandling på nerveledning i Diabetes Control and Complications Trial. Ann Neurol 1995;38:869-880.
- Diabetes Control and Complication Trial (DCCT) Research Group. Virkningen af intensiv diabetesbehandling på målinger af det autonome nervesystems funktion i Diabetes Control and Complications Trial (DCCT). Diabetologia 1998;41:416-423.
- Edwards JL, Vincent AM, Cheng HT, Feldman EL. Diabetisk neuropati: Mekanismer til håndtering. Pharmacol Ther 2008;120:1-34.
- Vincent AM, Callaghan BC, Smith AL, Feldman EL. Diabetisk neuropati: Cellulære mekanismer et terapeutisk mål. Nat Rev Neurol 2011;7:573-583.
- Kellogg AP, Wiggin T, Larkin D, et al. Beskyttende virkninger af inaktivering af cyclooxygenase-2 genet mod perifer nervedysfunktion og tab af intraepidermale nervefibre ved eksperimentel diabetes. Diabetes 2007;56:2997-3005.
- Callaghan BC, Cheng HT, Stables CL, et al. diabetisk neuropati: Kliniske manifestationer og nuværende behandlinger. Lancet Neurol 2012;11:521-534.
- Boulton AJM, Kirsner RS, Vileikyte L. Klinisk praksis: Neuropatiske diabetiske fodsår: Neuropatiske diabetiske fodsår. N Eng J Med 2004;351:48-55.
- Boulton AJM, Vinik AI, Arezzo JC, et al. Diabetiske neuropatier: En erklæring fra den amerikanske diabetesforening. Diabetes Care 2005;28:956-962.
- Boulton AJM, Armstrong DG, Albert SF, et al. Omfattende fodundersøgelse og risikovurdering: En rapport fra arbejdsgruppen under interessegruppen for fodpleje i American Diabetes Association, med tilslutning fra American Association of Clinical Endocrinologists. Diabetes Care 2008;31:1679-1685.
- Tesfaye S, Boulton AJ, Dyck PJ, et al. Diabetiske neuropatier: Opdatering af definitioner, diagnostiske kriterier, vurdering af sværhedsgrad og behandlinger. Diabetes Care 2010;33:2285-2293.
- Dyck PJ, Albers JW, Andersen H, et al. Diabetiske polyneuropatier: Opdatering af forskningsdefinition, diagnostiske kriterier og vurdering af sværhedsgrad. Diabetes Metab Res Rev 2011;27:620-628.
- Freeman R. Not all neuropathy is diabetes is of diabetic etiology: Differentialdiagnose af diabetisk neuropati. Curr Diabe Rep 2009;9:423-431.
- Balducci S, Iacobellis G, Parisi L, et al. Motionstræning kan modificere den naturlige historie af diabetisk perifer neuropati. J Diabetes Complications 2006;20:216-223.
- Bril V, England J, Franklin GM, et al. Evidensbaseret retningslinje: Behandling af smertefuld diabetisk neuropati. Rapport fra det amerikanske akademi for neurologi, den amerikanske sammenslutning for neuromuskulær og elektrodiagnostisk medicin og det amerikanske akademi for fysisk medicin og rehabilitering. Neurology 2011;76:1758-1765.
- Dowell D, Haegerich TM, Chou R. CDC Guideline for prescribing opioids for chronic pain – United States 2016. MMWR Recomm Rep 2016;65:1-49.
- Tesfaye S, Wilhelm S, Lledo A, et al. Duloxetin og pregabalin: Højdosis monoterapi eller deres kombination? “COMBO-DN-undersøgelsen” – en multinational, randomiseret, dobbeltblind, parallelgruppeundersøgelse hos patienter med diabetiske perifere neuropatiske smerter. Pain 2013;154;154:2616-2625.
- Ahn AC, Bennani T, Freeman R, et al. To stilarter af akupunktur til behandling af smertefuld diabetisk neuropati – et pilot randomiseret kontrolforsøg. Acupunct Med 2007;25:11-17.
- Garrow A, Xing M, Vere J, et al. Akupunkturens rolle i behandlingen af diabetisk smertefuld neuropati (DPN): Et pilot-RCT. Acupunct Med 2014;32;32:242-249.
- Ziegler D, Nowak H, Kempler P, et al. Behandling af symptomatisk diabetisk polyneuropati med antioxidanten alfa-liponsyre: En meta-analyse. Diabet Med 2004;21:114-121.
- Ziegler D, Low PA, Litchy WJ, et al. Efficacy and safety of antioxidant treatment with alpha-lipoic acid over 4 years in diabetic polyneuropathy: The NATHAN 1 trial. Diabetes Care 2011;34:2054-2060.
- Kuwabara S, Ogawara K, Harrori T, et al. De akutte virkninger af glykæmisk kontrol på axonal excitabilitet i humane diabetiske nerver. Intern Med 2002;41:360-365.
- Peltier A, Goutman SA, Callaghan BC. Smertefuld diabetisk neuropati. BMJ 2014;348:g1799.
- Soykan I, Sivri B, Sarosiek I, et al. Demografi, kliniske karakteristika, psykologiske profiler og misbrugsprofiler, behandling og langtidsopfølgning af patienter med gastroparese. Dig Dis Sci 1998;43;43:2398-2404.
- Camilleri M, Bharucha AE, Farrugia G. Epidemiologi, mekanismer og behandling af diabetisk gastroparese. Clin Gastroenterol Hepatol 2011;9:5-12.
- Shin AS, Camilleri M. Diagnostic assessment of diabetic gastroparesis. Diabetes 2013;62:2667-2673.
- Hasler WL, Wilson L, Parkman HP, Lee L. Vigtigheden af mavesmerter som et symptom ved gastroparese: Relation til kliniske faktorer, sygdommens sværhedsgrad, livskvalitet, gastrisk retention og medicinforbrug. Gastroenterology 2010;138. doi: 10.1016/S0016-5085(10)62131-2.
- Choung RS, Locke GR 3rd, Schleck CD, et al. Risiko for gastroparese hos personer med type 1- og 2-diabetes i den almindelige befolkning. Am J Gastroenterol 2012;107:82-88.
- Maleki D, Locke GR III, Camilleri M, et al. Gastrointestinal tract symptoms among persons with diabetes mellitus in the community. Arch Intern Med 2000;160;160:2808-2816.
- Bytzer P, Talley NJ, Leemon M, et al. Prævalens af gastrointestinale symptomer i forbindelse med diabetes mellitus: En befolkningsbaseret undersøgelse af 15.000 voksne. Arch Intern Med 2001;161:1989-1996.
- Jones KL, Russo A, Berry MK, et al. A longitudinal study of gastric emptying and upper gastrointestinal symptoms in patients with diabetes mellitus. Am J Med 2002;113:449-455.
- Gaber AO, Hathaway DK, Abell T, et al. Improved autonomic and gastric function in pancreas-kidney vs kidney-alone transplantation contributes to quality of life. Transplant Proc 1994;26;26:515-516.
- Punkkinen J, Färkkilä M, Mätzke S, et al. Upper abdominal symptoms in patients with Type 1 diabetes: Ikke relateret til forringelse af gastrisk tømning forårsaget af autonom neuropati. Diabet Med 2008;25:570-577.
- Schvarcz E, Palmer M, Aman J, et al. Fysiologisk hyperglykæmi forsinker gastrisk tømning hos normale personer og patienter med insulinafhængig diabetes mellitus. Gastroenterology 1997;113;113:60-66.
- Miller G, Palmer KR, Smith B, et al. Rygning forsinker gastrisk tømning af faste stoffer. Gut 1989;30:50-53.
- Rao AS, Camilleri M. Gennemgangsartikel: Metoclopramid og tardiv dyskinesi. Aliment Pharmacol Ther 2010;31:11-19.
- Patterson D, Abell T, Rothstein R, et al. A double-blind multicenter comparison of domperidone and metoclopramide in the treatment of diabetic patients with symptoms of gastroparesis. Am J Gastroenterol 1999;94:1230-1234.
- Arts J, Holvoet L, Caenepeel P, et al. Klinisk forsøg: En randomiseret-kontrolleret crossover-undersøgelse af intrapylorisk injektion af botulinumtoksin ved gastroparese. Aliment Pharmacol Ther 2007;26:1251-1258.
- Friedenberg FK, Palit A, Parkman HP, et al. Botulinum toxin A til behandling af forsinket gastrisk tømning. Am J Gastroenterol 2008;103:416-423.
- Humanitarian Device Exemption for Enterra Device. Fed Reg 2000;65:78495-78496.
- O’Grady G, Egbuji JU, Du P, et al. Højfrekvent elektrisk gastrisk stimulering til behandling af gastroparese: En meta-analyse. World J Surg 2009;33:1693-1701.
- Reddymasu SC, Sarosiek I, McCallum RW. Alvorlig gastroparese: Medicinsk behandling eller elektrisk stimulering af mavesækken. Clin Gastroenterol Hepatol 2010;8:117-124.
- McCallum RW, Dusing RW, Sarosiek I, et al. Mekanismer for symptomatisk forbedring efter gastrisk elektrisk stimulering hos gastroparetiske patienter. Neurogastroenterol Motil 2010;22:161-167.
- Douloumpakas I, Pyrpasopoulou A, Triantafyllou A, et al. Prævalens af muskuloskeletale lidelser hos patienter med type 2-diabetes mellitus: En pilotundersøgelse. Hippokratia 2007;11:216-218.
- Rosenbloom AL, Silverstein JH, Lezotte DC. Begrænset ledbevægelighed ved diabetes mellitus i barndommen indikerer øget risiko for mikrovaskulær sygdom. N Engl J Med 1981;305;191-194.
- Lister DM, Graham-Brown RAC, Burden AC. Opløsning af diabetisk cheiroarthropati. Br Med J 1986;293;293:1537.