Introduktion
Tethered Cord Syndrome (TCS) er en udviklingsmæssig neurologisk lidelse forårsaget af en unormalt lav conus medullaris. Det viser sig typisk i barndommen, men det kan forblive uopdaget indtil voksenalderen, og det kan være forbundet med et intraduralt lipom. Patienter med sameksisterende abnormiteter (f.eks. myelomeningocele) og klare kliniske symptomer (f.eks. progressiv bensvaghed, urininkontinens) kan kræve kirurgisk behandling. Målet med operationen er at frigøre rygmarven for at afhjælpe rygmarvsstrækningen. Indikationerne for kirurgi er dog fortsat kontroversielle (1).
Derimod er den spinale durale arteriovenøse fistel (SDAVF) en erhvervet tilstand. Det er den mest almindelige vaskulære misdannelse i rygsøjlen hos voksne. Den dannes i det neurale foramen ved en unormal, direkte forbindelse mellem den durale arterie (som forsyner duralrodshylsteret og den tilstødende spinal dura) og den medullære vene (som dræner det koronale venøse plexus) (2, 3).
Den kan præsentere sig med rygsmerter og progressivt neurologisk underskud. En SDAVF kræver typisk enten kirurgisk eller endovaskulær behandling.
Sammenfaldet af TCS, lipom (eller lipomyelomeningocele) og en SDAVF på sakralniveau er meget sjældent. I denne meddelelse rapporterer vi om to sådanne patienter. (4-6).
Faldmateriale
Fald 1
En 30-årig kvinde præsenterede sig med en 10-årig historie af smerter i lumbosakral rygsøjle; hun havde haft tilfældig stråling til begge nedre lemmer. Efter sin første fødsel udviklede hun rygsmerter. MR-scanningen påviste en tethered cord på L4-niveau og et filum terminale lipom. MRI’en viste også snoede vener på rygmarvsoverfladen (Figur 1C). Ni år senere, under den anden graviditet, konstaterede hun svaghed og føleforstyrrelser, ubalance med urin- og afføringsinkontinens. Ved indlæggelsen havde hun bilateral svaghed i plantarfleksion (grad 4 i henhold til det modificerede system fra Medical Research Council) og nedsat følesans i glutealregionerne og benene, samt plantarrespons. Babinski- og Rossolimo-tegnene var til stede bilateralt. En gentagen MRT afslørede intraspinale T2 hyperintensive forandringer i thorakal rygsøjlen og conus (figur 1A, B, D). Disse forandringer var i overensstemmelse med neurologisk underskud og blev efter udelukkelse af inflammatoriske demyeliniserende sygdomme, baseret på en hjerne-MRI og en aquaporin-4 antistoftest, diagnosticeret som myelopati. På grund af de beskrevne torturerede vener på rygmarvsoverfladen (Figur 1B) blev patienten underkastet spinal digital subtraktionsangiografi (DSA). DSA-området var fra Th6-niveauet til den coccygeale arterie. Resultaterne afslørede ikke nogen vaskulær misdannelse. Derfor var den foreløbige diagnose symptomatisk TCS og filum terminale lipom. I betragtning af svaghed og neurologisk underskud blev der planlagt kirurgisk rygmarvsafstilling uden lipomresektion.
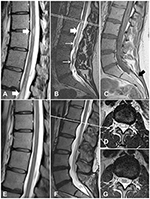
Figur 1. MR-billeder af rygmarven i tilfælde 1, før og efter behandling. (A) Myelopatiske forandringer i den thorakale rygmarv (hvide pile). (B) Myelopatiske forandringer i conus medullaris (tyk pil) og fortykkede torturkar (tynde pile). (C) T1WI-sekvens viser et filum terminale lipom (sort pil). (D) Et tværsnit på L1/L2-niveau viser myelopatiske forandringer. (E-G) Opfølgningsbilleder viser opløsning af myelopatiske forandringer og forsvinden af de fortykkede vener.
Sakralkanalen blev åbnet med et medianindsnit. Duraen var tynd og gennemsigtig. Efter en midline dura- og arachnoid-incision blev der visualiseret en tumor, der så ud til at være et lipom. Den opslugte filum terminale og spinalnerverødderne caudalt, til S2-niveau. S1- og S2-nerverødderne var placeret lateralt i forhold til tumoren. Der blev også konstateret et fortykket, snoet, lysrødt kar på filum terminale, der løb i kranial retning. Den ydre overflade af duraen blev undersøgt bilateralt på sacralniveau for at finde en SDAVF. Der blev identificeret et tydeligt synligt nidus på S3-niveau i venstre side. Der blev foretaget en empirisk test for at understøtte dette fund. Der blev anbragt et klip på den arterialiserede vene, intraduralt, i et par minutter. Derefter ændrede karret på filum terminale tydeligt farve, fra lyserødt til blåligt gråt, og dets spænding aftog. SDAVF blev derefter afkoblet intraduralt, og nidus blev koaguleret ekstraduralt. Desuden blev filum terminale skåret over, og der blev taget prøver af lipomet til histologisk undersøgelse. Duraen blev sutureret vandtæt, og såret blev lukket i lag.
Det postoperative forløb var begivenhedsløst. Et par dage senere blev patienten udskrevet. En opfølgende MRT viste en opløsning af de myelopatiske forandringer (figur 1E-G). Ved 1-årsopfølgningen var patienten betydeligt forbedret, uden inkontinens eller motorisk underskud.
Fald 2
En 33-årig mand præsenterede sig med en 2-årig historie af smerter i lumbosakral rygsøjle med progressiv svaghed i underbenene, urinfrekvens og inkontinens. Symptomerne intensiveredes efter motion og langvarig stående. MR-scanning af lænderyggen påviste en snoet ledning på L3-niveau, et filum terminale lipom og ødem i rygmarven. Den viste også snoede vener på rygmarvets bageste overflade (figur 2A,D).
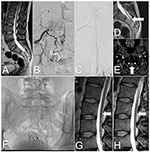
Figur 2. Billeder af rygmarven i tilfælde 2, før og efter behandling. (A) T2-vægtet MRI: Tethered cord og sacral lipoma. (B) DSA: SDAVF på S2-S3-niveau forsynet af de laterale sakrale arterier. (C) DSA: snoede vener på den posteriore overflade af den cervikale rygmarv. (D) T2-vægtet MRI: Vener på den bageste overflade af den bundet rygmarv (pil). (E) TOF-MRI: Drænende vene (pil) på niveau af atlanto-occipitalt kryds. (F) Røntgenbillede af det sakrale område viser emboliske midler efter tre emboliseringer. (G) Lumbal T2-vægtet MRI: Efter den sidste embolisering er der synlige snoede kar på rygmarvens bageste overflade (pil). (H) Opfølgnings-MRI: 6 måneder efter operationen ses de snoede kar ikke længere på rygmarvens bageste overflade (pil).
Den neurologiske undersøgelse afslørede bilateral hofteledsbøjningssvaghed (grad 4 i henhold til det modificerede Medical Research Council-system), plantarfleksionssvaghed (grad 3 i henhold til det modificerede Medical Research Council-system) og nedsat følesans i S2-S3-dermatomer. Babinski- og Rossolimo-tegnene var til stede bilateralt. På grundlag af de kliniske og radiologiske tegn var der mistanke om en SDAVF. En DSA bekræftede SDAVF på S2-S3-niveau i duraen, der forsynes af laterale arterier sacrale arterier og grene fra de indre arterier iliacus. Der var snoede drænende vener på den posteriore overflade af hele rygmarven og endte intrakranielt (figur 2B,C,E).
Patienten blev underkastet tre endovaskulære emboliseringer, hver med et andet middel. Først blev der udført embolisering med Onyx™ 18, der blev administreret i to mikrokathetere. Denne behandling resulterede i en okklusion af fistlen. Patienten fik en betydelig bedring, men på grund af dårlig penetration af den drænende vene rekanaliserede fistlen efter et par uger, og symptomerne vendte tilbage.
En anden embolisering blev udført 4 måneder senere. Den vaskulære adgang til fistlen var mere kompliceret. En 25% Phil™-injektion var kun mulig gennem de små sakrale grene af den venstre arteria iliacalis interna interna. Denne procedure opnåede en betydelig reduktion af flowet gennem fistlen. Atten måneder senere blev der forsøgt embolisering af fistlen med fortyndet lim. På trods af en god okklusion af fistlen observeret i en DSA, var de snoede kar fortsat synlige i opfølgnings-MRI’en (figur 2F,G). Symptomerne var fortsat, og patienten blev kvalificeret til kirurgisk behandling.
Målet med operationen var at okkludere den drænende vene og den arterielle føder og at reducere lipomet. Med en median incision blev sakralkanalen åbnet i højre side. Duraen var tyk, og der var flere kar fyldt med emboliske stoffer. Der var et stort, lysrødt kar ekstraduralt og et intraduralt på S2-S3-niveau. Der blev anbragt en clips på den arterialiserede vene intraduralt i et par minutter. Herefter skiftede karret farve, og spændingen aftog. Både intra- og ekstradurale kar blev koaguleret. Herefter blev lipomet visualiseret og delvist fjernet. Duraen blev sutureret vandtæt, og såret blev lukket i lag.
Det postoperative forløb var begivenhedsløst, og et par dage senere blev patienten udskrevet. Efter 6 måneder viste en opfølgende MRT, at der ikke fandtes snoede kar på rygmarvens bageste overflade og en betydelig reduktion af de myelopatiske forandringer (Figur 2H). Ved opfølgningen blev patienten betydeligt forbedret, uden inkontinens, med en vis urinfrekvens og let svaghed (grad 4 i henhold til det modificerede system fra Medical Research Council).
Diskussion
Den samtidige forekomst af TCS, et intraduralt lipom og en SDAVF på sakralniveau bør, selv om den er usædvanlig, holdes i erindring i lyset af det stigende antal rapporterede tilfælde. Denne undersøgelse beskrev det femte og sjette tilfælde af denne art med et TCS og et SDAVF på sakralniveau (tabel 1). For nylig blev et af disse tilfælde opført af Horiuchi et al. og yderligere to tilfælde blev tilføjet af Talenti et al. (6, 8).

Tabel 1. Litteraturgennemgang om sammenfaldet af sacral dural arteriovenøs fistel (DAVF), tethered cord syndrome (TCS) og filum terminale lipoma/lipomyelomeningocele.
Årsagen til dette tredobbelte sammenfald er gådefuld. På den ene side menes SDAVF at være en erhvervet enhed i modsætning til primære rygmarvsanomalier. Dette træk antydede, at sameksistensen af disse patologier kunne være tilfældig. På den anden side er lipomer og angiomer begge af mesenkymal oprindelse. Tidligere rapporter om kombineret intramedullær AVM og lipom tyder på, at der kan være en korrelation mellem disse ætiologier (9, 10). Så vidt vi ved, har ingen tidligere undersøgelser imidlertid beskrevet sameksistensen af dysrafiske anomalier og en SDAVF på sakralniveau, som præsenterede sig i barndommen. En søgning i Medline-databasen afslørede heller ikke nogen rapport om en medfødt SDAVF. Flere rapporter har imidlertid beskrevet en SDAVF sekundært til enten kirurgi eller traume (11-15). Derfor kunne en tidligere operation for en myelomeningocele teoretisk set efterfølgende udløse dannelsen af en SDAVF.
Der er i tidligere undersøgelser rapporteret, at en venøs sinustrombose med tilhørende intravenøs hypertension og en venøs udstrømsobstruktion kan udløse dannelsen af shunts (16-18). Derfor kunne en alternativ forklaring på sameksistensen af de lidelser, der blev fundet i vores tilfælde, have været, at et lipom forårsagede et tryk, som obstruerede det venøse udløb og dermed fremmede dannelsen af en SDAVF. Denne alternative mekanisme ville ikke være relateret til en tidligere historie med traumer eller kirurgi.
Erhvervede SDAVF’er er typisk placeret i thorakolumbalregionen, og den gennemsnitlige alder ved præsentation er omkring 60 år (19). Sacrale SDAVF’er er sjældne, og gennemsnitsalderen ved præsentation af SDAVF’er, der sameksisterer med et TCS, er 41 år (tabel 1). Derfor er det også muligt, at en medfødt anomali, som f.eks. et intraduralt lipom, kan fremme dannelsen af en SDAVF i en yngre alder. For nylig beskrev Horiuchi et al. to tilfælde og gennemgik ni tidligere offentliggjorte tilfælde af SDAVF’er og AVM’er, der sameksisterede med rygmarvslipomer af forskellige typer og på forskellige rygmarvsniveauer (8). Både Djindjian et al. og Horiuchi et al. postulerede, at den mest sandsynlige mekanisme, der ligger til grund for en forsinket SDAVF-dannelse, kan være adipocytternes frigivelse af angiogene faktorer; disse faktorer kan påvirke angiogenese (20) og føre til lokal hypervaskularisering (5, 8). Desuden udelukkede Jellema et al. prothrombotiske faktorer i patogenesen af SDAVF’er (21).
Det symptomatiske sammenfald af TCS, sakral lipom og SDAVF giver anledning til spørgsmålet: Hvad driver præcis symptomerne? Talenti et al. har for nylig beskrevet diagnostiske og terapeutiske vanskeligheder for to lignende tilfælde (6). Hos begge disse patienter resulterede en indledende afbinding af rygmarven og fjernelse af lipomaet/lipomyelomeningocele hverken i forbedring eller forværring. Efter spinal angiografi tog de derefter fat på den spinal vaskulære patologi. Den naturlige historie for filum terminale lipom er benignt; kun 5 % af patienterne har TCS-symptomer (22). Lipomaet var således den mindst sandsynlige årsag til neurologisk svækkelse. Ikke desto mindre kunne både TCS og SDAVF i et vist omfang forårsage lignende symptomer. Et TCS bliver oftere symptomatisk hos børn end hos voksne (23). I modsætning hertil udvikles funktionsnedsættelser i forbindelse med SDAVF’er hos ældre og midaldrende personer. Desuden inducerer sakrale SDAVF’er rygmarvshyperintensiteter, der er synlige i T2-vægtede MR-scanninger, og som typisk forsvinder efter en vellykket behandling (24). Derfor er den mest sandsynlige årsag til neurologisk forværring SDAVF, baseret på gennemsnitsalderen hos patienter med sammenfaldende TCS, sakral lipom og SDAVF (se tabel 1) og baseret på det gode postoperative resultat; dvs. opløsningen af intramedullære forandringer, der er påvist i MR-scanningerne. Desuden kan SDAVF-symptomer i modsætning til TCS blive forværret ved fysisk anstrengelse og ved stigende intraabdominalt tryk, som i begge tilfælde beskrevet i den foreliggende undersøgelse.
I patienter med dette tredobbelte sammenfald var SDAVF altid den direkte årsag til tiltagende symptomer. Derfor bør det vigtigste mål for behandlingen være okklusion. I litteraturen syntes endovaskulær embolisering at være lige så effektiv som kirurgi, og embolisering var den eneste behandling i lignende tilfælde (24). Desværre var embolisering enten umulig at gennemføre eller ineffektiv i vores tilfælde. Med kirurgi kunne både SDAVF og TCS udforskes og behandles i én procedure.
I vores første tilfælde var det indledende mål med kirurgien at afbinding af rygmarven, fordi SDAVF ikke blev bekræftet på en præoperativ DSA. Spørgsmålet er imidlertid stadig, hvorfor SDAVF var skjult på DSA’en? Oldfield et al. beskrev tre tilfælde af SDAVF’er, som ikke blev opdaget på en DSA, men som var stærkt mistænkt på grundlag af andre neuroimagingmodaliteter. Disse SDAVF’er blev med succes afbrudt under operationen (25). De faktorer, der hindrede spinal DSA-detektion, var bl.a. fedme, aortaaneurisme, aortaatersklerose med tortuositet og obstruktion af åbningen eller tortuositet i de lumbale arterier. I vores tilfælde kunne en mulig forklaring på de falsk negative DSA-resultater være, at DSA’en ikke var tilstrækkelig grundig; vi undersøgte således ikke indstrømningen på sakralniveau.
De to tilfælde, der er beskrevet her, viste, at sakrale SDAVF’er kan være vanskelige at påvise i DSA’er og vanskelige at okkludere med endovaskulær embolisering. Tidligere undersøgelser, der er præsenteret i tabel 1, beskrev også mislykkede emboliseringer ved behandling af SDAVF’er (4, 6, 8). I alt har der været 5 mislykkede forsøg på endovaskulær okklusion i 3 ud af 6 rapporterede tilfælde (tabel 1). Vi konkluderede således, at en kirurgisk tilgang kan være overlegen i forhold til endovaskulær embolisering, fordi kirurgi tilbyder en behandling i ét trin.
Sluttende bemærkninger
Den samtidige forekomst af TCS, lipom og SDAVF på sakralniveau er usædvanlig sjælden. Tidligere rapporter og vores resultater afslører, at kirurgi kan være overlegen endovaskulær embolisering til behandling af sakrale SDAVF’er med sameksisterende entiteter, fordi kirurgi tilbyder en ettrinsbehandling. Et stigende antal rapporterede tilfælde har indikeret, at symptomerne på denne tredobbelt lidelse kan være forårsaget udelukkende af SDAVF og ikke af TCS eller lipom, som er tydeligt synlige i neuroimaging.
Samtykke
Der blev indhentet et skriftligt informeret samtykke fra deltagerne til offentliggørelse af denne caserapport.
Author Contributions
PK designede projektet og gennemgik det kritisk. ŁP udarbejdede manuskriptet, indsamlede og gennemgik data. PJ, MZ og MG indsamlede casedata. BC gennemgik anatomien. AM foretog den endelige godkendelse af den version, der skulle offentliggøres.
Interessekonflikt erklæring
Forfatterne erklærer, at forskningen blev udført uden kommercielle eller økonomiske relationer, der kunne opfattes som en potentiel interessekonflikt.
1. Drake JM. Kirurgisk håndtering af den fastklemte rygmarv – at gå på den hårfine linje. Neurosurg Focus. (2007) 23:E4. doi: 10.3171/FOC-07/08/E4
PubMed Abstract | CrossRef Full Text
2. McCutcheon IE, Doppman JL, Oldfield EH. Mikrovaskulær anatomi af durale arteriovenøse abnormiteter i rygsøjlen: en mikroangiografisk undersøgelse. J Neurosurg. (1996) 84:215-20. doi: 10.3171/jns.1996.84.2.0215
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Gailloud P. Spinal dural arteriovenøs fistel (SDAVF) variant med dobbelt perimedullær og epidural drænage. Eur Spine J. (2017). 27(Suppl 3):375-9. doi: 10.1007/s00586-017-5298-x
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Krisht KM, Karsy M, Ray WZ, Dailey AT. Ekstraspinal type I dural arteriovenøs fistel med en lumbosakral lipomyelomeningocele: en case report og gennemgang af litteraturen. Case Rep Neurol Med. (2015) 2015:526321. doi: 10.1155/2015/526321
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Djindjian M, Ayache P, Brugieres P, Poirier J. Sacral lipom i filum terminale med dural arteriovenøs fistel. Case report. J Neurosurg. (1989) 71(5 Pt 1):768-71. doi: 10.3171/jns.1989.71.5.0768
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Talenti G, Vitale G, Cester G, Della Puppa A, Faggin R, Causin F. Rare association mellem spinal durale arteriovenøse fistler og dysraphismer: rapport om to tilfælde og gennemgang af litteraturen med fokus på faldgruber i diagnose og behandling. Intervent Neuroradiol. (2017) 23:458-64. doi: 10.1177/1591019917714636
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Przepiórka Ł, Kunert P, Juszynńska P, Zawadzki M, Ciszek B, Głowacki M, et al. Coincidence of tethered cord, filum terminale lipoma, and sacral dural arteriovenous fistula: report of two cases and a literature review. Front Neurol. (2018) 9:807. doi: 10.3389/fneur.2018.00807
CrossRef Full Text | Google Scholar
8. Horiuchi Y, Iwanami A, Akiyama T, Hikata T, Watanabe K, Yagi M, et al. Spinal arteriovenøs fistel sameksisterende inden for et spinal lipom: rapport om to tilfælde. Spinal Cord Series Cases (2017) 3:17079. doi: 10.1038/s41394-017-0011-1
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Weon YC, Chung JI, Roh HG, Eoh W, Byun HS. Kombineret spifnal intramedullær arteriovenøs misdannelse og lipomyelomeningocele. Neuroradiology (2005) 47:774-9. doi: 10.1007/s00234-005-1336-1
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Rice JF, Jelsma RK. Kombineret arteriovenøs misdannelse og intramedullært lipom: kirurgi og emboloterapi. Am J Neuroradiol. (1986) 7:171-3.
PubMed Abstract | Google Scholar
11. Asakuno K, Kim P, Kawamoto T, Ogino M. Dural arteriovenøs fistel og progressivt conus medullaris-syndrom som komplikationer af lumbale discectomier. Case report. J Neurosurg. (2002) 97(3 Suppl):375-9. doi: 10.3171/spi.2002.97.3.0375
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Kang JW, Koo JH, Kim DK, Joo YJ, Kim TH, Song SH. Myelopati forårsaget af spinal dural arterio-venøs fistel efter første lumbale vertebralkropfraktur – en caserapport. Ann Rehabil Med. (2011) 35:729-32. doi: 10.5535/arm.2011.35.5.729
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Vankan Y, Demaerel P, Heye S, Van Calenbergh F, van Loon J, Maleux G, et al. Dural arteriovenøs fistel som en sen komplikation efter brud på øvre halshvirvelsøjle. Case report. J Neurosurg. (2004) 100(4 Suppl Spine):382-4. doi: 10.3171/spi.2004.100.4.0382
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Nishimura Y, Natsume A, Ginsberg HJ. Spinal dural arteriovenøs fistel i forbindelse med L-4 isthmisk spondylolisthesis. J Neurosurg Spine (2014) 20:670-4. doi: 10.3171/2014.3.SPINE13492
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Khaldi A, Hacein-Bey L, Origitano TC. Spinal epidural arteriovenøs fistel med sent indsættende perimedullær venøs hypertension efter lumbalkirurgi: case report and discussion of the pathophysiology. Spine (2009) 34:E775-9. doi: 10.1097/BRS.0b013e3181ae4a52
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Jablawi F, Nikoubashman O, Mull M. Arteriel hypertension er forbundet med symptomatiske spinal durale arteriovenøse fistler med symptomer. World Neurosurg. (2017) 103:360-3. doi: 10.1016/j.wneu.2017.04.050
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Borden JA, Wu JK, Wu JK, Shucart WA. En foreslået klassifikation for spinal og kraniel durale arteriovenøse fistelmalformationer og konsekvenser for behandlingen. J Neurosurg. (1995) 82:166-79. doi: 10.3171/jns.1995.82.2.0166
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Lawton MT, Jacobowitz R, Spetzler RF. Omdefineret rolle for angiogenese i patogenesen af durale arteriovenøse misdannelser. J Neurosurg. (1997) 87:267-74. doi: 10.3171/jns.1997.87.2.0267
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Wojciechowski J, Kunert P, Nowak A, Dziedzic T, Czernicki T, Wojtowicz K, et al. Kirurgisk behandling af spinal durale arteriovenøse fistler: Udfald, komplikationer og prognostiske faktorer. Neurol Neurochir Pol. (2017). 51:446-53. doi: 10.1016/j.pjnns.2017.07.001
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Lucarelli E, Sangiorgi L, Benassi S, Donati D, Gobbi GA, Picci P, et al. Angiogenese i lipom: En eksperimentel undersøgelse i kyllingeembryoens chorioallantoiske membran. Int J Mol Med. (1999) 4:593-6. doi: 10.3892/ijmm.4.6.593
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Jellema K, Tijssen CC, Fijnheer R, de Groot PG, Koudstaal PJ, van Gijn J. Spinal durale arteriovenøse fistler er ikke forbundet med prothrombotiske faktorer. Stroke (2004) 35:2069-71. doi: 10.1161/01.STR.0000135766.22285.dc
CrossRef Full Text | Google Scholar
22. Cools MJ, Al-Holou WN, Stetler WR Jr Jr, Wilson TJ, Muraszko KM, Ibrahim M, et al. Filum terminale lipomer: prævalens ved billeddannelse, naturlig historie og konusposition. J Neurosurg Pediatr. (2014) 13:559-67. doi: 10.3171/2014.2.PEDS13528
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Al-Holou WN, Muraszko KM, Garton HJ, Buchman SR, Maher CO. Resultatet af frigørelse af tethered cord release ved sekundært og multiple gentagne tethered cord syndrom. J Neurosurg Pediatr. (2009) 4:28-36. doi: 10.3171/2009.2.PEDS08339
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Gioppo A, Farago G, Giannitto C, Caputi L, Saladino A, Acerbi F, et al. Sacrale durale arteriovenøse fistler: en diagnostisk og terapeutisk udfordring – single-center erfaring med 13 tilfælde og gennemgang af litteraturen. J Neurointerv Surg. (2017). 10:415-21. doi: 10.1136/neurintsurg-2017-013307
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Oldfield EH, Bennett A 3rd Chen MY, Doppman JL. Vellykket håndtering af spinal durale arteriovenøse fistler, der ikke er opdaget ved arteriografi. Rapport om tre tilfælde. J Neurosurg. (2002) 96(2 Suppl):220-9. doi: 10.3171/spi.2002.96.2.0220
PubMed Abstract | CrossRef Full Text | Google Scholar