På mødet i 2013 i American Academy of Ophthalmology deltog jeg i en debat om fordele og ulemper ved at bruge generiske lægemidler i forhold til mærkevare-medicin. Jeg blev bedt om at argumentere til fordel for mærkevaremedicin, men som i de fleste debatter er det en overforenkling at tage blindt den ene eller den anden side. Virkeligheden er mere kompliceret. Generiske lægemidler har omkostninger til deres fordel, men de giver nogle gange ikke de samme behandlingsspecifikationer eller resultater som mærkevaremedicin, på trods af Food and Drug Administration’s bestræbelser på at sikre, at de gør det.
Her vil jeg gerne tale om nogle af de måder, hvorpå generiske lægemidler kan afvige fra de mærkevarer, de erstatter, og hvad klinikere skal være opmærksomme på.
Spørgsmålet om bioækvivalens
De forhindringer, der kræves for at få et nyt, “innovativt” lægemiddel på markedet, er væsentligt forskellige fra dem, der kræves for et generisk opfølgningslægemiddel. Det er naturligvis en del af grunden til, at et mærkevareprodukt koster mere. Hvor det første innovative lægemiddel skal bevise sikkerhed og effektivitet gennem kliniske forsøg, skal et generisk lægemiddel kun påvise bioækvivalens.
Og selv om bioækvivalens lyder som om det kunne involvere gennemførelse af biologiske undersøgelser, definerer FDA det således, at du skal påvise, at ingredienserne i din generiske version er en nøjagtig kopi af ingredienserne i det originale lægemiddel, herunder både aktive ingredienser og hjælpestoffer. (Hvis de aktive ingredienser og hjælpestoffer ikke er identiske, betragtes lægemidlet ikke som et generisk lægemiddel; det skal gennemgå den almindelige FDA-godkendelse ligesom ethvert andet nyt lægemiddel). Forudsætningen er, at dette vil medføre, at det generiske lægemiddel vil have samme sikkerhed og virkning som det mærkevarepræparat.
Den idé, at generiske lægemidler er lig med mærkevarepræparater, fordi ingredienserne er de samme, er desværre ikke nødvendigvis sand. Mange faktorer, der påvirker virkningen af et aktuelt lægemiddel, er uafhængige af ingredienserne i flasken. For eksempel:
– Flaskematerialet har betydning. Ingredienserne i mange mærkevaremediciner er afstemt efter det anvendte flaske-materiale. Dette var bestemt tilfældet med latanoprost, hvor kompatibilitet med flaskematerialet var en stor del af forsknings- og udviklingsprocessen, da Xalatan blev bragt på markedet. Dette er ikke noget, der er direkte undersøgt af FDA.
– Flaskeform og -størrelse påvirker brugen. Innovative lægemiddelforsøg tester ikke kun lægemidlet, men også den flaske, som det skal leveres til patienterne i, så der er taget hensyn til virkningen af flaskens form og størrelse. Producenter af generiske lægemidler er imidlertid ikke forpligtet til at kopiere flaskeform og -størrelse, og dette kan gøre en forskel i forhold til, hvor let patienterne kan bruge lægemidlet.
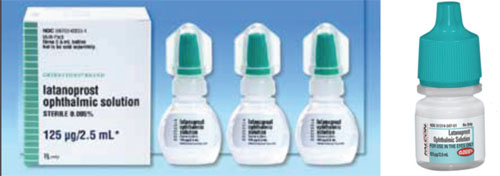
Et problem, der kan skabe forvirring, når man skifter fra et mærkevarepræparat til et generisk lægemiddel, eller fra et generisk lægemiddel til et andet, er forskellen i lågets form og farve.
For eksempel leveres Xalatan i en flad, lille flaske, som kræver en vis anstrengelse og finesse at klemme for at indgyde en dråbe. I modsætning hertil er nogle af de generiske flasker med latanoprost runde og mere stive, hvilket gør flasken sværere for patienten at klemme. (Se eksempler på modsatte side.) Mange af vores patienter er ældre og har fysiske begrænsninger. Hvis de er vant til at klemme en bestemt flaske, der er flad og lidt mindre stiv, og de derefter skifter til en flaske, der er rund og mere stiv, kan påføringsprocessen – og deres overholdelse af medicinen – være anderledes, end da de brugte den tidligere flaske. Da flaskeform og -størrelse desuden vælges af hver enkelt generisk producent, kan patienterne nogle gange få medicinen i en flad flaske og andre gange få den i en rund flaske. Det har skabt en masse forvirring hos vores patienter.
– Kappens farve passer ikke altid sammen. Det er meningen, at flaskehætternes farver skal koordineres på baggrund af lægemiddelkategorien. FDA forsøger at sikre, at farven er korrekt, men der har været tilfælde, hvor en hætte af en anden farve er gledet igennem. Som følge heraf kan det forekomme, at den generiske flaskehætte (såvel som form og størrelse) afviger fra mærkevaremidlets farve (se eksempel ovenfor). Dette skaber en masse forvirring, når patienterne forsøger at huske, hvilke af flere dråber de skal tage på hvilket tidspunkt.
Selv om en patient aldrig har brugt mærkevarepræparatet med den korrekte hættefarve, er en ændret farve stadig et problem; den nye hættefarve kan faktisk være den samme farve som en anden medicin, som patienten tager. F.eks. skal prostaglandinanalogflasker have tealfarvede hætter. Hvis din patient bruger en generisk version, hvis flaske har en hvid hætte, kan hun forveksle den med andre klasser af medicin, der skal have en hvid hætte.
Hvis du bemærker et eksempel på en forkert hættefarve, har FDA sagt, at de gerne vil høre om det, så der kan tages skridt til at rette op på uoverensstemmelsen.
– Dråbestørrelsen kan være anderledes. De topiske dråbeflasker, der er på markedet lige nu, giver en dosis på 30 til 50 µl pr. dråbe. Desværre kan der være stor variation mellem mærkevare- og generiske formuleringer, blot fordi spidsen kan have et større eller mindre hul. Det kan naturligvis påvirke, hvor meget af lægemidlet der rent faktisk kommer ud i øjet; det kan være mindre, det kan være mere.
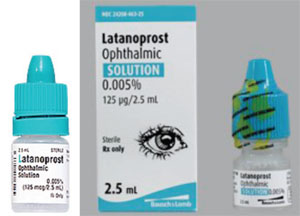
Et andet problem er forskelle i flaskeform og stivhed, hvilket kan gøre det sværere for en ældre patient at påføre dråberne. For eksempel kommer xalatan i en flad flaske; mange generiske lægemidler til dette lægemiddel kommer i runde flasker, som er vanskeligere at klemme.
Et endnu mere interessant er, at der kom en generisk timolol på markedet, som slet ikke havde et hul i spidsen; patienten skulle gennembore spidsen for at få medicin ud, svarende til en tube superlim. Det skabte forvirring hos mange patienter; nogle var ikke klar over, at det var meningen, at de skulle gøre dette, og forsøgte at bruge dråberne alligevel. De troede, at de satte en dråbe på, men de havde aldrig åbnet flasken, så der kom ikke noget ud. Andre troede, at flasken var defekt eller tom. Desuden kunne et selvlavet hul ende med at være af en hvilken som helst størrelse, hvilket kunne påvirke dosis, og processen med at lave hullet kunne let kompromittere steriliteten af indholdet.
Alle disse overvejelser – flaske-materiale, form og størrelse, hættefarve og diameteren på dråbeåbningen – er meget vigtige for både lægen og patienten. Desværre kan disse overvejelser blive overset, fordi fokus er på at forsøge at bevise bioækvivalens.
– En patients generiske lægemiddel kan se anderledes ud fra måned til måned. Dette er en anden uheldig bivirkning ved generiske lægemidler. Det sker, fordi der kan være flere producenter af et givet generisk lægemiddel, hver med en anden flaske. Der er f.eks. seks til otte forskellige producenter af generisk latanoprost på det amerikanske marked lige nu. Den, som et givet apotek sælger, kan ændre sig, fordi en kæde som CVS, Walgreens eller Walmart normalt vil vælge den producent, der giver apoteksgruppen det bedste tilbud på et givet tidspunkt. Derfor kan et apotek skifte det generiske lægemiddel, som det tilbyder, når der kommer et lavere bud fra en anden producent af generiske lægemidler. Så selv om patienten går til det samme apotek, kan han ende med at få forskellige generiske versioner af et lægemiddel på forskellige tidspunkter. Det kan være forvirrende, hvis flaskerne ser forskellige ud og/eller opfører sig forskelligt. (Der kan endda være en forskel i tolerance og IOP-kontrol mellem de to.)
Pakkeomslaget
Ironisk set forhindrer de nuværende regler producenterne i at advare læger eller patienter, selv hvis et generisk lægemiddel viser sig at have et problem, selv om de nuværende regler forhindrer producenterne i at advare læger eller patienter. Der er en regel, der kræver, at producenter af generiske lægemidler skal medtage en nøjagtig kopi af den indlægsseddel, der følger med det innovative lægemiddel. Selv om denne regel skulle afspejle idéen om, at lægemidlerne er bioækvivalente, har den utilsigtede bivirkning været at undgå at pålægge producenterne af generiske lægemidler de samme krav om omhyggelighed og byrde med hensyn til at sikre sikkerheden, som vi kræver af fabrikanterne af mærkevarer.
Det betyder, at hvis den generiske producent introducerer et lægemiddel på markedet og bemærker nogle bivirkninger eller uønskede hændelser, der opstår med det generiske produkt, har han ikke lov til at ændre indlægssedlen for at advare læger og patienter om, at der kan være et problem. Desuden kan denne regel faktisk mindske de generiske producenters motivation til at foretage en passende overvågning af deres produkter; der er trods alt ingen trussel om en retssag, hvis der opstår et problem.
Glædeligvis er FDA blevet opmærksom på dette problem. I november 2013 foreslog FDA en regel, der ville tillade producenter af generiske lægemidler at opdatere deres etiketter, hvis de modtager oplysninger om potentielle sikkerhedsproblemer. Hvis dette vedtages, vil det være et stort skridt i retning af at sikre sikkerheden for vores patienter.
Importerede generiske lægemidler
Et andet problem med generiske lægemidler er, at mange af dem fremstilles uden for USA, hvor kvalitetskontrollen nogle gange har været et reelt problem. Problemerne har varieret fra mystiske urenheder, der er fundet i lægemidlerne, til ufuldstændig tilpasning af ingredienserne til direkte svigagtige formuleringer, der ikke tjener noget gavnligt formål overhovedet (hvilket i nogle tilfælde kan resultere i alvorlige skader for patienterne).
Virkeligheden er, at generiske lægemidler ikke nødvendigvis er de samme som mærkevaremedicinen – selv om de har opfyldt FDA’s krav om bioækvivalens. Det betyder, at når der anvendes generiske lægemidler, er det os og vores patienter, der har ansvaret for at sikre sikkerheden og virkningen.
I henhold til New York Times leverer Indiens medicinalindustri i øjeblikket 40 procent af den håndkøbsmedicin og generiske receptpligtige medicin, der forbruges i USA. Mange af landets fabrikker er i verdensklasse og “kan stort set ikke skelnes” fra amerikanske produktionsfaciliteter (ifølge Times) og producerer pålidelige lægemidler af høj kvalitet. Men samtidig har Verdenssundhedsorganisationen anslået, at en ud af fem lægemidler, der fremstilles i Indien, er forfalskninger. (Lignende problemer er blevet rapporteret med lægemidler fremstillet i andre lande, herunder Kina.)
Vores gruppe foretog for et par år siden en undersøgelse, hvor vi sammenlignede latanoprost fremstillet i Indien med Xalatan. Vi fandt, at stabiliteten af de aktive ingredienser ikke var den samme over tid eller når de blev udsat for varme. Desuden fandt vi forurenende stoffer i alle de importerede flasker, herunder mikroskopiske filamenter, der lignede snor, og det, vi kaldte “UFO’er.”
Pointen er, at tilsynet med fremstillingspraksis, der finder sted i udlandet i virksomheder, der ikke er baseret i USA, især virksomheder, der ikke har mærkevarer på markedet, bare ikke er det samme.
Nogle læger antager måske, at sådanne importerede lægemidler kun er et problem, når patienterne køber lægemidler uden for USA via internettet for at spare penge, men virkeligheden er, at disse importerede lægemidler i stigende grad er tilgængelige her. Indiske formuleringer af timolol og travoprost er i øjeblikket tilgængelige gennem amerikanske distributører, og andre lægemidler som f.eks. NSAID’er vil snart være tilgængelige. Det er klart, at mange virksomheder uden for USA producerer generiske lægemidler af høj kvalitet, men det er bekymrende, at nogle få af dem ikke gør det. Det lægger byrden på læger og patienter at sikre sig, at et givet generisk lægemiddel er sikkert og effektivt. (I det mindste har de lægemidler, der er tilgængelige i USA, gennemgået FDA’s bioækvivalensproces; det har de lægemidler, som nogle patienter køber uden for landet via internettet, måske ikke, hvilket gør dem endnu mere mistænkelige.)
Inkliniske strategier
På grund af alle de variabler, vi har diskuteret, bør lægerne holde sig nøje orienteret om, hvad der sker med patienterne, når de skifter fra et mærkevareprodukt til et generisk lægemiddel eller skifter fra et generisk lægemiddel til et andet. Vi skal være opmærksomme for at sikre, at kontrollen af det intraokulære tryk ikke svinger, og at patienterne ikke præsenterer nye tegn og symptomer på intolerance over for medicinen.
Her er et par ting, du kan gøre for at beskytte dine patienter (og din praksis):
– Bed patienterne om at medbringe deres dråber. Jeg beder mine patienter om at gøre dette, uanset hvilken medicin de bruger, og mange af dem gør det, og mange af dem gør det. Det giver mig mulighed for at registrere, hvilken generisk producent de bruger, og gøre mit bedste for at holde øje med det, så hvis der opstår et problem eller noget ændrer sig, kan jeg se efter en mulig sammenhæng.
– Få patienter, der skifter til et nyt generisk lægemiddel, til at vende tilbage til klinikken hurtigere, end du ellers ville få dem til at vende tilbage. På den måde kan du sikre dig, at der ikke opstår uhensigtsmæssige konsekvenser. Vær opmærksom på ændringer i virkningen eller nye tegn eller symptomer.
– Hvis du ser, at der opstår problemer, når en patient skifter til et generisk lægemiddel, skal du underrette FDA. Husk, at denne situation lægger byrden på lægen til at sikre, at det generiske lægemiddel virkelig er sikkert og effektivt.
– Hvis en patient ikke klarer sig lige så godt med et generisk lægemiddel, skal du gøre en indsats for at få forsikringsselskabet til at dække det mærkevarepræparat. Jeg har stået over for patienter, som kunne tåle mærkevaremedicinen, men som havde svært ved at tåle et generisk lægemiddel på grund af bivirkninger som rødme eller irritation. I disse tilfælde skriver vi til forsikringsselskabet og gør alt, hvad vi kan, for at få patienten tilbage til mærkevareformuleringen.
For eksempel kan en mærkevaremedicin have et specifikt konserveringsmiddel i den, mens den generiske formulering har et alternativt konserveringsmiddel, som patienten er følsom over for. Travatan Z er et mærkevareprodukt fremstillet af Alcon, der indeholder konserveringsmidlet SofZia i stedet for benzalkoniumchlorid; de generiske versioner indeholder BAK, fordi deres bioækvivalens var baseret på den ældre version af travoprost. Hvis et apotek skifter en patient, der er allergisk over for BAK, til det generiske lægemiddel, bliver det et problem.
Da vi ser tusindvis af patienter om året i vores praksis, er det desværre virkelig svært at sikre, at vi vinder kampen for hver patient, der havner i denne situation. Vi gør dog en indsats.
Byrden er på os
Generiske lægemidler er kommet for at blive, og de er ved at blive en vigtig del af behandlingen af alle sygdomme, ikke kun inden for oftalmologi. De er typisk sikre og effektive, og de kan give omkostningsbesparelser for både patienterne og sundhedssystemet i almindelighed. Tag ikke fejl – jeg er en stor tilhænger af omkostningsbesparelser. Hvis vi kan finde en sikker måde at reducere omkostningerne på, samtidig med at vi opretholder en fremragende behandling, er jeg helt med på den. Det er den anden del af denne ligning, som vi skal holde øje med.
Jeg bruger selv generisk medicin hver dag, og det overvældende flertal af mine patienter er på generiske lægemidler nu. De klarer sig næsten alle meget godt, med god IOP-kontrol og god tolerance over for medicinen. Så jeg siger bestemt ikke, at vi skal undgå at bruge generiske lægemidler. Virkeligheden er imidlertid, at generiske lægemidler ikke nødvendigvis er de samme som mærkevaremedicin – selv om de har opfyldt FDA’s krav om bioækvivalens. Det betyder, at når man bruger generiske lægemidler, er det os og vores patienter, der har ansvaret for at sikre sikkerheden og effektiviteten. REVIEW
Dr. Kahook er The Slater Family Endowed Chair in Ophthalmology og næstformand for klinisk og translationel forskning ved University of Colorado School of Medicine i Denver. Han er konsulent for og modtager forskningsstøtte fra Allergan og Alcon.