Mit gæt her er, at du allerede har den empiriske formel for vinsyre, og at du skal finde dens molekylformel ved at bruge dens molarmasse.
Hvis man antager, at udgangspunktet her er den empiriske formel for vinsyre ser således ud
#”C”_2 “H”_3 “O”_3 -># empirisk formel
Nu fortæller en forbindelses empiriske formel dig det mindste hele talforhold, der eksisterer mellem atomerne i de elementer, der indgår i den.
I dette tilfælde ved du, at molekylformlen, som fortæller dig det nøjagtige antal atomer, der udgør et molekyle af den pågældende forbindelse, vil indeholde
#color(sort)(“2 atomer af C” color(red)(” for hver “) {(“3 atomer af H”),(“3 atomer af O”) :}#
I det væsentlige leder du efter et multiplum af den empiriske formel.
Vinsyre siges at have en molarmasse på #”150 g mol”^(-1)#. Dit mål her bliver at bestemme den molare masse af dens empiriske formel og derefter bruge denne værdi til at bestemme forbindelsens molekylformel.
I dette tilfælde får du
#2 xx “12.011 g mol”^(-1) “”color(blue)(+)#
#3 xx “1.00794 g mol”^(-1)#
#3 xx “15.9994 g mol”^(-1)#
#color(white)(aaaaaaaaaaaaaaaaaaaaaaaaaaaa)/color(white)(aaaaaaaaaaaaaaaaaaaaaaaaaaa)#
#”75.044 g mol”^(-1) -> #den molare masse af den empiriske formel
Så, hvis den empiriske formel har en molarmasse på #”75.044 g mol”^(-1)#, og den molare masse af vinsyre er #”150 g mol”^(-1)#, følger det, at du skal gange den empiriske formel med
#(150 color(red)(cancel(color(black)(“g mol”^(-1)))))/(75.044color(red)(cancel(color(black)(“g mol”^(-1))))) = 1,999 ~~ color(red)(2)#
for at få den molekylære formel. Dette betyder, at vinsyrens molekylformel vil være
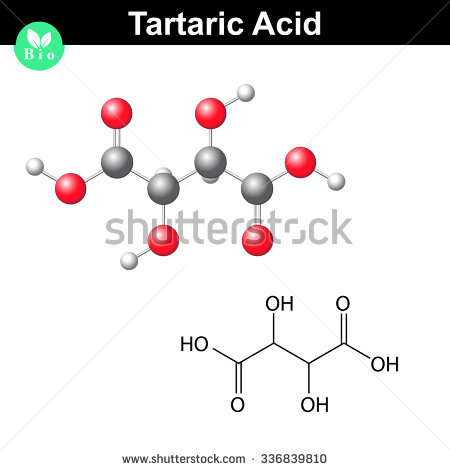
#(“C”_2 “H”_3 “O”_3)_color(red)(2) indebærer color(green)(|bar(ul(color(white)(a/a) “C”_4 “H”_6 “O”_6color(white)(a/a)|)))#
Sådan ser et molekyle af vinsyre ud