Células voltaicas (galvánicas)
Para ilustrar los principios básicos de una célula galvánica, consideremos la reacción del zinc metálico con el ion cúprico (Cu2+) para dar cobre metálico e ion Zn2+. La ecuación química equilibrada es la siguiente:
\NPodemos provocar esta reacción introduciendo una varilla de zinc en una solución acuosa de sulfato de cobre(II). A medida que la reacción avanza, la varilla de zinc se disuelve y se forma una masa de cobre metálico. Estos cambios ocurren espontáneamente, pero toda la energía liberada es en forma de calor y no en una forma que pueda ser utilizada para hacer trabajo.
Esta misma reacción puede llevarse a cabo utilizando la célula galvánica que se ilustra en la figura \(\PageIndex{3a}\N). Para montar la célula, se introduce una tira de cobre en un vaso de precipitados que contiene una solución 1 M de iones Cu2+, y se introduce una tira de zinc en otro vaso de precipitados que contiene una solución 1 M de iones Zn2+. Las dos tiras de metal, que sirven de electrodos, están conectadas por un cable, y los compartimentos están conectados por un puente de sal, un tubo en forma de U insertado en ambas soluciones que contiene un electrolito líquido o gelificado concentrado. Los iones del puente salino se seleccionan de forma que no interfieran en la reacción electroquímica oxidándose o reduciéndose ellos mismos o formando un precipitado o un complejo; los cationes y aniones comúnmente utilizados son Na+ o K+ y NO3- o SO42-, respectivamente. (Los iones del puente salino no tienen por qué ser los mismos que los del par redox en cualquiera de los dos compartimentos). Cuando se cierra el circuito, se produce una reacción espontánea: el zinc metálico se oxida a iones Zn2+ en el electrodo de zinc (el ánodo), y los iones Cu2+ se reducen a Cu metálico en el electrodo de cobre (el cátodo). A medida que la reacción avanza, la tira de zinc se disuelve y la concentración de iones Zn2+ en la solución de Zn2+ aumenta; simultáneamente, la tira de cobre gana masa y la concentración de iones Cu2+ en la solución de Cu2+ disminuye (Figura \PageIndex{3b}). De este modo, hemos llevado a cabo la misma reacción que con un solo vaso de precipitados, pero esta vez las semirreacciones oxidativa y reductora están físicamente separadas entre sí. Los electrones que se liberan en el ánodo fluyen a través del cable, produciendo una corriente eléctrica. Por lo tanto, las células galvánicas transforman la energía química en energía eléctrica que puede utilizarse para realizar un trabajo.
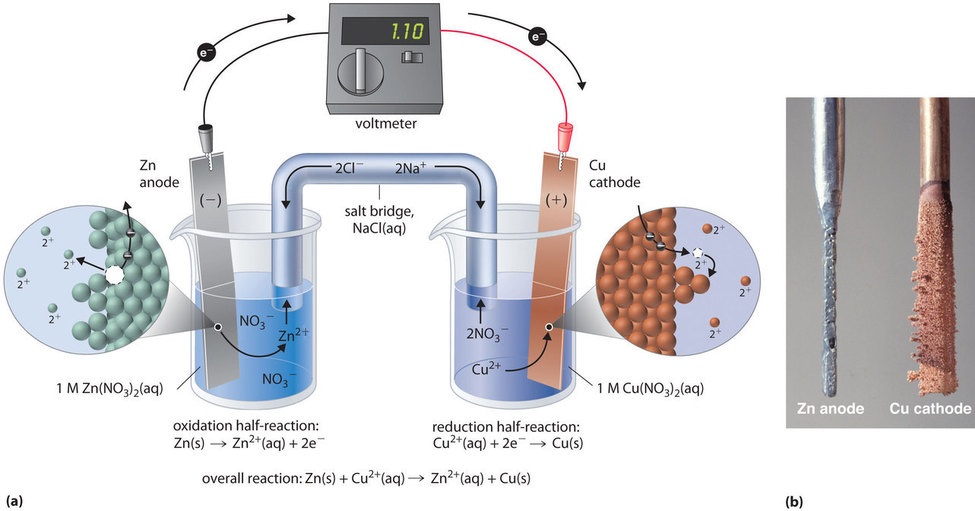
El electrolito en el puente salino cumple dos propósitos: completa el circuito transportando la carga eléctrica y mantiene la neutralidad eléctrica en ambas soluciones permitiendo que los iones migren entre ellas. La identidad de la sal en un puente salino no es importante, siempre que los iones componentes no reaccionen o sufran una reacción redox en las condiciones de funcionamiento de la célula. Sin esta conexión, la carga positiva total en la solución de Zn2+ aumentaría al disolverse el metal de zinc, y la carga positiva total en la solución de Cu2+ disminuiría. El puente salino permite neutralizar las cargas mediante un flujo de aniones hacia la solución de Zn2+ y un flujo de cationes hacia la solución de Cu2+. En ausencia de un puente salino o alguna otra conexión similar, la reacción cesaría rápidamente porque no se podría mantener la neutralidad eléctrica.
Se puede utilizar un voltímetro para medir la diferencia de potencial eléctrico entre los dos compartimentos. Si se abre el interruptor que conecta los cables al ánodo y al cátodo se evita que fluya una corriente, por lo que no se produce ninguna reacción química. Sin embargo, con el interruptor cerrado, el circuito externo está cerrado y puede fluir una corriente eléctrica del ánodo al cátodo. El potencial (\(E_{cell}\)) de la célula, medido en voltios, es la diferencia de potencial eléctrico entre las dos semirreacciones y está relacionado con la energía necesaria para mover una partícula cargada en un campo eléctrico. En la célula que hemos descrito, el voltímetro indica un potencial de 1,10 V (Figura \(\PageIndex{3a}\)). Como los electrones de la semirreacción de oxidación se liberan en el ánodo, el ánodo de una célula galvánica está cargado negativamente. El cátodo, que atrae los electrones, está cargado positivamente.
No todos los electrodos sufren una transformación química durante una reacción redox. El electrodo puede estar hecho de un metal inerte y altamente conductor, como el platino, para evitar que reaccione durante un proceso redox, donde no aparece en la reacción electroquímica global. Este fenómeno se ilustra en el Ejemplo \(\PageIndex{1}).
Una célula galvánica (voltaica) convierte la energía liberada por una reacción química espontánea en energía eléctrica. Una célula electrolítica consume energía eléctrica de una fuente externa para impulsar una reacción química no espontánea.
Ejemplo \(\PageIndex{1})
Un químico ha construido una célula galvánica que consta de dos vasos de precipitados. Un vaso contiene una tira de estaño sumergida en ácido sulfúrico acuoso, y el otro contiene un electrodo de platino sumergido en ácido nítrico acuoso. Las dos soluciones están conectadas por un puente de sal, y los electrodos están conectados por un cable. La corriente comienza a fluir y aparecen burbujas de un gas en el electrodo de platino. La reacción redox espontánea que se produce se describe mediante la siguiente ecuación química equilibrada:
\Npara esta célula galvánica,
- escriba la semirreacción que se produce en cada electrodo.
- indíquese qué electrodo es el cátodo y cuál el ánodo.
- indicar qué electrodo es el positivo y cuál es el negativo.
Dado: célula galvánica y reacción redox
Se pide: semirreacciones, identidad de ánodo y cátodo, y asignación de electrodo como positivo o negativo
Estrategia:
- Identificar la semirreacción de oxidación y la semirreacción de reducción. A continuación, identifique el ánodo y el cátodo de la semirreacción que se produce en cada electrodo.
- A partir de la dirección del flujo de electrones, asigne cada electrodo como positivo o negativo.
Solución
A En la semirreacción de reducción, el nitrato se reduce a óxido nítrico. (El óxido nítrico reaccionaría luego con el oxígeno del aire para formar NO2, con su característico color rojo-marrón). En la semirreacción de oxidación, el estaño metálico se oxida. Las semirreacciones correspondientes a las reacciones reales que ocurren en el sistema son las siguientes:
reducción:
oxidación: \
Así, el nitrato se reduce a NO, mientras que el electrodo de estaño se oxida a Sn2+.
Como la reacción de reducción ocurre en el electrodo de Pt, éste es el cátodo. A la inversa, la reacción de oxidación ocurre en el electrodo de estaño, por lo que es el ánodo.
B Los electrones fluyen desde el electrodo de estaño a través del cable hasta el electrodo de platino, donde se transfieren al nitrato. El circuito eléctrico se completa con el puente de sal, que permite la difusión de cationes hacia el cátodo y de aniones hacia el ánodo. Como los electrones fluyen desde el electrodo de estaño, éste debe ser eléctricamente negativo. Por el contrario, los electrones fluyen hacia el electrodo de Pt, por lo que ese electrodo debe ser eléctricamente positivo.
Ejercicio \(\PageIndex{1})
Considere una célula galvánica simple que consiste en dos vasos de precipitados conectados por un puente de sal. Un vaso de precipitados contiene una solución de \ce{MnO_4^{}} en ácido sulfúrico diluido y tiene un electrodo de Pt. El otro vaso de precipitados contiene una solución de \ce{Sn^{2+}} en ácido sulfúrico diluido, también con un electrodo de Pt. Cuando los dos electrodos se conectan mediante un cable, fluye la corriente y se produce una reacción espontánea que se describe mediante la siguiente ecuación química equilibrada:
\Npara esta célula galvánica,
- escriba la semirreacción que se produce en cada electrodo.
- Indica qué electrodo es el cátodo y cuál es el ánodo.
- Indica qué electrodo es positivo y cuál es negativo.
Responde a
\ce{Sn^{2+}(aq)} &→ \ce{Sn^{4+}(aq) + 2e^{-}} \end{align*}]
Respuesta b
El electrodo de Pt en la solución de permanganato es el cátodo; el de la solución de estaño es el ánodo.
Respuesta c
El cátodo (electrodo del vaso de precipitados que contiene la solución de permanganato) es positivo, y el ánodo (electrodo del vaso de precipitados que contiene la solución de estaño) es negativo.