- ¿Qué es la acidez?
- ¿Qué es el pH?
- ¿Por qué es importante la acidez?
- Síntomas de un pH demasiado bajo (el sustrato es demasiado ácido)
- Síntomas de un pH demasiado elevado (sustrato demasiado alcalino)
- ¿Qué determina el pH?
- Medir el valor del pH
- Toma de muestras
- Los valores de pH correctos para cada medio
- Corrección del valor del pH
¿Qué es la acidez?
La acidez es esencial para la vida en la tierra. La acidez suele determinar las características, la calidad, la capacidad de absorción y la solubilidad de muchas sustancias. Así funcionan las enzimas, responsables de casi todos los procesos biológicos de los organismos, pero sólo con la acidez correcta. Una pequeña fluctuación en la acidez de la sangre es mortal.
¿Qué es el pH?
El pH (pondus Hydrogenii) indica la acidez o alcalinidad de una solución. El valor del pH suele variar entre 0 y 14. Una solución con un valor de pH entre 0 y 7 es ácida y una entre 7 y 14 es alcalina. El vinagre y la cola tienen un valor de pH inferior a 3. La sosa y el jabón tienen un valor de pH superior a 8. Un valor de pH de 7 se considera neutro. El agua pura a temperatura ambiente tiene un pH de 7. El pH del agua del grifo suele ser un poco más alto debido a la presencia de calcio.
Muchos entornos naturales como nuestra piel, los sustratos de las plantas y los medios nutritivos son ligeramente ácidos y tienen un valor de pH de entre 5 y 6,5. Si nos fijamos en las cosas que le gustan a la gente, vemos que generalmente son sustancias ligeramente ácidas o neutras, como el agua. Las plantas también prefieren las sustancias ligeramente ácidas. Un valor de pH de alrededor de 5,5 se da con tanta frecuencia en la naturaleza que algunos expertos en plantas consideran este valor como «neutro».
¿Por qué es importante la acidez?
La acidez tiene una influencia sustancial en la capacidad de absorción y solubilidad de una serie de elementos alimentarios (véase la figura 1).
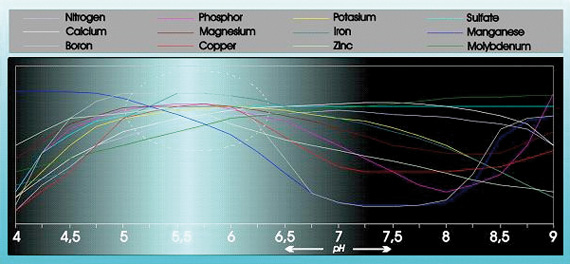
Fig. 1
Además, la acidez tiene una influencia considerable en la estructura, la descomposición de las sustancias orgánicas y la microvida del suelo. El pH también influye en la forma en que los elementos alimenticios, los metales pesados, los pesticidas y otros microorganismos del medio de cultivo son expulsados del suelo.
Un valor de pH demasiado bajo o demasiado alto puede ser perjudicial para sus plantas, por lo que es importante acertar. Pero, ¿cómo saber si el pH es incorrecto? Por experiencia. Así que, para ayudarte, hemos expuesto algunos de los síntomas que puedes observar:
Síntomas de un pH demasiado bajo (el sustrato es demasiado ácido)
- La mayoría de los nutrientes pueden disolverse fácilmente, lo que puede provocar un exceso de manganeso, aluminio y hierro;
- Las deficiencias de fósforo, potasio, magnesio y molibdeno pueden ser causadas por un exceso de aclarado;
- Deficiencia de magnesio, especialmente en sustratos fríos;
- El suelo es generalmente pobre;
- La vida del suelo está inhibida.
Síntomas de un pH demasiado elevado (sustrato demasiado alcalino)
- La mayoría de los nutrientes se disuelven con menos facilidad, provocando la precipitación de compuestos de calcio, hierro y fosfato;
- Reducción de la absorción de manganeso, fosfato y hierro en particular, pero también de cobre, zinc y boro. Esto provocará carencias, sobre todo en medios de cultivo húmedos y fríos.
- En suelos arenosos, la descomposición de las sustancias orgánicas aumenta considerablemente si el pH es elevado.
¿Qué determina el pH?
Uno de los factores más importantes que determinan el valor del pH en una solución o en el sustrato es la capacidad de amortiguación. La capacidad de amortiguación en este caso significa que existe una especie de equilibrio que se restablece continuamente. Por ejemplo, si se pone una gota de ácido en un litro de agua del grifo que tiene un pH de 7, tendrá poca influencia en la acidez. Sin embargo, si se pone una gota de ácido en un litro de agua desmineralizada (agua de la batería), el pH bajará inmediatamente de forma drástica. Esto se debe a que el agua del grifo contiene bicarbonato, mientras que el agua desmineralizada no. El bicarbonato es la sustancia amortiguadora más importante para los valores de pH entre 5,5 y 7,5 en el agua.
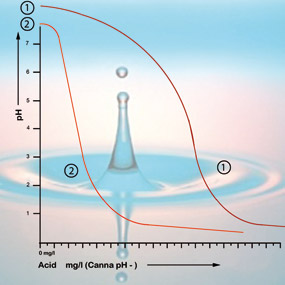 El bicarbonato se une al ácido en la solución que libera dióxido de carbono a la atmósfera. Así se neutraliza el ácido y los cambios en la acidez sólo serán menores mientras siga habiendo bicarbonato.
El bicarbonato se une al ácido en la solución que libera dióxido de carbono a la atmósfera. Así se neutraliza el ácido y los cambios en la acidez sólo serán menores mientras siga habiendo bicarbonato.
Con un valor de pH de 5,3 todo el bicarbonato se ha agotado y la solución no tiene más amortiguadores. El pH es ahora inestable y cambiará inmediatamente si se añade ácido (véase la figura 2). Por lo tanto, la cantidad de ácido que se necesita para conseguir una solución de alimentación con la acidez correcta puede calcularse basándose en el contenido de bicarbonato. El contenido de bicarbonato del agua del grifo es generalmente dado por la compañía de agua en miligramos por litro.
La capacidad de amortiguación y la acidez del sustrato dependen de su composición y frescura. La presencia de materia orgánica, calcio y bicarbonato determinan generalmente el pH. La arcilla siempre contiene carbonato de calcio y tiene un valor de pH relativamente alto y difícil de modificar, mientras que la turba y los suelos arenosos son ácidos.
La propia planta también tiene gran influencia en la acidez. Las raíces segregarán subestados ácidos o alcalinos en función del estado de desarrollo del cultivo, del alimento disponible, de las diferencias de temperatura de las raíces y de la intensidad de la luz. Así que ya ves por qué el pH del entorno de las raíces puede fluctuar constantemente. Un sofisticado equilibrio alimentario durante las diferentes fases de desarrollo mantendrá el pH del entorno de las raíces dentro de unos límites aceptables.
La microvida, los niveles de CO2 y el crecimiento de las algas también pueden tener un efecto sobre la acidez del entorno de las raíces y el tanque de nutrientes.
Medir el valor del pH

Es bastante fácil medir el pH – se necesitan algunos indicadores de pH como el papel tornasol o un juego de pruebas de pH. Estos son relativamente baratos pero no siempre son precisos y a veces pueden desviarse en 1 o 2 unidades de pH. Todos los medidores de pH son generalmente más caros y la precisión depende del tipo de medidor y de la calibración regular con líquido de calibración.
Toma de muestras

El pH del agua utilizada para regar las plantas es importante, pero la acidez alrededor de las raíces es esencial. Así que cuando se mide el pH es muy importante tomar la muestra de forma correcta para obtener buenos resultados. La muestra tiene la acidez de la edad en el entorno de las raíces.
Es fácil tomar muestras y medir el pH en un sistema de recirculación, simplemente se mide la solución de alimentación recirculada.
En los sistemas de sustrato sin recirculación, la solución de alimentación se extrae del sustrato (lana de roca, agroespuma, etc.) en varios lugares. Los expertos llevan un año y un día discutiendo la cuestión de dónde tomar las muestras. Recomendamos, al igual que hacen varios laboratorios de renombre, tomar muestras de los lugares donde están las raíces, es decir, debajo y alrededor del gotero. Tome pequeñas muestras de tantos lugares como sea posible. Siempre tome todas las muestras al mismo tiempo y preferiblemente después de la segunda alimentación por goteo durante el ciclo de luz – día -.
 En sustratos de tierra, coco y turba sólo tome una pequeña cantidad de sustrato de varios lugares.
En sustratos de tierra, coco y turba sólo tome una pequeña cantidad de sustrato de varios lugares.
La mejor manera de medir la acidez de su muestra es utilizando el método de «extracto de volumen 1:1,5». Puede hacerlo usted mismo fácilmente haciendo que el medio de cultivo esté tan húmedo que el agua se escurra entre los dedos al amasarlo y apretarlo con fuerza (foto 1). Utilice, por ejemplo, un vaso de precipitados de 250 ml. Llena el vaso de medida hasta 150 ml con agua desmineralizada. Añade el medio de cultivo hasta que el volumen sea de 250 ml (foto 2). Agítalo bien y déjalo reposar durante unas horas. A continuación, fíltrelo y mida el pH.

Los valores de pH correctos para cada medio
Cuando se cultiva en sustrato los valores de pH de entre 5,0 y 6,4 están bien para el entorno de las raíces. No habrá efectos adversos si los valores son un poco más altos o más bajos. Sólo se observarán efectos adversos inmediatos con valores inferiores a 4 y superiores a 8, un valor de pH inferior a 4 suele provocar daños inmediatos en las raíces. Además, los metales pesados, incluidos el manganeso y el hierro, se absorben tan bien que pueden envenenar la planta (necrosis). Los valores entre 7 y 8 no son inmediatamente perjudiciales para la planta. Los nutrientes como el hierro, el fosfato y el manganeso están menos disponibles entonces, lo que provocará carencias (clorosis y problemas de desarrollo) a largo plazo.
Corrección del valor del pH
 Si la acidez en el entorno de las raíces está entre 5 y 6,4, entonces el pH de su entorno de cultivo está bien y no tiene que tomar ninguna medida correctiva. Intenta evitar corregir el pH a menos que sea realmente necesario. Es más probable que haga daño que bien; a la planta le gusta la tranquilidad. Es más importante vigilar cómo cambia la acidez durante un periodo más largo. Si el valor cae por debajo de pH 5 o sube por encima de pH 6,4, entonces es aconsejable empezar a hacer ajustes gradualmente.
Si la acidez en el entorno de las raíces está entre 5 y 6,4, entonces el pH de su entorno de cultivo está bien y no tiene que tomar ninguna medida correctiva. Intenta evitar corregir el pH a menos que sea realmente necesario. Es más probable que haga daño que bien; a la planta le gusta la tranquilidad. Es más importante vigilar cómo cambia la acidez durante un periodo más largo. Si el valor cae por debajo de pH 5 o sube por encima de pH 6,4, entonces es aconsejable empezar a hacer ajustes gradualmente.
Corregir la acidez se hace más fácilmente bajando la acidez de la solución de alimentación con ácido nítrico durante la fase de crecimiento y ácido fosfórico durante la fase de floración o, según el caso, subirla con potasa cáustica, bicarbonato de sodio y CANNA RHIZOTONIC. Asegúrese de que el pH de la solución que se utilice no descienda demasiado por debajo de 5,0. Al cultivar en lana de roca, las fibras se verán perjudicadas y se liberará una gran cantidad de material alcalino con valores de pH muy bajos. Además, el pH es más difícil de controlar debido a la ausencia de bicarbonato
Un pH alto en el entorno de las raíces también puede ser causado por el bicarbonato que se ha acumulado. Para remediarlo, mantenga un 20% de drenaje o enjuague con una solución más ácida.
Es útil anotar las mediciones de pH tanto de la solución añadida como de la solución de alimentación en el sustrato. Tendrá una buena idea de la progresión del pH y del efecto de las medidas tomadas.
- Las enzimas que dividen las proteínas necesitan un entorno ácido (jugos gástricos) y las enzimas que dividen los carbohidratos necesitan un entorno alcalino (saliva).
- La acidez de una solución viene determinada por la relación entre los iones de hidrógeno (= ácido) y los iones de hidróxido (= alcalino).
- Se pueden producir carencias porque la planta tiene que segregar protones para poder absorber estas moléculas. Un medio de cultivo con un pH bajo ya tiene una gran cantidad de protones. Estos elementos también se aclaran porque los protones repelen las moléculas del medio en el sustrato.
- El bicarbonato es la sustancia que, combinada con el calcio, es responsable del sarro. En combinación con el sodio, el bicarbonato se utiliza en los medicamentos para contrarrestar el exceso de ácido gástrico (Alka-seltzer).
- Algunos laboratorios trabajan también con la dureza del bicarbonato. Para traducir esto a mg/l de bicarbonato hay que multiplicar la dureza de bicarbonato por 21,8.
Por ejemplo: la dureza de bicarbonato es de 11, entonces 1 litro de agua contiene (11 x 21.8=) 240 mg/litro de bicarbonato. -
Suelo arenoso: Tierra de césped pH 4,6 … 5,2 Tierra de construcción pH 5,0 … 5.6 Arcilla: Arcilla marina pH 6,0 … 7,2 Arcilla de río pH 6,2 … 6,4 Arcilla: Sin procesar pH 4.0 - Si hay un crecimiento importante de algas, el pH aumentará porque se eliminará el dióxido de carbono de la solución. Las bacterias pueden transformar ciertas formas de nitrógeno para que tengan un efecto acidificante. Grandes cantidades de CO2 en el aire generan más dióxido de carbono en la solución de alimentación y viceversa.
- Utilice sólo sosa en pequeñas cantidades, porque contiene sodio, y las plantas sólo necesitan una cantidad muy pequeña de sodio. Recuerde que las altas concentraciones de sodio dañarán la planta.
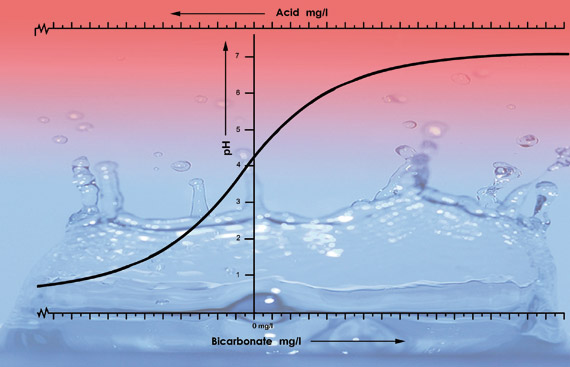
Ilustración de los valores de pH del agua del grifo de varias zonas con diferentes niveles de bicarbonato. Añadimos 33 ml de ácido nítrico (38%) a cada muestra de 100 litros de cada tipo de agua. La curva de pH desciende más rápidamente a partir de pH 5,3 porque en este tipo de agua el ácido neutraliza todo el bicarbonato. Por debajo de pH 5,3 el nivel de acidez se acelera rápidamente.
En los sistemas de recirculación, el valor del pH puede fluctuar más que en los sistemas de circulación. Lo mismo ocurre con el valor de CE, ppm. Si quiere saber más sobre la CE, el pH y las ppm, le aconsejamos que lea nuestro artículo Todo sobre la CE, el pH y las ppm con AQUA.