La diabetes mellitus es cara, pero la mayoría de los costes se atribuyen a las complicaciones y a la atención hospitalaria.1 Según la Asociación Americana de la Diabetes (ADA), en 2012 el coste total estimado de la diabetes fue de 245.000 millones de dólares.1 Se calcula que el 43% corresponde a los costes de hospitalización y otro 18% a las recetas para controlar las complicaciones de la diabetes.1
La mayoría de estas complicaciones pueden prevenirse con un control específico de la glucosa. Los datos epidemiológicos demuestran que por cada punto porcentual de disminución de la hemoglobina A1c (HbA1c), se produce una reducción del 35% del riesgo de complicaciones microvasculares.2 La buena noticia es que las tasas de complicaciones en la diabetes se han reducido,3 pero esto se ha visto superado por el gran aumento del número de personas con diabetes que evolucionan con complicaciones.
Muchas personas con diabetes tipo 2 pueden tener una complicación relacionada con la diabetes en el momento del diagnóstico. Tanto en la diabetes de tipo 1 como en la de tipo 2, algunas de las complicaciones, como la retinopatía y la nefropatía, son silenciosas. Esto requiere un enfoque agresivo porque esperar a que aparezcan los síntomas será demasiado tarde. Incluso la neuropatía diabética será asintomática en hasta el 50% de las personas con anomalías medibles.4
Este artículo revisará las recomendaciones de los Estándares de Atención de la ADA de 2017 para las complicaciones microvasculares y las declaraciones de posición pertinentes, y destacará el cribado preventivo y las perlas clínicas para el médico de atención primaria que trata a los pacientes con diabetes.
- Retinopatía diabética
- Tabla 1. Etapas de la retinopatía con descripción
- Perlas clínicas
- Enfermedad renal por diabetes
- Tabla 2. Selección de estudios de referencia que demuestran un control glucémico con A1c por debajo del 7%
- Tabla 3. TFG estimada con estadio y descripción
- Tabla 4. Categorías de albuminuria en la ERC
- Figura 1. Frecuencia de evaluación sugerida (número de veces al año) por categoría de TFGe y albuminuria
- Tabla 5. Banderas rojas que sugieren enfermedad glomerular no diabética
- Tabla 6. Ajustes de dosis y recomendaciones para los agentes reductores de la glucosa en pacientes con insuficiencia renal
- Clase
- Medicación
- Perlas clínicas
- Neuropatía periférica diabética
- Tabla 7. Otras causas de neuropatía67
- Tabla 8. Agentes farmacológicos comúnmente utilizados para la DPN4,69
- Perlas clínicas
- Gastroparesia
- Perlas clínicas
- Quiroartropatía diabética
- Conclusión
Retinopatía diabética
La retinopatía diabética es una complicación microvascular común de la diabetes tipo 1 y tipo 2. Se calcula que 3,7 millones de personas en todo el mundo tienen una discapacidad visual de moderada a grave a causa de la retinopatía diabética, y más de 800.000 personas en todo el mundo son ciegas a causa de la retinopatía diabética.5 Es la causa más frecuente de ceguera de nueva aparición en adultos de entre 20 y 74 años de edad.6 Se han establecido fuertes correlaciones con el control glucémico, el control de la presión arterial y la duración de la enfermedad. Mediante la detección precoz y periódica y el control de estos factores de riesgo, la retinopatía diabética puede detectarse y tratarse para prevenir el deterioro visual.
La duración de la diabetes es el mayor factor de riesgo para la progresión de la retinopatía diabética. En la diabetes tipo 1, la retinopatía es rara en los primeros 3-5 años o antes de la pubertad.7 En los siguientes 20 años, casi todos los pacientes con diabetes tipo 1 desarrollarán retinopatía diabética.7 En los pacientes con diabetes tipo 2, hasta el 21% tendrá algún grado de retinopatía en el momento del diagnóstico.7 La hiperglucemia crónica, la nefropatía, la hipertensión y la dislipidemia son otros factores que aumentan el riesgo de retinopatía diabética o se asocian a ella.8 Hasta el 50% de los pacientes con albuminuria (independientemente del nivel de la tasa de filtración glomerular estimada) tendrán retinopatía.9 En la tabla 1 se describen los distintos estadios de la retinopatía.
Tabla 1. Etapas de la retinopatía con descripción |
|
|
Etapa |
Descripción |
|
Leve noRetinopatía diabética no proliferativa |
Microaneurismas presentes |
|
Retinopatía diabética no proliferativa moderada |
Microaneurismas, hemorragias de puntos o manchas en la retina, exudados duros, o manchas de algodón pueden estar presentes |
|
Retinopatía diabética no proliferativa grave |
Hemorragias intrarretinianas, cordones venosos o anomalías microvasculares intrarretinianas pueden estar presentes |
|
Retinopatía diabética proliferativa |
Presencia de neovascularización, hemorragias vítreas o prerretinianas |
Fisiopatología. Las anomalías no proliferativas leves, caracterizadas por un aumento de la permeabilidad vascular, pueden progresar a una retinopatía diabética no proliferativa (NPDR) de moderada a grave.7 La retinopatía diabética proliferativa se caracteriza por la proliferación de nuevos vasos sanguíneos retinianos.7 El edema macular, que es un engrosamiento central de la retina con exudación y edema, puede presentarse en cualquier fase de la retinopatía.7 La retinopatía diabética puede acelerarse con el embarazo, la pubertad, la falta de control glucémico, la hipertensión y la cirugía de cataratas.7
Prevención de la retinopatía diabética. El control glucémico es clave para la prevención de la retinopatía diabética. En el ensayo Diabetes Control and Complications Trial (DCCT), los investigadores evaluaron el efecto de un control glucémico estricto y la progresión de una retinopatía nula o mínima al inicio a una retinopatía moderada.10 Para los pacientes del grupo de terapia intensiva sin retinopatía al inicio, el riesgo medio de retinopatía se redujo en un 76% en 36 meses.10 Entre los pacientes del grupo de terapia intensiva que ya presentaban una NPDR de mínima a moderada, el riesgo de progresión se redujo en un 54% con respecto a los que utilizaban el tratamiento convencional.10 En el ensayo original Action to Control Cardiovascular Risk in Diabetes (ACCORD), los participantes con diabetes tipo 2 durante 10 años y enfermedad cardiovascular conocida fueron asignados al azar a una terapia intensiva o estándar para la glucemia, la presión arterial sistólica y la dislipidemia. Cuatro años después, la progresión de la retinopatía se redujo en aquellos con un control glucémico intensivo previo, independientemente de que los niveles actuales de HbA1c fueran similares.11 No se observaron efectos heredados similares en aquellos grupos con un control intensivo de la presión arterial o con fenofibrato para la dislipidemia.11
Control. Dado que el edema macular y la retinopatía diabética proliferativa pueden ser asintomáticos, el cribado es vital para la detección y el tratamiento tempranos. En el caso de los pacientes con diabetes de tipo 1, el cribado debe iniciarse cinco años después del diagnóstico.8 En el caso de los pacientes con diabetes de tipo 2, el cribado debe iniciarse en el momento del diagnóstico.8 El cribado debe ser realizado por un oftalmólogo u optometrista con experiencia en retinopatía diabética. El cribado debe realizarse con los ojos dilatados. Si la retinopatía ya está presente, se recomienda la derivación a un oftalmólogo.8 Se debe repetir la evaluación anualmente si se encuentra una enfermedad mínima o ninguna.8
El embarazo es un momento de alto riesgo para la retinopatía proliferativa. En las mujeres embarazadas con diabetes tipo 1 o tipo 2 preexistente, los exámenes oculares deben realizarse antes de la concepción o en el primer trimestre. Los exámenes deben repetirse cada trimestre y durante un año después del parto.8 En el caso de las mujeres con diabetes gestacional, no es necesario realizar exámenes oculares adicionales después del parto.
El embarazo en pacientes con diabetes tipo 1 o tipo 2 preexistente puede dar lugar a una rápida progresión de la retinopatía diabética. Esto es especialmente cierto si hay un mal control glucémico en el momento de la concepción.14 Las mujeres con diabetes que están embarazadas o que planean quedarse embarazadas deben ser asesoradas sobre el riesgo de desarrollo o progresión de la retinopatía diabética y la necesidad de control glucémico antes de la concepción.8 Sin embargo, puede producirse un empeoramiento precoz de la retinopatía con la aplicación rápida de un control glucémico intensivo si la retinopatía ya está presente.8 La diabetes gestacional no parece conferir el mismo riesgo de desarrollar retinopatía diabética durante el embarazo.8
Tratamiento. Además del control glucémico, también se ha demostrado que el control de la presión arterial (< 140 mmHg sistólica) disminuye la progresión de la retinopatía diabética, pero no existe ningún beneficio adicional del control estricto de la presión arterial sistólica < 120 mmHg.12 El fenofibrato también puede ralentizar la progresión de la retinopatía diabética, especialmente con una NPDR muy leve, en pacientes con dislipidemia.13 Se ha demostrado que la aspirina no tiene ningún efecto sobre la progresión de la retinopatía, el desarrollo de la hemorragia vítrea o la duración de la misma, y puede utilizarse de forma segura para otras indicaciones médicas sin compromiso ocular.7
El tratamiento de los pacientes con diabetes debe incluir recomendaciones de ejercicio. Aquellos con retinopatía no proliferativa leve pueden comenzar a realizar actividad física con seguridad. Sin embargo, los pacientes con retinopatía no proliferativa moderada deben evitar las actividades que aumenten en gran medida la presión arterial, como el levantamiento de pesas.15 Los pacientes con retinopatía no proliferativa grave o inestable deben evitar cualquier actividad física vigorosa (saltos, sacudidas), cualquier actividad con la cabeza hacia abajo y la contención de la respiración.15 En el caso de la hemorragia vítrea, no debe realizarse ningún ejercicio.15
La detección temprana de la retinopatía diabética es importante porque el tratamiento puede prevenir o revertir la pérdida de visión. En el Estudio de Retinopatía Diabética (DRS), los investigadores descubrieron que la cirugía de fotocoagulación era un tratamiento eficaz para la retinopatía diabética. El estudio Early Treatment Diabetic Retinopathy y el DRS demostraron que la fotocoagulación disminuía el riesgo de pérdida de visión, y que el mayor beneficio se producía en los pacientes que tenían una enfermedad de base más avanzada.16,17 Los datos actuales proporcionan pruebas de que los agentes del factor de crecimiento endotelial intravítreo (anti-VEGF) son más eficaces en el tratamiento del edema macular que la monoterapia o la terapia combinada con la coagulación con láser.8 Además, el anti-VEGF puede mejorar la visión, mientras que la fotocoagulación sólo previene una mayor pérdida de visión.18,19 Un inconveniente del anti-VEGF es que requiere una terapia intravítrea mensual durante los primeros 12 meses.
Perlas clínicas
- No hay signos o síntomas específicos de retinopatía diabética temprana.
- El cribado de la retinopatía diabética debe realizarse en pacientes:
– con diabetes tipo 1 cinco años después del diagnóstico.
– en pacientes con diabetes tipo 2 en el momento del diagnóstico.
- Se debe proporcionar asesoramiento y aumentar los exámenes a las mujeres diabéticas que planean quedarse o se quedan embarazadas, porque la retinopatía diabética puede acelerarse rápidamente durante el embarazo.
- Un control glucémico estricto y un control de la presión arterial (< 140 mmHg sistólica) pueden prevenir el desarrollo de la retinopatía diabética.
- Hasta el 50% de los pacientes con albuminuria (independientemente del nivel de FGe) tendrán retinopatía.9
- El tratamiento con fotocoagulación puede prevenir la progresión de la enfermedad y el tratamiento con anti-VEGF puede revertir la pérdida de visión por edema macular.
Enfermedad renal por diabetes
La enfermedad renal por diabetes (DKD), la terminología preferida por la ADA, es la principal causa de enfermedad renal crónica (CKD) en los Estados Unidos.20,21 La ERC tiene importantes efectos a largo plazo en la calidad de vida de los pacientes con diabetes y es responsable de hasta el 40% de la enfermedad renal terminal (ERT).20 Basándose en la Iniciativa de Calidad de los Resultados de la Enfermedad Renal (KDOQI, por sus siglas en inglés) de la Fundación Nacional del Riñón y en los Estándares de Atención de la ADA de 2017, esta sección proporcionará orientación sobre los niveles objetivo de HbA1c, el manejo de la medicación y el tratamiento terapéutico para los pacientes con DKD.
La KDOQI estratifica el nivel objetivo de HbA1c según el riesgo de hipoglucemia y las comorbilidades del paciente. Esta iniciativa se basa en tres publicaciones que demuestran que el control glucémico con HbA1c por debajo del 7% previene o disminuye la progresión de la enfermedad renal en pacientes con diabetes tipo 2.22,23,24 Estos estudios se resumen en la tabla 2. La ADA recomienda que, en los pacientes con mayor riesgo de hipoglucemia, el objetivo de HbA1c se eleve por encima del 7%.8 La KDOQI recomienda que los pacientes con ERC en estadio 4 y 5 que tienen una esperanza de vida limitada mantengan una HbA1c superior al 7%.25
Tabla 2. Selección de estudios de referencia que demuestran un control glucémico con A1c por debajo del 7% |
|
|
Ensayo |
Resultados |
|
Acción en diabetes y enfermedad vascular: Evaluación Controlada de Preterax y Diamicron de Liberación Modificada (ADVANCE)22 |
Reducción del 21% de la nueva macroalbuminuria y de la terapia de sustitución renal con A1c inferior al 7% |
|
Tratamiento de la Diabetes de los Veteranos (VADT)23 |
Reducción del 37% de la macroalbuminuria y 32% de reducción de la microalbuminuria con A1c inferior al 7% |
|
El estudio Action to Control Cardiovascular Risk in Diabetes (ACCORD)24 |
Reducción del 2% de la macroalbuminuria y del 21% de la microalbuminuria con A1c inferior al 7% |
Epidemiología. Hombres y mujeres se ven igualmente afectados por la DNC.20 La incidencia máxima de desarrollo de la DNC se produce 15 años después del diagnóstico.21 Los afroamericanos tienen entre tres y cinco veces más probabilidades de desarrollar nefropatía diabética que los caucásicos.20 Los estadounidenses de origen mexicano y los indios Pima también tienen un mayor riesgo de desarrollar DNC.20
La proteinuria es un factor predictivo de la morbilidad cardiovascular y de la mortalidad por todas las causas en la diabetes.21 La presencia de DNC es un factor de mayor riesgo de enfermedad cardiovascular. Los pacientes con DMD se enfrentan sistemáticamente a tasas de mortalidad por enfermedades cardiovasculares.26 Además, la mortalidad por todas las causas es mayor en los pacientes con DMD.21
En la diabetes de tipo 1, las complicaciones microvasculares como la DMD comienzan a desarrollarse aproximadamente entre 10 y 20 años después del diagnóstico; en la diabetes de tipo 2, a menudo se desconoce el inicio exacto y, por lo tanto, se justifica un cribado más temprano.27
Patofisiología y patogénesis. Se cree que la hiperglucemia induce tres cambios histológicos principales en los glomérulos que conducen a la DKD: 1) expansión mesangial, 2) engrosamiento de la membrana basal glomerular, y 3) esclerosis glomerular.28 Aunque se desconoce la patogénesis exacta de por qué se produce la DKD, se cree que la hiperglucemia provoca inicialmente hiperfiltración y lesión renal como resultado de los cambios histológicos y la activación de las citocinas.20 Por lo general, la albuminuria puede ser el primer signo de la enfermedad renal crónica.29
Esta situación se agrava aún más como resultado de las condiciones comórbidas de hiperlipidemia, arteriosclerosis, hipertensión y obesidad, que contribuyen a la lesión renal y al subsiguiente deterioro de la función. La obesidad central conduce a la hipertensión a través de la hiperactivación del sistema renina-angiotensina-aldosterona y del sistema nervioso simpático.20 Además, a medida que la vasculatura renal se vuelve arteriosclerótica, se produce una mayor progresión de la nefropatía diabética. Un rasgo distintivo importante de la nefropatía diabética en comparación con otras formas de ERC es que los glomérulos y los riñones suelen tener un tamaño normal o aumentado inicialmente.20
Clasificación. Tanto la TFGe como la presencia de albuminuria se utilizan para clasificar la ERC.30,31 La TFGe se basa en la raza, la edad, el sexo, el peso y los niveles de creatinina sérica. (Véase la tabla 3.) Históricamente, el término microalbuminuria se utilizaba para definir los niveles de albúmina moderadamente elevados. La Fundación Nacional del Riñón recomienda ahora el uso de los términos «leve», «moderado» o «gravemente aumentado» para describir los niveles de albuminuria basándose en los niveles representados en la Tabla 4.31 El cociente albúmina-creatinina es la prueba inicial utilizada para detectar la albuminuria.
Tabla 3. TFG estimada con estadio y descripción |
||
|
Estadio |
TFG (mL/min por 1.73 m2) |
Descripción |
|
90+ |
Hiperfiltración glomerular |
|
|
Función renal ligeramente reducida |
||
|
3A |
Función renal moderadamente reducida |
|
|
3B |
||
|
Función renal gravemente reducida |
||
|
< 15 o en diálisis |
Insuficiencia renal enestadio de insuficiencia renal |
|
Tabla 4. Categorías de albuminuria en la ERC |
||
|
Categoría |
Albúmina-aCreatinina |
Descripción |
|
A1 |
< 30 |
Normal a ligeramente aumentado |
|
A2 |
Moderadamente aumentada |
|
|
A3 |
> 300 |
Severamente aumentada |
Los dos esquemas de clasificación representan la doble vía para desarrollar la ERC. Una es a través de la elevación de la creatinina y el empeoramiento de la TFG. La otra es a través del desarrollo de la albuminuria. El aumento de la albuminuria suele ir seguido de un descenso del FGe;32 sin embargo, esto puede evitarse mediante el uso de inhibidores de la enzima convertidora de la angiotensina (IECA) o bloqueadores de los receptores de la angiotensina (BRA) y el control de la glucemia. (Véase la figura 1.)
Figura 1. Frecuencia de evaluación sugerida (número de veces al año) por categoría de TFGe y albuminuria
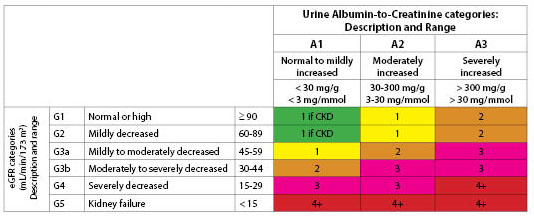
Reproducido con permiso de Kidney Disease: Improving Global Outcomes (KDIGO).
Síntomas comunes. La mayoría de las personas no presentan síntomas de nefropatía diabética. A menudo, los pacientes pueden tener indicios o el diagnóstico de otras complicaciones microvasculares.20 La DNC temprana suele ser asintomática. Un hallazgo tardío de la nefropatía diabética es la orina espumosa. Además, si un paciente es gravemente hipoalbuminémico, puede presentar edema pedal y fatiga.20 Los pacientes con DKD suelen tener hipertensión sistémica. Los pacientes con nefropatía diabética suelen presentar también retinopatía y neuropatía.8
Opciones de diagnóstico. Dado que no hay síntomas, el cribado rutinario es fundamental. La ADA recomienda realizar un cribado anual de la relación albúmina-creatinina en orina.8 Además, al menos una vez al año, debe comprobarse la TFGe en pacientes con diabetes tipo 1 con una duración de cinco años y entre todos los pacientes con diabetes tipo 2 o pacientes con hipertensión y diabetes comórbidas.8 No existe una recomendación clara para obtener imágenes, como una ecografía, para el diagnóstico de la DKD.
Diagnóstico diferencial. Algunas señales de alarma pueden sugerir que la diabetes no es la única causa de la ERC. Si una persona tiene una ERC avanzada sin evidencia de otras complicaciones microvasculares, esto es una advertencia. La proteinuria manifiesta con aparición súbita (menos de cinco años después del inicio de la diabetes) de un sedimento de orina con glóbulos rojos y cilindros dismórficos, o una disminución brusca de la TFG, sugieren una enfermedad renal de etiología no diabética.20 Puede realizarse una electroforesis sérica o urinaria si existe la preocupación de un mieloma múltiple. La ausencia de albuminuria con una TFG reducida y diabetes requiere la investigación de otras causas de ERC distintas de la ERC.21 La Tabla 5 enumera las banderas rojas que sugieren una enfermedad glomerular no diabética.
Tabla 5. Banderas rojas que sugieren enfermedad glomerular no diabética
- Inicio de proteinuria < 5 años desde el inicio documentado de la diabetes tipo 1 o inicio agudo de la enfermedad renal
- Declive agudo de la TFGe; nefropatía diabética
- Sedimento urinario que contiene glóbulos rojos dismórficos o cilindros celulares
- Ausencia de otras complicaciones microvasculares como neuropatía o retinopatía
- Signos y/o síntomas de otra enfermedad sistémica
Tratamiento. Una característica de la nefropatía diabética es el control de la glucosa, la reducción de la sal, la presión arterial y la dislipidemia. Además, los pacientes deben evitar los medicamentos y suplementos nefrotóxicos, como los aminoglucósidos y los antiinflamatorios no esteroideos. Los pacientes deben ser remitidos a un nefrólogo en el estadio IV de la enfermedad renal o si se produce un rápido deterioro de la función renal. Otras indicaciones de derivación dependen de la complejidad del caso. Los nuevos medicamentos orales para la diabetes pueden ayudar a prevenir la progresión de la insuficiencia renal.
Control de la glucemia. La selección de fármacos, la monitorización y la farmacología se ven afectadas en los pacientes con nefropatía diabética. A medida que el FGe del paciente disminuye, algunos agentes orales requerirán un ajuste de la dosis. La insulina sigue siendo el tratamiento central para el control de la glucosa en pacientes con diabetes y ERC avanzada.31 La tabla 6 muestra los ajustes de dosis recomendados para los medicamentos antiglucémicos en pacientes con enfermedad renal. En 2016, tanto empagliflozina como canagliflozina demostraron reducir la progresión de la ERC y la microalbuminuria.33,34 La empagliflozina disminuyó las tasas de progresión de la nefropatía y redujo el riesgo de eventos cardiovasculares adversos mayores en comparación con el placebo cuando se añadió a la atención estándar de la diabetes tipo 2 en el histórico estudio de resultados Empagliflozin Cardiovascular Outcome Event Trial in Type 2 Diabetes Mellitus Patients (EMPA-REG).33
Tabla 6. Ajustes de dosis y recomendaciones para los agentes reductores de la glucosa en pacientes con insuficiencia renal |
||
|
Agentes reductores de la glucosaAgentes reductores de la glucosa |
Ajustes de la dosis en la insuficiencia renal |
|
Clase |
Medicación |
|
|
Biguanidas |
Metformina |
FGe 30 a 45 mL/min/1.73 m2: No se recomienda iniciar la terapia. Si después de la iniciación, evaluar los beneficios/riesgos de continuar la terapia. eGFR < 30 mL/min/1,73 m2: Su uso está contraindicado |
|
Sulfonilureas |
Glimepirida |
Deterioro leve a moderado: Iniciar con 1 mg una vez al día Deterioro severo: Su uso está contraindicado |
|
Glipizida |
Liberación prolongada: Iniciar con 2,5 mg una vez al día |
|
|
Gliburida |
FGe < 60 mL/min/1,73 m2: No se recomienda su uso |
|
|
Meglitinidas |
Nateglinida |
Sin ajuste de dosis necesario |
|
Repaglinida |
CrCl 20 a 40 mL/min: Iniciar con 0.5 mg con las comidas CrCl < 20 mL/min: Sin información |
|
|
Tiazolidinediones |
Pioglitazona |
No es necesario ajustar la dosis necesario |
|
Rosiglitazona |
No es necesario ajustar la dosis |
|
|
α-Inhibidores de la glucosidasa |
Acarbosa |
SCr > 2.0 mg/dL: No se recomienda su uso |
|
Miglitol |
CrCl < 25 mL/min o SCr >2.0 mg/dL: No se recomienda su uso |
|
|
Inhibidores de la PDP-4 |
Alogliptina |
CrCl 30 a 60 mL/min: 12.5 mg una vez al día CrCl < 30 mL/min: 6,25 mg una vez al día Dependencia renal crónica que requiere hemodiálisis: 6.25 mg una vez al día y administrar sin tener en cuenta el horario de la hemodiálisis |
|
Linagliptina |
No es necesario ajustar la dosis |
|
|
Saxagliptina |
CrCl ≤ 50 mL/min: 2.5 mg una vez al día
Dependencia renal crónica que requiera hemodiálisis: 2.5 mg una vez al día y administrar después de la hemodiálisis |
|
|
Sitagliptina |
CrCl 30 a 50 mL/min: 50 mg una vez al día CrCl < 30 mL/min: 25 mg una vez al día Dependencia renal crónica que requiera hemodiálisis o diálisis peritoneal: 25 mg una vez al día y administrar sin tener en cuenta el horario de la hemodiálisis |
|
|
Vildagliptina |
CrCl < 50 mL/min: 50 mg una vez al día |
|
|
Secuestradores de ácidos biliares |
Colesevelam |
No es necesario ajustar la dosis |
|
Dopamina-2 |
Bromocriptina |
Sin información |
|
Inhibidores de la SGLT-2 |
Canagliflozina |
FGe 45 a 60 mL/min/1.73 m2: No exceder de 100 mg una vez al día FGe < 45 mL/min/1,73 m2: No se recomienda iniciar la terapia. Si después de la iniciación, interrumpir la terapia para los pacientes con TFGe persistentemente < 45 mL/minuto/1,73 m2. TFGe < 30 mL/min/1,73 m2/ESRD/Hemodiálisis: Su uso está contraindicado |
|
Dapagliflozina |
FGe < 60 mL/min/1,73 m2: No se recomienda iniciar la terapia. Si después de la iniciación, suspender la terapia en pacientes con TFGe persistente entre 30 y < 60 mL/min/1,73 m2. TFGe < 30 mL/min/1,73 m2/ESRD/Hemodiálisis: Su uso está contraindicado |
|
|
Empagliflozina |
FGe < 45 mL/min/1,73 m2: No se recomienda iniciar la terapia. Si después de la iniciación, suspender la terapia en pacientes con TFGe persistentemente < 45 mL/min/1,73 m2. TFGe < 30 mL/min/1,73 m2. República Democrática del Congo/ Hemodiálisis: Su uso está contraindicado |
|
|
GLP-1 |
Albiglutida |
No es necesario ajustar la dosis |
|
Dulaglutida |
No es necesario ajustar la dosis |
|
|
Exenatida |
CrCl 30 a 50 mL/min: No hay información. Utilizar con precaución. CrCl < 30 mL/min/ ESRD: No se recomienda su uso |
|
|
Liraglutida |
Sin información |
|
|
Lixisenatida |
FGe 15 a 29 mL/min/1.73 m2: No hay información. Vigilar el aumento de los efectos adversos gastrointestinales que pueden provocar deshidratación y empeoramiento de la función renal. TFGe <15 mL/min/1.73 m2/ ESRD: No se recomienda su uso |
|
|
Miméticos de la amilina |
Pramlintida |
CrCl ≥15 mL/min: No es necesario ajustar la dosis ESRD: Sin información |
|
Insulinas |
Análogos de rápidaacción rápida
De acción corta
Intermediaacción
Análogos de la insulina basal
|
Las necesidades de insulina pueden reducirse debido a cambios en el aclaramiento o el metabolismo de la insulina. Vigilar estrechamente la glucemia. |
Tensión arterial. El tratamiento de la presión arterial debe comenzar en 140/90 mmHg para los pacientes con diabetes y enfermedad renal diabética.37 El Estudio Prospectivo de la Diabetes del Reino Unido (UKPDS) encontró una reducción del 12% del riesgo de complicaciones diabéticas con cada descenso de 10 mmHg en la presión sistólica hasta que la presión fuera de 120 mmHg.38 Los medicamentos de elección siguen siendo los inhibidores de la ECA o los ARA para los individuos con hipertensión y diabetes, enfermedad renal crónica y enfermedad renal crónica. Se ha demostrado que los inhibidores de la ECA retrasan el desarrollo de la ERC cuando se inician en pacientes con una albuminuria ligeramente elevada. La creatinina puede aumentar hasta un 30% al iniciarse un IECA o un ARA.39 Considere la posibilidad de evaluar otras enfermedades renales subyacentes si la creatinina se eleva más que esto.
Las KDOQI recomiendan no administrar IECA/ARA a pacientes con diabetes tipo 2 que sean normotensos y normoalbuminúricos.40,41,42 Los inhibidores de la ECA o los ARA se sugieren para los pacientes diabéticos que son normotensos con microalbuminuria.31,37 No existe una dosis o titulación específica para estos individuos. No se recomienda el doble bloqueo del sistema renina-angiotensina mediante IECA y ARA debido al mayor riesgo de hiperpotasemia, deterioro de la función renal e hipotensión.43
Reducción de la sal. El ensayo de 2012 sobre la reducción de los criterios de valoración en la diabetes mellitus no insulinodependiente con el antagonista de la angiotensina II Losartán (RENAAL) y el ensayo sobre la nefropatía diabética con Irbesartán (IDNT) demostraron que las dietas bajas en sodio aumentaron los efectos nefroprotectores y cardioprotectores de los ARA en pacientes con diabetes tipo 2 y nefropatía diabética.44,45
Diálisis renal y trasplante renal. Los pacientes con enfermedad renal terminal deben ser remitidos a nefrología. Las opciones de tratamiento incluyen la diálisis peritoneal o la hemodiálisis, el transporte renal o la opción de interrumpir el tratamiento y comenzar los cuidados paliativos o de cuidados paliativos. Un estudio observacional descubrió que los pacientes que iniciaban la diálisis a una edad más temprana (< 60 años) tenían una peor supervivencia.46
Referencia. La figura 1 incluye las indicaciones de derivación basadas en la clasificación de la TFG y la albuminuria. Considerar otras causas de enfermedad renal no relacionadas con la diabetes, especialmente en pacientes con diabetes tipo 1 en los que la aparición de la retinopatía no precede al desarrollo de la nefropatía.21 Los nefrólogos pueden ayudar a aclarar el diagnóstico, controlar la hipertensión resistente y la hiperpotasemia, y preparar a los pacientes para la diálisis.8
También hay que considerar que el desarrollo de la nefropatía puede no estar relacionado con la propia diabetes. En los pacientes con diabetes de tipo 1, la aparición de la retinopatía suele preceder al desarrollo de la nefropatía.47 Una persona que presenta nefropatía pero no retinopatía debe someterse a una evaluación para detectar otras causas. Debe remitirse a un nefrólogo para establecer la causa de la nefropatía cuando no se sabe con certeza o cuando hay problemas relacionados con la ERC difíciles de manejar, como la anemia, el hiperparatiroidismo y la enfermedad renal avanzada con una TFGe < 30 mL/min/1,73 m2.8 Contar con un nefrólogo de consulta cuando se desarrolla la ERC en estadio 4 (TFGe < 30 mL/min/1,73 m2) se asocia con una disminución de la morbilidad, de los costes sanitarios y con el retraso de la diálisis.48 Considerar una derivación en el estadio 3B para preparar a los pacientes antes y para que la nefrología les dé el máximo tratamiento médico.
Perlas clínicas
- El cribado anual de la ERC debe realizarse mediante un análisis de albúmina urinaria y una medición de la TFGe.
- El control de la presión arterial y de la glucosa puede prevenir la progresión de la nefropatía. Mantener la presión arterial < 140/90 mmHg en pacientes con diabetes y ERC. Los inhibidores de la ECA o los ARA deben ser el tratamiento de elección.
- Los inhibidores de la ECA y los ARA no deben utilizarse para prevenir la nefropatía si la presión arterial y la excreción de proteínas son normales. Los inhibidores de la ECA y los ARA no deben utilizarse en combinación.
- Los pacientes con ERC estadios 3-5 tienen un mayor riesgo de hipoglucemia. Debe tenerse precaución con los agentes orales como las sulfonilureas.
- En algunos pacientes con ERC, es apropiado establecer el objetivo de HbA1c >7%, especialmente cuando el riesgo de hipoglucemia es grande.
Neuropatía periférica diabética
Una definición ampliamente aceptada de la neuropatía periférica diabética (NPD) en la práctica clínica es «la presencia de síntomas y/o signos de disfunción nerviosa periférica en personas con diabetes tras la exclusión de otras causas.» 49 La clasificación de la ADA de la polineuropatía simétrica distal es: 1) neuropatía principalmente de fibra pequeña, 2) neuropatía principalmente de fibra grande, y 3) neuropatía mixta de fibra pequeña y grande (la más común).
Patofisiología y patogénesis. El desarrollo y la progresión de la DPN surgen de las complejas relaciones entre los nervios y las células que los rodean.50 Tanto los factores vasculares como las interacciones metabólicas contribuyen a todas las etapas de la DPN.51 El entendimiento generalmente aceptado en la diabetes humana que conduce al desarrollo de la DPN es la compleja interacción entre la hiperglucemia, la duración de la diabetes, los daños neuronales relacionados con la edad, los grados de control de la presión arterial y de los lípidos en sangre, y el peso.52,53,54,55 La hiperglucemia activa numerosas vías bioquímicas que determinan el estado metabólico de una célula nerviosa y se combina con el deterioro de la perfusión nerviosa, contribuyendo a la progresión de las neuropatías. Un ensayo histórico, el DCCT, apoya la importancia de la hiperglucemia en la patogénesis de la neuropatía.10,56,57 Otro mecanismo relacionado con la hiperglucemia que conduce a la DPN es el estrés oxidativo y nitrosativo inducido por la hiperglucemia con un aumento de la producción de radicales libres.58,59
Además de la hiperglucemia, recientemente se ha sugerido que la inflamación de bajo grado puede desempeñar un papel importante en la patogénesis de las neuropatías diabéticas, provocando déficits en las fibras nerviosas periféricas y autonómicas.51,60 El complejo conjunto de factores metabólicos y vasculares desencadena el desequilibrio entre los daños y las reparaciones en las fibras nerviosas, afectando específicamente a las fibras sensoriales distales y contribuyendo a la pérdida gradual de sensibilidad que manifiesta los síntomas clínicos de la polineuropatía diabética.58,61
Síntomas comunes. Cuando se pregunte por los síntomas de la DPN que se experimentan, hay que anotar la localización (lo más probable es que se sienta en las manos y los pies), los factores precipitantes, las características de las molestias, así como el inicio y la frecuencia de la exacerbación nocturna, ya que los síntomas son específicos de cada paciente.4 Tanto las fibras pequeñas como las grandes se ven afectadas por la elevación de la glucosa en sangre, y los síntomas que se experimentan varían en función de la clase de fibras sensoriales afectadas. Cuando las fibras nerviosas afectadas son predominantemente pequeñas, los síntomas que se desencadenan suelen ser dolor (punzante, lancinante, con pinchazos, ardor, aburrido y excesivamente sensible), disestesias (sensaciones desagradables de ardor, hormigueo, pinchazos y punzadas) y entumecimiento.4
La intensidad de las molestias puede variar desde sentir sensaciones anormales menores hasta estar incapacitado por el dolor que puede exacerbarse por la noche y perturbar el sueño, lo que se ha demostrado que se asocia con la depresión debido a la percepción de una menor calidad de vida.4
Por otra parte, cuando se ven afectadas predominantemente las fibras grandes, los pacientes pueden sentir entumecimiento y hormigueo en las extremidades, experimentar una marcha inestable y perder el equilibrio (lo que conduce a posibles caídas).4 Algunos pacientes pueden experimentar el empeoramiento de los síntomas a medida que disminuyen sus niveles de glucosa en sangre debido a la intensificación del tratamiento de la diabetes. Los pacientes pueden ser asintomáticos pero con diversos grados de pérdida sensorial; un resultado indeseable de la pérdida sensorial grave debida a la neuropatía diabética puede ser una lesión indolora, que conduce a un mayor riesgo de ulceración del pie o, en casos graves, a la amputación.62
La forma más común de neuropatía periférica diabética es la polineuropatía simétrica distal con una pérdida progresiva de fibras nerviosas sensoriales.4 El patrón típico de «media» bilateral se crea por los daños que se producen en las porciones más distales de los nervios más largos (que se afectan primero).63,64,65 A medida que avanza el tiempo, se produce un patrón de «media-guante», que promueve la pérdida sensorial y los síntomas típicos de la DPN, a partir del avance proximal de los déficits nerviosos.4
Diagnóstico clínico. El diagnóstico clínico de la DPN puede realizarse a partir de los signos y síntomas neuropáticos de un paciente con diabetes después de excluir otras causas de neuropatía.66 La neuropatía periférica diabética asintomática puede darse hasta en el 50% de los que tienen esta complicación; por lo tanto, la aplicación de los cuidados preventivos de los pies es esencial, especialmente para aquellos que tienen un alto riesgo de sufrir lesiones debido a los pies insensibles.4 En todos los pacientes con diabetes debe realizarse un cribado anual de la DPN mediante pinchazos, temperatura, percepción de vibraciones (utilizando un diapasón de 128 Hz), sensación de presión con monofilamento de 10 g y reflejos tendinosos profundos del tobillo; las posibles úlceras en los pies pueden predecirse por la pérdida de la sensación del monofilamento de 10 g (pérdida de la sensación de protección) y una menor percepción de las vibraciones.63 Las Normas de Atención Médica en la Diabetes-2017 de la ADA siguen recomendando una prueba anual de monofilamento de 10 g con el fin de identificar a los pacientes con riesgo de desarrollar una ulceración y una amputación.8 Además, las directrices de la ADA de 2017 recomiendan el cribado de la DPN en el momento del diagnóstico de la diabetes de tipo 2 y cinco años después del diagnóstico de la diabetes de tipo 1.8
En 2009, el Panel de Consenso de Toronto sobre Neuropatías Diabéticas actualizó los criterios de diagnóstico para proporcionar categorías de diagnóstico. Además, los profesionales sanitarios pueden incluir varios instrumentos de cribado bien validados en el proceso de diagnóstico, como el Michigan Neuropathy Screening Instrument (MNSI), el Toronto Clinical Neuropathy Score y la Utah Neuropathy Scale. La Tabla 7 describe otras causas de neuropatía que deben excluirse.
Tabla 7. Otras causas de neuropatía67
- Alcohol u otras toxinas
- Medicamentos neurotóxicos, especialmente quimioterapia
- Deficiencia de vitamina B12
- Hipotiroidismo
- Enfermedad renal
- Malignidades (mieloma múltiple, carcinoma broncogénico)
- Virus de la inmunodeficiencia humana (VIH)
- Neuropatía desmielinizante inflamatoria crónica, neuropatías hereditarias y vasculitis
Estudios de diagnóstico. Existen varias pruebas diagnósticas para confirmar la presencia de DPN. Los estudios de conducción nerviosa se han considerado durante años como la prueba diagnóstica de referencia para la DPN debido a sus medidas objetivas sin respuestas de los pacientes, lo que conlleva una alta fiabilidad.4 Las pruebas sensoriales cuantitativas evalúan las capacidades de los pacientes para detectar el tacto ligero, la vibración y la discriminación de la temperatura, lo que implica un cierto nivel de subjetividad.4 Otros métodos, como la biopsia de piel y la densidad de fibras nerviosas intraepidérmicas y la microscopía confocal corneal, no se han utilizado de forma rutinaria en la práctica clínica, pero pueden emplearse en los ensayos clínicos.4
Opciones de tratamiento: Tratamiento farmacológico. El tratamiento farmacológico de la DPN es para la mejora sintomática, por lo que los medicamentos utilizados no están destinados a prevenir la progresión. La Tabla 8 resume los medicamentos de las tres clases más utilizadas (anticonvulsivos, antidepresivos y opioides) para controlar los síntomas neuropáticos. Aunque varios agentes se utilizan habitualmente como enfoque inicial para el tratamiento de la DPN, sólo la pregabalina y la duloxetina han sido aprobadas por la FDA para el tratamiento de esta afección; por lo tanto, cualquiera de estos agentes se recomienda como elección inicial para el dolor neuropático sintomático.4 La gabapentina, aunque no está aprobada por la FDA para su uso en el tratamiento de la DPN, se utiliza a menudo como enfoque inicial, que tiene una eficacia comparativa con los agentes aprobados por la FDA. Los antidepresivos tricíclicos (por ejemplo, la amitriptilina) -agentes no aprobados por la FDA para la DPN- son eficaces en el manejo de la DPN, pero deben utilizarse con precaución debido a un mayor riesgo de efectos secundarios.
Tabla 8. Agentes farmacológicos comúnmente utilizados para la DPN4,69 |
|||||
|
Agente farmacológico (rango NNT 30-50% de mejora*) |
Dosis máxima diaria de DNP (mg/día) |
Efectos secundarios comunes |
¿Se necesitan ajustes de la dosis? |
Contraindicaciones |
Consideraciones sobre la prescripción |
|
Anticonvulsivos
|
|||||
|
Pregabalina (3.3-8,3) |
Mareo Somnolencia Aumento de peso Edema periférico Visión borrosa Estreñimiento |
Renal: Sí Hepático: No |
Hipersensibilidad a pregabalina |
Evidencia fuerte; aprobado por la FDA; sustancia controlada |
|
|
Gabapentina (3.3-7.2) |
3,600 |
Mareos Ataxia Somnolencia Dolor de cabeza Náuseas Diarrea Aumento de peso |
Renal: Sí Hepático: No |
Hipersensibilidad a la gabapentina |
Evidencia moderada; no aprobada por la FDA |
|
Antidepresivos
|
|||||
|
Amitriptilina (2.1-4,2) |
Sedación grave; confusión; efectos anticolinérgicos (estreñimiento, visión borrosa) |
Renal: No Hepático: No Se recomiendan dosis más bajas para pacientes de edad avanzada |
Hipersensibilidad a la amitriptilina; coadministración con MAOs o dentro de los 14 días siguientes; coadministración con cisaprida; fase de recuperación aguda después de un infarto de miocardio |
Evidencia moderada; no aprobado por la FDA; utilizar con precaución en personas con antecedentes de enfermedad cardiovascular |
|
|
Duloxetina (3.8-11) |
(EE.UU.) |
Náuseas; sedación; somnolencia generalizada |
Renal: Sí Hepática: Evitar su uso en deterioro hepático |
Hipersensibilidad; coadministración con MAOs o dentro de los 14 días siguientes; inicio en aquellos que estén recibiendo linezolid o azul de metileno IV |
Evidencia moderada; Aprobado por la FDA; puede añadirse a pregabalina o gabapentina |
|
Venlafaxina (5.2-8.4) |
Náuseas; sedación; somnolencia generalizada |
Renal: Sí Hepática: Sí |
Evidencia débil; no aprobado por la FDA; puede añadirse a gabapentina |
||
|
Opioides
|
|||||
|
Tramadol (2.1-6.4) |
Somnolencia Náuseas Vómitos Estreñimiento Mareos Dolor de cabeza |
Renal: Sí Hepático: No |
Hipersensibilidad al tramadol, a los opioides o a cualquier componente de la formulación; Fórmula ER: depresión respiratoria significativa y asma aguda o grave; Fórmula IR: intoxicación aguda con alcohol, hipnóticos, narcóticos, analgésicos de acción central, opiáceos o drogas psicotrópicas |
Potencial de abuso menor (sustancia controlada de la Lista IV); No se recomienda su uso como agente de primera o segunda línea |
|
|
Tapentadol (N/A) |
Liberación inmediata: Liberación prolongada: |
Somnolencia Náuseas Vómitos Estreñimiento Mareos |
Renales: No se recomienda su uso cuando Hepático: No |
Hipersensibilidad a tapentadol; depresión respiratoria significativa; asma aguda o grave; íleo paralítico; dentro de los 14 días de uso de inhibidores de la MAO |
Aprobado por la FDA; sustancia controlada de la Lista II; no se recomienda su uso como agente de primera o segunda línea |
|
La información se refiere a agentes farmacéuticos obtenidos de los respectivos prospectos (referenciados por los nombres comerciales) |
|||||
La guía de la Academia Americana de Neurología (AAN) recomienda los siguientes agentes tópicos: Spray de capsaicina y dinitrato de isosorbida (evidencia moderada) y parche Lidoderm (evidencia débil).69 La oxcarbazepina, la lamotrigina, lacosamida, la clonidina, la pentoxifilina y la mexiletina no se recomiendan en la guía de la AAN para el tratamiento de la DPN.69
Además, algunos han recomendado el uso de opioides en la DPN refractaria. Los opioides recomendados por la directriz de la AAN incluyen el dextrometorfano (400 mg/día), el sulfato de morfina (titulado a 120 mg/día) y la oxicodona (media de 37 mg/día, máximo de 120 mg/día); sin embargo, no hay datos suficientes para sugerir el uso de un agente sobre el otro.69 Los autores de este artículo recomiendan sólo el uso de opioides en casos refractarios graves con un estrecho seguimiento de los pacientes que obtienen una verdadera mejora funcional con los opioides. Los autores siguen la declaración de posición de 2016 de los Centros para el Control y la Prevención de Enfermedades de que los opioides tienen un uso limitado a largo plazo en el dolor de tipo no oncológico.70
Uno de los retos en el tratamiento farmacológico de la DPN es la insuficiencia de estudios cara a cara que incorporen resultados de calidad de vida.4 Un estudio reciente en el que se comparó una terapia de ocho semanas entre pregabalina a dosis altas, duloxetina a dosis altas o en combinación no encontró diferencias significativas en el cambio medio del dolor entre la monoterapia y la terapia combinada.71 Se necesitan más estudios en los que se comparen dos agentes activos para aportar información sobre la mejora de la atención a quienes padecen neuropatía periférica diabética.
Tratamiento no farmacológico. Procedimientos. La directriz de la RNA sugiere que se considere la estimulación nerviosa eléctrica percutánea durante tres o cuatro semanas para el tratamiento de la NDP.69 Un ensayo piloto controlado y aleatorizado de dos tipos de acupuntura72 y un ensayo aleatorizado, a ciegas y controlado con placebo73 que evaluaron la eficacia de la acupuntura en la NDP mostraron mejoras en las medidas de resultado asociadas al dolor. Sin embargo, se necesitan más estudios para confirmar el papel de la acupuntura en el tratamiento de la DPN.
Ácido alfa-lipoico. Algunas evidencias sugieren que el uso del antioxidante ácido alfa-lipoico podría ayudar a reducir el estrés oxidativo mediado por los radicales libres y proporcionar los siguientes beneficios: dirigirse a la patogénesis, frenar el desarrollo y mejorar los síntomas de la DPN.74,75
Prevención. Se ha demostrado que las modificaciones del estilo de vida, centradas en una dieta saludable y en la actividad física, disminuyen continuamente la prevalencia de la diabetes y sus complicaciones, incluida la neuropatía diabética periférica.68 Se ha demostrado que el control glucémico intensivo ayuda a reducir el riesgo de neuropatía diabética en pacientes con diabetes mediante la mejora de la función nerviosa.61,76,77 El DCCT estableció el papel del control glucémico en la prevención y el cese de la progresión de la neuropatía diabética en la diabetes de tipo 1.10,56
Perlas clínicas
- Hasta el 50% de los pacientes pueden tener una neuropatía periférica indolora o asintomática.
- Se recomienda que los pacientes con neuropatía reciban educación sobre el cuidado de los pies (autoinspección diaria de los pies) y atención podológica periódica para pacientes seleccionados.
- Se debe aconsejar a los pacientes con DPN que muestren signos de pérdida de sensibilidad protectora con o sin deformidad que realicen un seguimiento con un médico cada tres o seis meses para tomar medidas preventivas.64
- Para manejar eficazmente los síntomas de la DPN, resulta esencial un enfoque multidisciplinar; este enfoque integral podría incluir terapia farmacológica, psicológica y/o física.
- Una nueva declaración de posición sobre la neuropatía diabética publicada por la ADA recomienda el cribado de la DPN en pacientes con prediabetes que presenten síntomas de neuropatía periférica.4
- Se necesita atención especializada para las personas con enfermedad periférica, neuropatía no sensorial o pie de Charcot.
Gastroparesia
Otra forma de neuropatía diabética es la gastroparesia. Esta afección se asocia con síntomas gastrointestinales superiores que incluyen náuseas, vómitos, saciedad precoz o plenitud postprandial, dolor abdominal y distensión abdominal, pero en ausencia de obstrucción de la salida. Aunque existen varias causas de gastroparesia, se ha estimado que la diabetes es responsable de aproximadamente un tercio de todos los casos.78
Patofisiología. Los mecanismos fisiopatológicos propuestos para la gastroparesia diabética incluyen el deterioro del control glucémico, la neuropatía de los ganglios simpáticos vagales o prevertebrales, las anomalías de las células intersticiales de Cajal, la pérdida de óxido nítrico sintasa y, posiblemente, la miopatía.79,80
Presentación clínica. Al principio de esta enfermedad, los pacientes suelen ser asintomáticos. No existe una relación lineal entre los síntomas y la gravedad de la neuropatía. La gran variedad de síntomas dificulta el diagnóstico de la enfermedad. Otras presentaciones clínicas son la anorexia, la desnutrición, la pérdida de peso y la hipoglucemia por el desajuste de la absorción de los alimentos y la insulina. En realidad, el dolor puede ser poco comunicado pero significativo para muchas personas. En un consorcio financiado por los Institutos Nacionales de la Salud (NIH), el 72% de los pacientes con gastroparesia tenían dolor abdominal.81 Éste era el síntoma dominante en el 18% de estos pacientes. El dolor era inducido por la comida (72%), era nocturno (74%) e interfería en el sueño (66%) de estos pacientes.81
¿Qué frecuencia tiene la gastroparesia diabética? La incidencia acumulada a lo largo de 10 años de la gastroparesia se ha estimado en un 5,2% en la diabetes tipo 1 y en un 1% en la diabetes tipo 2 entre los pacientes comunitarios con diabetes82. Otros estudios han encontrado tasas de entre el 5 y el 12%.83,84 Sin embargo, las tasas son mucho más altas cuando el diagnóstico se basa en los síntomas y no en el estudio de vaciado gástrico.
La gastroparesia es más común en la diabetes de tipo 1 que en la de tipo 2, y se observa con mayor frecuencia después de que la persona haya tenido diabetes durante más de 10 años y haya desarrollado las otras complicaciones microvasculares de retinopatía, nefropatía y neuropatía periférica. Si un paciente presenta gastroparesia antes de lo esperado, deben explorarse otras etiologías, más comúnmente la lesión perioperatoria del nervio vago o los efectos farmacológicos de los agentes basados en la incretina – agonistas del receptor del péptido-1 similar al glucagón (GLP-1RA) e inhibidores de la dipeptidil-peptidasa 4 (inhibidores de la DPP-4).
Una vez que un paciente desarrolla síntomas de gastroparesia, los síntomas suelen persistir y son estables durante 12-25 años. Esto es así incluso si mejora el control de la glucosa,85 excepto en el caso de un trasplante de páncreas y riñón.86 Aunque no hay pruebas claras de que la gastroparesia aumente la mortalidad en sí misma, sí reduce sustancialmente todos los aspectos de la calidad de vida.87
Diagnóstico. Varias pruebas pueden ayudar al diagnóstico. El patrón de oro para este diagnóstico es la gammagrafía gastroesofágica. No es invasiva, comprueba la fisiología y proporciona resultados cuantitativos. La gastroparesia puede diagnosticarse si hay al menos un 35% de retención de una comida estándar baja en grasas cuatro horas después de la ingesta.80
Para obtener los resultados más precisos de la prueba, el protocolo previo a la misma debe incluir la interrupción de todos los medicamentos que alteren la motilidad durante al menos dos o tres días antes de la prueba, incluidos los procinéticos, los opiáceos y los anticolinérgicos. También deben suspenderse los agentes de la incretina, como los agonistas del GLP-1 y los inhibidores del DPP-4, ya que se sabe que retrasan el vaciado gástrico. También se ha demostrado que la hiperglucemia retrasa el vaciado gástrico, y la glucosa debe estar por debajo de 275 mg/dL antes de comenzar el estudio.79,88
Los pacientes deben abstenerse de fumar y de consumir alcohol el día de la prueba, ya que ambos pueden retrasar el vaciado gastroesofágico.89 Además, los GLP-1RA pueden exacerbar la gastroparesia porque retrasan el vaciado gástrico. Además, algunas personas pueden tener gastroparesia subclínica que se descubre cuando se inicia un GLP-1RA.
Tratamiento. El tratamiento de la gastroparesia depende en gran medida de la gravedad de los síntomas. Los principios generales del tratamiento incluyen tratamientos de apoyo (líquidos, electrolitos, control de la glucosa y nutrición), tratamientos médicos (procinéticos, antieméticos y alivio del dolor) y tratamientos invasivos (cirugía, inyecciones de Botox, estimulación gástrica o eléctrica).79
El tratamiento de apoyo suele iniciarse en el hospital y se centra en la normalización de los trastornos de líquidos, electrolitos y nutrición. Cuando se proporciona apoyo nutricional, se prefiere la alimentación enteral a la parenteral, ya que es más fisiológica y puede ayudar a mantener la flora intestinal. Además, los cambios dietéticos pueden ser muy útiles en la gastroparesia. Se recomiendan las dietas bajas en fibra, grasas y residuos para los pacientes con gastroparesia.85 Las dietas altas en fibra pueden aumentar los síntomas, ya que requieren más digestión.
Medicamentos. Procinéticos: En Estados Unidos la metoclopramida y la eritromicina son los medicamentos más utilizados para tratar la gastroparesia. Sin embargo, la metoclopramida tiene una advertencia de caja negra debido al riesgo de discinesia tardía. El desarrollo de esta enfermedad está directamente relacionado con la duración del uso de la metoclopramida y el número de dosis tomadas. Cuando se utiliza este medicamento, es mejor usarlo sólo en pacientes sintomáticos y empezar con la dosis efectiva más baja 15 minutos antes de las comidas. Las vacaciones del fármaco a veces pueden ayudar a prolongar la duración de los efectos.90
La domperidona es un agonista dopaminérgico más selectivo que es igualmente eficaz que la metoclopramida pero tiene menos efectos secundarios sobre el sistema nervioso central.91
Antieméticos: Los antieméticos pueden utilizarse para ayudar con los síntomas. Sin embargo, el riesgo de interacciones con la medicación es significativo y debe vigilarse cuidadosamente.
El manejo del dolor puede ser un reto en los pacientes con gastroparesia. Los antidepresivos tricíclicos suelen utilizarse como tratamiento de primera línea para el dolor en la gastroparesia. Los enfoques de segunda línea son el agonista débil del receptor mu-opioide, tramadol, que también libera serotonina e inhibe la recaptación de norepinefrina, y el análogo del ácido gamma-aminobutírico, gabapentina. Sin embargo, no se recomienda el uso de narcóticos en la gastroparesia, ya que puede contribuir al estreñimiento y al empeoramiento de los síntomas.
Tratamientos invasivos: Las inyecciones de bótox se utilizan habitualmente en el tratamiento de la gastroparesia, pero su uso no está respaldado en ensayos clínicos.92,93
El dispositivo de estimulación eléctrica gástrica fue aprobado por la FDA en virtud de una exención de dispositivos humanitarios en el año 2000.94 El dispositivo de estimulación eléctrica gástrica administra estimulación eléctrica de alta frecuencia y baja energía al estómago. Es más útil en la gastroparesia diabética que en la idiopática. Un metaanálisis mostró beneficios sustanciales en los síntomas de los pacientes. Todavía no se conoce el mecanismo exacto de su beneficio.95 Se ha propuesto que la estimulación eléctrica gástrica produce cambios en los mecanismos centrales que controlan las náuseas y los vómitos, aumenta la función vagal y provoca una disminución de la sensibilidad a la distensión.97 Los pacientes que responden bien suelen hacerlo rápidamente. Esto ha llevado a algunos a recomendar un ensayo con la colocación temporal de electrodos primero antes de la aplicación a largo plazo.
Perlas clínicas
- La gastroparesia diabética es más frecuente en personas con diabetes de larga duración y en aquellas con otras complicaciones microvasculares.
- El diagnóstico de referencia para la gastroparesia es la gammagrafía gastroesofágica.
- En la gastroparesia diabética se recomiendan dietas bajas en fibra, grasas y residuos.
- Los tratamientos farmacológicos y de intervención tienen beneficios limitados y un riesgo significativo a largo plazo.
Quiroartropatía diabética
Una de las complicaciones de la diabetes menos conocidas es la quiroartropatía. Esta afección se caracteriza por la limitación de la movilidad de las articulaciones debido al engrosamiento de la piel en personas con diabetes de larga duración. Probablemente fue la primera complicación identificada de la diabetes tipo 1. Las tasas de prevalencia varían ampliamente entre el 8 y el 50%.98
Se cree que la quiroartropatía está causada por la glicosilación y la reticulación del colágeno. Puede afectar a la piel y a los tendones, y puede dar lugar a una movilidad limitada de las articulaciones, más comúnmente la extensión de los dedos, rigidez y dolor. El signo clásico del examen físico de la queiropatía diabética es el «signo de la oración». En esta condición, una persona es incapaz de aplanar completamente sus manos para «rezar» dejando un espacio entre los dedos de la mano izquierda y derecha. Hay pruebas de que quienes desarrollan la queiropatía tienen un riesgo tres veces mayor de sufrir complicaciones microvasculares.99
La queiropatía diabética suele ser peor en quienes tienen una glucemia de larga duración o mal controlada. Afortunadamente, muchas personas experimentan un alivio de los síntomas y una mejora de la movilidad cuando mejora el control de la glucosa.100
Conclusión
El tratamiento de las complicaciones de la diabetes requiere un equipo multidisciplinar. El cribado temprano de la retinopatía, la nefropatía y la neuropatía es esencial, dada la naturaleza asintomática de la enfermedad. El sello de la gestión de la diabetes para todas las complicaciones sigue siendo el control de la glucemia y la presión arterial.
- American Diabetes Association. Coste de la diabetes. Disponible en: http://www.diabetes.org/advocacy/news-events/cost-of-diabetes.html?referrer=https://www.google.com/. Actualizado el 22 de junio de 2015. Consultado el 8 de febrero de 2017.
- UK Prospective Diabetes Study Group. Control intensivo de la glucosa en sangre con sulfonilureas o insulina en comparación con el tratamiento convencional y el riesgo de complicaciones en pacientes con diabetes tipo 2. Lancet 1998;352:837-853.
- Gregg EW, Yanfed L, Wang J. Cambios en las complicaciones relacionadas con la diabetes en los Estados Unidos, 1990-2010. N Engl J Med 2014;370:1514-1523.
- Pop-Busui R, Boulton A, Feldman E, et al. Diabetes neuropathy: Una declaración de posición de la Asociación Americana de Diabetes. Diabetes Care 2017;40:136-154.
- Leasher JL, Bourne RR, Flaxman SR, et al. Estimaciones globales sobre el número de personas ciegas o con discapacidad visual por retinopatía diabética: Un meta-análisis de 1990 a 2010. Diabetes Care 2016;39:1643-1649.
- Instituto Nacional del Ojo. Datos sobre la enfermedad ocular diabética. Disponible en: https://nei.nih.gov/health/diabetic/retinopathy. Actualizado en septiembre de 2015. Consultado el 8 de febrero de 2017.
- Fong, DS, Aiello L, Gardner TW, et al. Retinopatía en la diabetes. Diabetes Care 2004;27(Suppl 1):S84-S87.
- American Diabetes Association. Normas de atención médica en la diabetes-2017. Diabetes Care 2017;40:(Suppl 1):S4-S5.
- Doggen K, Nobels F, Scheen AJ, et al. Factores de riesgo cardiovascular y complicaciones asociadas a la albuminuria y al deterioro de la función renal en la diabetes tratada con insulina. J Diabetes Complications 2013;27:370-375.
- Grupo de investigación del ensayo de control y complicaciones de la diabetes. El efecto del tratamiento intensivo de la diabetes en el desarrollo y la progresión de las complicaciones a largo plazo en la diabetes mellitus insulinodependiente. N Engl J Med 1993;329:977-986.
- Action to Control Cardiovascular Risk in Diabetes Follow-On (ACCORDION) Eye Study Group and the Action to Control Cardiovascular Risk in Diabetes Follow-On (ACCORDION) Study Group. Efectos persistentes del control glucémico intensivo sobre la retinopatía en la diabetes tipo 2 en el estudio de seguimiento Action to Control Cardiovascular Risk in Diabetes (ACCORD). Diabetes Care 2016;39:1089-1100.
- Grupo de Estudio ACCORD, Grupo de Estudio Ocular ACCORD, Chew EY, et al. Efectos de las terapias médicas en la progresión de la retinopatía en la diabetes tipo 2. N Engl J Med 2010;363:233-244.
- Chew EY, Davis MD, Danis RP, et al. The effects of medical management on the progression of diabetic retinopathy in persons with type 2 diabetes: El estudio ocular Action to Control Cardiovascular Risk in Diabetes (ACCORD). Ophthalmology 2014;121:2443-2451.
- Grupo de investigación del ensayo de control y complicaciones de la diabetes. Efecto del embarazo sobre las complicaciones microvasculares en el Diabetes Control and Complications Trial. Diabetes Care 2000;23:1084-1091.
- Colberg SR, Sigal RJ, Yardley JE, et al. Physical activity/exercise and diabetes: Una declaración de posición de la Asociación Americana de Diabetes. Diabetes Care 2016;39:2065-2079.
- El Grupo de Investigación del Estudio de la Retinopatía Diabética. Informe preliminar sobre los efectos de la terapia de fotocoagulación. Am J Ophthalmol 1976;81:383-396.
- Grupo de investigación del estudio de la retinopatía diabética de tratamiento temprano. Photocoagulation for diabetic macular edema: Early Treatment Diabetic Retinopathy Study report number 1. Arch Ophthalmol 1985;103:1796-1806.
- Nguyen QD, Brown DM, Marcus DM, et al. Ranibizumab for diabetic macular edema: Resultados de 2 ensayos aleatorios de fase III: RISE y RIDE. Ophthalmology 2012;119:789-801.
- Wong TY, Cheung CMG, Larsen M, et al. Diabetic retinopathy. Nat Rev Disease Prim doi:10.1038/nrdp.2016.12; publicado en línea el 17 de marzo de 2016.
- Batuman V, Soman AS, Schmidt RJ, Soman SS. Nefropatía por diabetes. Medscape Disponible en: http://emedicine.medscape.com/article/238946-overview. Actualizado el 30 de septiembre de 2016. Consultado el 12 de febrero de 2017.
- Tuttle KR, Bakris GL, Bilous RW, et al. Diabetic kidney disease: Un informe de una Conferencia de Consenso de la ADA. Diabetes Care 2014;37:2864-2883. https://doi.org/10.2337/dc14-1296
- Patel A, MacMahon S, Chalmers J, et al. Control intensivo de la glucemia y resultados vasculares en pacientes con diabetes tipo 2. N Engl J Med 2008;358:2560-2572.
- Duckworth W, Abraira C, Moritz T, et al. Control de la glucosa y complicaciones vasculares en veteranos con diabetes tipo 2. N Engl J Med 2009;360:129-139.
- Ismail-Beigi F, Craven T, Banerji MA, et al. Effect of intensive treatment of hyperglycaemia on microvascular outcomes in type 2 diabetes: Un análisis del ensayo aleatorio ACCORD. Lancet 2010;376:419-430.
- Fundación Nacional del Riñón. Guía de práctica clínica KDOQI para la diabetes y la ERC: actualización 2012. Am J Kidney Dis 2012;60:850-886.
- Fox CS, Matsushita K, Woodward M, et al. Chronic Kidney Disease Prognosis Consortium. Asociaciones de las medidas de la enfermedad renal con la mortalidad y la enfermedad renal terminal en individuos con y sin diabetes: Un meta-análisis. Lancet 2012;380:1662-1673.
- Hahr AJ, Molitch ME. Manejo de la diabetes mellitus en pacientes con enfermedad renal crónica. Clin Diabetes Endocrinol 2015. doi: 10.1186/s40842-015-0001-9.
- Alsaad KO, Herzenberg AM. Distinguiendo la nefropatía diabética de otros casos de glomeruloesclerosis: Una actualización. J Clin Pathol 2007;60:18-26.
- Narva AS, Bilous RW. Evaluación de laboratorio de la enfermedad renal diabética. Diabetes Spectr 2015;28:162-166.
- Levey AS, Stevens LA, Schmid CH, et al. A new equation to estimate glomerular filtration rate. Ann Intern Med 2009;150:604-612.
- Fundación Nacional del Riñón. Guías de práctica clínica KDOQI para la enfermedad renal crónica: Evaluación, clasificación y estratificación. Am J Kidney Dis 2002;39(2 Suppl 1):S1-S266.
- De Boer IH, Rue TC, Cleary PA, et al. Long-term renal outcomes of patients with type 1 diabetes mellitus and microalbuminuria: Un análisis de la cohorte Diabetes Control and Complications Trial/Epidemiology of Diabetes Interventions and Complications. Arch Intern Med 2011;171:412-420.
- Wanner C, Inzucchi SE, Lachin JM, et al. Empagliflozin and progression of kidney disease in type 2 diabetes. N Engl J Med 2016;375:323-334.
- Heerspink HJL, Desai M, Jardine M, et al. Canagliflozin slows progression of renal function decline independently of glycemic effects. J Am Soc Nephrol 2016;28:1-8.
- Lexi-Drugs. Lexicomp. Wolters Kluwer Health, Inc. Riverwoods, IL. Disponible en: http://online.lexi.com. Consultado el 31 de octubre de 2016.
- Micromedex Solutions. Truven Health Analytics, Inc. Ann Arbor, MI. Disponible en: http://www.micromedexsolutions.com. Consultado el 31 de octubre de 2016.
- James PA, Oparil S, Carter BL, et al. 2014 evidence-based guideline for the management of high blood pressure in adults. JAMA 2014;311:507-520.
- King P, Peacock I, Donnelly R. The United Kingdom Prospective Diabetes Study (UKPDS): Implicaciones clínicas y terapéuticas para la diabetes de tipo 2. Br J Clin Pharmacol 1999;48:643-648.
- Jackevicius CA, Wong J, Aroustamian I, et al. Rates and predictors of ACE inhibitor discontinuation subsequent to elevated serum creatinine: Un estudio de cohorte retrospectivo. BMJ Open 2014;4:e005181.
- Mauer M, Zinman B, Gardiner R, et al. Efectos renales y retinales de enalapril y losartán en la diabetes tipo 1. N Engl J Med 2009;361:40-51.
- Bilous R, Chaturvedi N, Sjølie AK, et al. Effect of candesartan on microalbuminuria and albumin excretion rate in diabetes: Three randomized trials. Ann Intern Med 2009;151:11-20.
- Haller H, Ito S, Izzo JL Jr, et al. Olmesartan for the delay or prevention of microalbuminuria in type 2 diabetes. N Engl J Med 2011;364:907-917.
- Makani H, Bangalore S, Desouza KA, et al. Eficacia y seguridad del bloqueo dual del sistema renina-angiotensina: Meta-análisis de ensayos aleatorios. BMJ 2013;346:f360.
- Miao Y, Ottenbros SA, Laverman GD, et al. Efecto de una reducción del ácido úrico en los resultados renales durante el tratamiento con losartán: Un análisis post-hoc de la reducción de los puntos finales en la diabetes mellitus no insulinodependiente con el ensayo del antagonista de la angiotensina II Losartán. Hypertension 2011;58:2-7.
- Lewis EJ, Hunsicker LG, Clarke WR, et al. Efecto renoprotector del antagonista del receptor de la angiotensina irbesartán en pacientes con nefropatía debida a la diabetes tipo 2. N Eng J Med 2001;354:851-860.
- Adler A, Casula A, Steenkamp R, et al. Asociación entre la glucemia y la mortalidad en individuos diabéticos en tratamiento de sustitución renal en el Reino Unido. Diabetes Care 2014;37:1304-1311.
- Sharma SG, Bomback AS, Radhakrishnan J, et al. El espectro moderno de los hallazgos de la biopsia renal en pacientes con diabetes. Clin J Am Soc Nephrol 2013;8:1718-1724.
- Smart NA, Dieberg G, Ladhani M, Titus T. Derivación temprana a servicios de nefrología especializados para prevenir la progresión a la enfermedad renal terminal. Cochrane Database Syst Rev 2014;6:CD007333.
- Boulton AJM, Gries FA, Jervell JA. Directrices para el diagnóstico y el manejo ambulatorio de la neuropatía periférica diabética. Diabet Med 1998;15:508-514.
- O’Brien PD, Hinder LM, Sakowski SA, Feldman EL. ER stress in diabetic peripheral neuropathy: Una nueva diana terapéutica. Antioxid Redox Signal 2014;21:621-633.
- Cameron NE, Cotter MA. Mecanismos proinflamatorios en la neuropatía diabética: Enfoque en la vía del factor nuclear kappa B. Curr Drug Targets 2008;9:60-67.
- Tesfaye S, Chaturvedi N, Eaton SE, et al. Vascular risk factors and diabetic neuropathy. N Engl J Med 2005;352:341-350.
- Wiggin TD, Sullivan KA, Pop-Busui R, et al. Elevated triglycerides correlated with progression of diabetic neuropathy. Diabetes 2009;58:1634-1640.
- Stella P, Ellis D, Maser RE, Orchard TJ. Neuropatía autonómica cardiovascular (relación de espiración e inspiración) en la diabetes tipo 1. Incidencia y predictores. J Diabetes Complications 2000;14:1-6.
- Witten DR, Tesfaye S, Chaturvedi N, et al. Risk factors for cardiac autonomic neuropathy in type 1 diabetes mellitus. Diabetologia 2005;48:164-171.
- Grupo de investigación del ensayo de control y complicaciones de la diabetes (DCCT). Efecto del tratamiento intensivo de la diabetes sobre la conducción nerviosa en el Diabetes Control and Complications Trial. Ann Neurol 1995;38:869-880.
- Grupo de Investigación del Ensayo de Control y Complicaciones de la Diabetes (DCCT). El efecto de la terapia intensiva de la diabetes en las medidas de la función del sistema nervioso autónomo en el Ensayo de Control y Complicaciones de la Diabetes (DCCT). Diabetologia 1998;41:416-423.
- Edwards JL, Vincent AM, Cheng HT, Feldman EL. Diabetic neuropathy: Mechanisms to management. Pharmacol Ther 2008;120:1-34.
- Vincent AM, Callaghan BC, Smith AL, Feldman EL. Diabetic neuropathy: Mecanismos celulares una diana terapéutica. Nat Rev Neurol 2011;7:573-583.
- Kellogg AP, Wiggin T, Larkin D, et al. Protective effects of cyclooxygenase-2 gene inactivation against peripheral nerve dysfunction and intraepidermal nerve fibers loss in experimental diabetes. Diabetes 2007;56:2997-3005.
- Callaghan BC, Cheng HT, Stables CL, et al. Diabetic neuropathy: Manifestaciones clínicas y tratamientos actuales. Lancet Neurol 2012;11:521-534.
- Boulton AJM, Kirsner RS, Vileikyte L. Clinical practice: Úlceras neuropáticas del pie diabético. N Eng J Med 2004;351:48-55.
- Boulton AJM, Vinik AI, Arezzo JC, et al. Diabetic neuropathies: Una declaración de la Asociación Americana de Diabetes. Diabetes Care 2005;28:956-962.
- Boulton AJM, Armstrong DG, Albert SF, et al. Comprehensive foot examination and risk assessment: Un informe del grupo de trabajo del grupo de interés en el cuidado de los pies de la Asociación Americana de Diabetes, con la aprobación de la Asociación Americana de Endocrinólogos Clínicos. Diabetes Care 2008;31:1679-1685.
- Tesfaye S, Boulton AJ, Dyck PJ, et al. Diabetic neuropathies: Actualización de las definiciones, criterios de diagnóstico, estimación de la gravedad y tratamientos. Diabetes Care 2010;33:2285-2293.
- Dyke PJ, Albers JW, Andersen H, et al. Diabetic polyneuropathies: Actualización de la definición de la investigación, los criterios de diagnóstico y la estimación de la gravedad. Diabetes Metab Res Rev 2011;27:620-628.
- Freeman R. Not all neuropathy is diabetes is of diabetic etiology: Diagnóstico diferencial de la neuropatía diabética. Curr Diabe Rep 2009;9:423-431.
- Balducci S, Iacobellis G, Parisi L, et al. Exercise training can modify the natural history of diabetic peripheral neuropathy. J Diabetes Complications 2006;20:216-223.
- Bril V, England J, Franklin GM, et al. Evidence-based guideline: Tratamiento de la neuropatía diabética dolorosa. Informe de la Academia Americana de Neurología, la Asociación Americana de Medicina Neuromuscular y Electrodiagnóstico, y la Academia Americana de Medicina Física y Rehabilitación. Neurología 2011;76:1758-1765.
- Dowell D, Haegerich TM, Chou R. CDC Guideline for prescribing opioids for chronic pain – United States 2016. MMWR Recomm Rep 2016;65:1-49.
- Tesfaye S, Wilhelm S, Lledo A, et al. Duloxetina y pregabalina: ¿Monoterapia a dosis altas o su combinación? El «estudio COMBO-DN»: un estudio multinacional, aleatorizado, doble ciego y de grupos paralelos en pacientes con dolor neuropático periférico diabético. Pain 2013;154:2616-2625.
- Ahn AC, Bennani T, Freeman R, et al. Two styles of acupuncture for treating painful diabetic neuropathy – a pilot randomized control trial. Acupunct Med 2007;25:11-17.
- Garrow A, Xing M, Vere J, et al. Role of acupuncture in the management of diabetic painful neuropathy (DPN): Un ECA piloto. Acupunct Med 2014;32:242-249.
- Ziegler D, Nowak H, Kempler P, et al. Tratamiento de la polineuropatía diabética sintomática con el antioxidante ácido alfa-lipoico: Un meta-análisis. Diabet Med 2004;21:114-121.
- Ziegler D, Low PA, Litchy WJ, et al. Eficacia y seguridad del tratamiento antioxidante con ácido alfa-lipoico durante 4 años en la polineuropatía diabética: El ensayo NATHAN 1. Diabetes Care 2011;34:2054-2060.
- Kuwabara S, Ogawara K, Harrori T, et al. The acute effects of glycemic control on axonal excitability in human diabetic nerves. Intern Med 2002;41:360-365.
- Peltier A, Goutman SA, Callaghan BC. Neuropatía diabética dolorosa. BMJ 2014;348:g1799.
- Soykan I, Sivri B, Sarosiek I, et al. Demografía, características clínicas, perfiles psicológicos y de abuso, tratamiento y seguimiento a largo plazo de pacientes con gastroparesia. Dig Dis Sci 1998;43:2398-2404.
- Camilleri M, Bharucha AE, Farrugia G. Epidemiology, mechanisms, and management of diabetic gastroparesis. Clin Gastroenterol Hepatol 2011;9:5-12.
- Shin AS, Camilleri M. Evaluación diagnóstica de la gastroparesia diabética. Diabetes 2013;62:2667-2673.
- Hasler WL, Wilson L, Parkman HP, Lee L. Importancia del dolor abdominal como síntoma en la gastroparesia: Relación con factores clínicos, gravedad de la enfermedad, calidad de vida, retención gástrica y uso de medicación. Gastroenterology 2010;138. doi: 10.1016/S0016-5085(10)62131-2.
- Choung RS, Locke GR 3rd, Schleck CD, et al. Risk of gastroparesis in subjects with type 1 and 2 diabetes in the general population. Am J Gastroenterol 2012;107:82-88.
- Maleki D, Locke GR III, Camilleri M, et al. Gastrointestinal tract symptoms among persons with diabetes mellitus in the community. Arch Intern Med 2000;160:2808-2816.
- Bytzer P, Talley NJ, Leemon M, et al. Prevalence of gastrointestinal symptoms associated with diabetes mellitus: Una encuesta basada en la población de 15.000 adultos. Arch Intern Med 2001;161:1989-1996.
- Jones KL, Russo A, Berry MK, et al. A longitudinal study of gastric emptying and upper gastrointestinal symptoms in patients with diabetes mellitus. Am J Med 2002;113:449-455.
- Gaber AO, Hathaway DK, Abell T, et al. Improved autonomic and gastric function in pancreas-kidney vs kidney-alone transplantation contributes to quality of life. Transplant Proc 1994;26:515-516.
- Punkkinen J, Färkkilä M, Mätzke S, et al. Upper abdominal symptoms in patients with Type 1 diabetes: Sin relación con el deterioro del vaciado gástrico causado por la neuropatía autonómica. Diabet Med 2008;25:570-577.
- Schvarcz E, Palmer M, Aman J, et al. Physiological hyperglycemia slows gastric emptying in normal subjects and patients with insulin-dependent diabetes mellitus. Gastroenterology 1997;113:60-66.
- Miller G, Palmer KR, Smith B, et al. Smoking delays gastric emptying of solids. Gut 1989;30:50-53.
- Rao AS, Camilleri M. Artículo de revisión: Metoclopramida y discinesia tardía. Aliment Pharmacol Ther 2010;31:11-19.
- Patterson D, Abell T, Rothstein R, et al. A double-blind multicenter comparison of domperidone and metoclopramide in the treatment of diabetic patients with symptoms of gastroparesis. Am J Gastroenterol 1999;94:1230-1234.
- Arts J, Holvoet L, Caenepeel P, et al. Clinical trial: Un estudio cruzado aleatorizado y controlado de la inyección intrapilórica de toxina botulínica en la gastroparesia. Aliment Pharmacol Ther 2007;26:1251-1258.
- Friedenberg FK, Palit A, Parkman HP, et al. Botulinum toxin A for the treatment of delayed gastric emptying. Am J Gastroenterol 2008;103:416-423.
- Exención de dispositivos humanitarios para el dispositivo Enterra. Fed Reg 2000;65:78495-78496.
- O’Grady G, Egbuji JU, Du P, et al. Estimulación eléctrica gástrica de alta frecuencia para el tratamiento de la gastroparesia: A meta-analysis. World J Surg 2009;33:1693-1701.
- Reddymasu SC, Sarosiek I, McCallum RW. Gastroparesia severa: Terapia médica o estimulación eléctrica gástrica. Clin Gastroenterol Hepatol 2010;8:117-124.
- McCallum RW, Dusing RW, Sarosiek I, et al. Mechanisms of symptomatic improvement after gastric electrical stimulation in gastroparetic patients. Neurogastroenterol Motil 2010;22:161-167.
- Douloumpakas I, Pyrpasopoulou A, Triantafyllou A, et al. Prevalencia de trastornos musculoesqueléticos en pacientes con diabetes mellitus tipo 2: Un estudio piloto. Hippokratia 2007;11:216-218.
- Rosenbloom AL, Silverstein JH, Lezotte DC. La movilidad articular limitada en la diabetes mellitus infantil indica un mayor riesgo de enfermedad microvascular. N Engl J Med 1981;305;191-194.
- Lister DM, Graham-Brown RAC, Burden AC. Resolución de la queiroartropatía diabética. Br Med J 1986;293:1537.