La capacidad de drenar completamente la cavidad torácica, romper las loculaciones de líquido pleural, visualizar completamente todos los aspectos del espacio pleural y evitar la morbilidad de una toracotomía ha hecho que la toracoscopia sea atractiva en el tratamiento del empiema y el hemotórax.
Selección de pacientes
La capacidad de drenar completamente la cavidad torácica, romper las loculaciones de líquido pleural, visualizar completamente todos los aspectos del espacio pleural y evitar la morbilidad de una toracotomía ha hecho que la toracoscopia sea atractiva en el tratamiento del empiema y el hemotórax.
Tabla 1: Criterios de laboratorio para el drenaje del empiema
Un derrame que ocupe más del 50% del hemitórax o que esté loculado;
Una tinción de Gram positiva o un cultivo del líquido pleural;
Un líquido pleural purulento que tenga un pH inferior a 7.20 o una glucosa inferior a 60,
Un nivel de deshidrogenasa del ácido láctico de más de tres veces el límite superior normal para el suero.
Los pacientes en los que se ha comprobado la existencia de un derrame pleural infectado mediante toracocentesis y que cumplen los criterios de laboratorio para la intervención son candidatos a la decorticación toracoscópica.
Cuando el empiema está en la fase exudativa o fibrinopurulenta y ha estado presente durante aproximadamente 3 semanas de duración o menos, la intervención toracoscópica suele tener éxito (Vídeo 1, Vídeo 2 abajo). Cuando el empiema ha estado presente durante más de 3 semanas (fase de organización), la capacidad de realizar una decorticación adecuada puede ser más difícil debido a las adherencias más densas y a la presencia de una cáscara visceral pulmonar adherida . Los pacientes con un empiema exudativo o fibrinopurulento casi siempre pueden ser abordados con toracoscopia; la TC no es útil para predecir los pacientes que requerirán toracotomía. La conversión a toracotomía abierta se realiza cuando es necesario y no debe considerarse un fracaso de la toracoscopia, sino más bien un ejercicio de juicio quirúrgico maduro . La toracoscopia también está indicada cuando no se ha diagnosticado la naturaleza del proceso pleural, ya que permite realizar una biopsia pleural dirigida que probablemente permita realizar el diagnóstico y evitar la morbilidad de una toracotomía. Otras indicaciones para la decorticación toracoscópica son el hemotórax y el desbridamiento mediastínico en pacientes con mediastinitis descendente.
La toracotomía previa, la pleurodesis previa con talco y el empiema previo son contraindicaciones relativas para la toracoscopia. La incapacidad de tolerar la ventilación monopulmonar y la presencia de un fibrotórax son contraindicaciones para realizar una decorticación toracoscópica. Los pacientes que desarrollan un empiema tras una perforación esofágica no deben ser tratados por toracoscopia, sino por toracotomía.
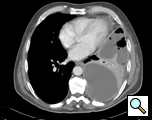
Figura 1: TC que muestra un empiema
La TC del tórax proporciona información sobre la localización, el grado de localización, la extensión del empiema y el parénquima pulmonar subyacente (Figura 1). No es infrecuente que no se identifique un organismo en el cultivo del líquido pleural y, por lo tanto, debe instaurarse una cobertura antibiótica de amplio espectro cuando se hace el diagnóstico de empiema. Esto puede modificarse si los datos del cultivo identifican un organismo. Los antibióticos se mantienen durante el período perioperatorio.
Se debe realizar una evaluación del estado nutricional del paciente y se inicia la alimentación suplementaria si es necesario. Debe realizarse una broncoscopia antes de la decorticación para descartar una obstrucción endobronquial en la porción del pulmón que está atrapada por el empiema.
Pasos operativos
Se instituye la anestesia general y se logra el aislamiento pulmonar mediante un tubo endotraqueal de doble luz o un tubo de una sola luz con un bloqueador bronquial. Esto permite la expansión y el colapso del pulmón según sea necesario durante la decorticación. La monitorización intraoperatoria incluye una línea de presión arterial, un acceso intravenoso de gran calibre, un catéter de Foley y una pulsioximetría. El paciente se coloca como para una toracotomía posterolateral.

Figura 3. Radiografía de tórax postoperatoria después de la decorticación VATS, con los tubos de drenaje pleural izquierdo colocados.

Figura 2b: Uso de un retractor para mantener abierto el puerto de trabajo.
El puerto de la cámara se coloca en el 7º o 6º espacio intercostal en la línea de la espina ilíaca superior anterior o justo antes de ésta. La decorticación VATS y/o la evacuación del hemotórax pueden realizarse a través de 2 o 3 puertos. El puerto de trabajo debe colocarse sobre el 5º espacio intercostal entre las líneas axilares media y anterior. (Figura 2a) La incisión intercostal debe permitir 3 dedos. Se utiliza un Weitlaner para retraer los tejidos blandos (Figura 2b). Se puede colocar un tercer puerto posteriormente, colocado para permitir el acceso a la parte anterior de la cavidad pleural.
Una vez que se ha entrado en el tórax, se utiliza una succión de Yankauer para drenar el tórax de derrame o sangre (Vídeo 3, Vídeo 4 abajo) y junto con un dedo se utiliza para romper las loculaciones simples (Vídeo 5 abajo). El TAC preoperatorio ayuda a guiar este drenaje inicial «ciego» y crea un espacio pleural de trabajo para los instrumentos toracoscópicos. Los depósitos fibrinosos gelatinosos y los coágulos de sangre se eliminan con unas pinzas de anillo curvadas (Vídeo 6, Vídeo 7 abajo). La cáscara pleural visceral se puede desbridar con pinzas de anillo, una cureta (Vídeo 8 abajo) y un disector de cacahuetes como en una decorticación abierta.
Una vez que se ha creado un espacio pleural, la eliminación del material fibrinoso se lleva a cabo en la parte lateral de la cavidad pleural empezando por el ápice del pulmón y procediendo hasta el diafragma o viceversa. La ventosa y la pinza anular se utilizan conjuntamente para eliminar el material fibrinoso de la cavidad pleural y la cureta, el cacahuete y la pinza anular se utilizan para disecar la corteza del pulmón. En la cara inferior de la cavidad pleural es útil identificar y separar el lóbulo inferior del pulmón del diafragma (Video 9 abajo). Este plano se desarrolla posterior y anteriormente permitiendo que el pulmón llene el surco costodiafragmático una vez completada la decorticación. A continuación, se desbrida la cara posterior del espacio pleural y se decora el pulmón subyacente. La exposición se facilita rodando al paciente en sentido anterior. Por último, se desbrava el aspecto anterior de la cavidad pleural y se libera el pulmón de donde está adherido al mediastino. Esta exposición se mejora rodando al paciente hacia atrás. A la izquierda se debe tener cuidado de proteger el nervio frénico.
La ventilación intermitente del pulmón se utiliza para evaluar la integridad de la decorticación a medida que avanza la disección. Si no se produce un progreso adecuado o si la expansión del pulmón es insuficiente para llenar el tórax, debe realizarse una conversión a una decorticación abierta. Debe prestarse especial atención a la hemostasia (vídeo 10, vídeo 11 a continuación) tanto en la pleura parietal como en la visceral.
Una vez que se ha logrado un desbridamiento adecuado, se realiza la irrigación y se visualiza la expansión del pulmón para asegurarse de que la cavidad pleural está llena por el pulmón (vídeo 12 a continuación). Se pueden colocar tubos torácicos por delante y por detrás para el drenaje de aire y líquido. Si hay un pequeño espacio sobre el diafragma, se coloca un tubo en ángulo recto en esta posición para asegurar el drenaje y permitir una expansión pulmonar gradual.
Los tubos torácicos se mantienen en succión para asegurarse de que hay una expansión pulmonar completa y un drenaje adecuado del espacio pleural (Figura 3). Una vez que el drenaje es inferior a 200 cc/24 horas, se pueden retirar los tubos. Para los pacientes con un empiema, los antibióticos intravenosos se continúan durante el curso postoperatorio y durante otros 14 días de antibióticos orales una vez que el paciente es dado de alta. Para los pacientes con hemotórax, los antibióticos se continúan en el postoperatorio durante 48 horas.
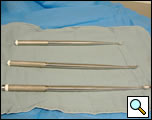
Figura 5. Curetas largas para su uso en la decorticación VATS.

Figura 4b: Pinzas de anillo curvo abiertas.
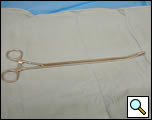
Figura 4a. Pinzas de anillo curvo cerradas (panel izquierdo) y abiertas (panel derecho).
Tarjeta de preferencia
- Toracoscopio de 30 grados
- Forceps anulares curvos (Figuras 4a, 4b)
- Succionador de Yankauer
- Disector de cacahuetes
- Curetas largas (Figura 5)
Consejos &Peligros
- Utilizar un succionador/dedo/esponja de amígdalas para crear «a ciegas» un espacio de trabajo en la cavidad pleural.
- Comprobar que el pulmón se reexpande para llenar el tórax adecuadamente antes de salir del quirófano.
- Si no se está seguro de la progresión de la operación, de la hemorragia, del tamaño de la fuga de aire y de la reexpansión del pulmón, proceder a la decorticación abierta.
Resultados
La decorticación toracoscópica está ya probada en el manejo del empiema y el tiempo transcurrido desde el origen del empiema y la intervención quirúrgica es probablemente el que más predice la capacidad de realizar la operación con éxito . La tomografía computarizada no es útil a este respecto, pero ayuda a la colocación del puerto y a la dirección de la decorticación dentro del tórax. Los principios de la decorticación abierta deben seguirse cuando se utiliza la tecnología toracoscópica. Todas las áreas de material fibrinoso deben ser drenadas y el pulmón subyacente debe ser liberado de una cáscara pleural restrictiva para permitir la reexpansión completa. Las tasas de éxito son elevadas y la duración del tubo torácico, la duración de la estancia hospitalaria, el dolor postoperatorio y la recuperación mejoran con respecto a la toracotomía. Las tasas de mortalidad son bajas, al igual que las tasas de recurrencia y las complicaciones. Las conversiones a toracotomía abierta son más frecuentes que después de otros procedimientos toracoscópicos, pero esto debe considerarse un ejercicio de buen juicio quirúrgico más que un fracaso de la técnica.
La decorticación toracoscópica amplía la versatilidad del cirujano torácico en su tratamiento de las infecciones del espacio pleural y puede utilizarse para el diagnóstico y tratamiento de las mismas con excelentes resultados.
Video 1
Video 2
Video 3
Video 4
Video 5
Video 6
Video 7
Vídeo 8
Vídeo 9
Vídeo 10
Vídeo 11
Vídeo 12
- Light RW. Derrames paraneumónicos y empiema. Proc Am Thorac Soc 2006;3:75-80.
- Cassina PC et al. Video-assisted thoracoscopy in the treatment of pleural empyema: stage-based management and outcome. J Thorac Cardiovasc Surg 1999;117:234-8.
- Lardinois D et al. El retraso en la derivación y los organismos gramnegativos aumentan la tasa de toracotomía de conversión en pacientes sometidos a cirugía toracoscópica asistida por vídeo para el empiema. Ann Thorac Surg 2005;79:1851-6.
- Roberts JR. Cirugía mínimamente invasiva en el tratamiento del empiema: toma de decisiones intraoperatorias. Ann Thorac Surg 2003;76:225-30.
- Navsaria PH, Vogel RJ, Nicol AJ. Evacuación toracoscópica del hemotórax postraumático retenido. Ann Thorac Surg 2004;78:282-6.
- Shimizu K, et al. Successful video-assisted mediastinoscopic drainage of descending necrotizing mediastinitis. Ann Thorac Surg 2006;81:2279-81.
- Hope WW, Bolton WD, Stephenson JE. The utility and timing of surgical intervention for parapneumonic empyema in the era of video-assisted thoracoscopy. Am Surg 2005;71:512-4.
- Luh SP, et al. Video-assisted thoracoscopic surgery in the treatment of complicated parapneumonic effusions or empyemas: outcome of 234 patients. Chest 2005;127:1427-32.
- Wurnig PN, et al. Video-assisted thoracic surgery for pleural empyema. Ann Thorac Surg 2006;81:309-13.