Introducción
El síndrome de la médula anclada (SCM) es un trastorno neurológico del desarrollo causado por un cono medular anormalmente bajo. Se presenta típicamente en la infancia, pero puede persistir sin ser detectado hasta la edad adulta, y puede estar asociado a un lipoma intradural. Los pacientes con anomalías coexistentes (por ejemplo, mielomeningocele) y síntomas clínicos claros (por ejemplo, debilidad progresiva de las piernas, incontinencia urinaria) pueden requerir tratamiento quirúrgico. El objetivo de la cirugía es desligar la médula espinal para aliviar su estiramiento. No obstante, las indicaciones de la cirugía siguen siendo controvertidas (1).
En cambio, la fístula arteriovenosa dural espinal (FAVD) es una afección adquirida. Es la malformación vascular más común en la columna vertebral en adultos. Se forma en el foramen neural por una conexión directa anormal entre la arteria dural (que suministra el manguito de la raíz dural y la duramadre espinal adyacente) y la vena medular (que drena el plexo venoso coronal) (2, 3).
Puede presentarse con dolor de espalda y déficit neurológico progresivo. Un SDAVF suele requerir un tratamiento quirúrgico o endovascular.
La coincidencia de TCS, lipoma (o lipomielomeningocele) y un SDAVF a nivel del sacro es muy rara. En esta comunicación informamos de dos pacientes de este tipo. (4-6).
Material del caso
Caso 1
Una mujer de 30 años se presentó con una historia de 10 años de dolor en la columna lumbosacra; había tenido una radiación casual en ambas extremidades inferiores. Después de su primer parto, desarrolló dolor de espalda. La resonancia magnética demostró una médula anclada en el nivel L4 y un lipoma del filum terminale. La RMN también mostró venas tortuosas en la superficie de la médula espinal (Figura 1C). Nueve años después, durante el segundo embarazo, notó debilidad y pérdida sensorial, desequilibrio con incontinencia urinaria y fecal. En el momento del ingreso, presentaba debilidad bilateral en la flexión plantar (grado 4 según el sistema modificado del Consejo de Investigación Médica) y reducción de la sensibilidad en las regiones glúteas y las piernas, así como de la respuesta plantar. Los signos de Babinski y Rossolimo estaban presentes bilateralmente. La repetición de la resonancia magnética reveló cambios hiperintensos en T2 intraespinal en la columna torácica y el cono (Figuras 1A,B,D). Dichos cambios eran consistentes con un déficit neurológico y, tras la exclusión de enfermedades desmielinizantes inflamatorias, sobre la base de una RMN cerebral y una prueba de anticuerpos contra la acuaporina 4, se diagnosticó como mielopatía. Debido a las venas tortuosas descritas en la superficie de la médula espinal (Figura 1B), el paciente fue sometido a una angiografía de sustracción digital (DSA) espinal. El alcance de la DSA fue desde el nivel Th6 hasta la arteria coccígea. Los resultados no revelaron ninguna malformación vascular. Por lo tanto, el diagnóstico preliminar fue de un TCS sintomático y un lipoma del filum terminale. En vista de la debilidad y el déficit neurológico se planificó la desligadura quirúrgica de la médula espinal, sin resección del lipoma.
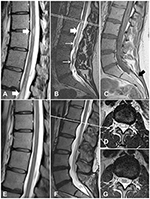
Figura 1. Imágenes de RM de la médula espinal del caso 1, antes y después del tratamiento. (A) Cambios mielopáticos en la médula espinal torácica (flechas blancas) (B) Cambios mielopáticos en el cono medular (flecha gruesa) y vasos tortuosos engrosados (flechas finas). (C)La secuencia T1WI muestra un lipoma del filum terminale (flecha negra). (D) Una sección transversal a nivel de L1/L2 muestra cambios mielopáticos. (E-G) Las imágenes de seguimiento demuestran la resolución de los cambios mielopáticos y la desaparición de las venas engrosadas.
El canal sacro se abrió con una incisión mediana. La duramadre era fina y transparente. Tras una incisión en la línea media de la duramadre y la aracnoides, se visualizó un tumor que parecía ser un lipoma. Engullía el filum terminale y las raíces nerviosas espinales caudalmente, hasta el nivel S2. Las raíces nerviosas S1 y S2 estaban situadas lateralmente al tumor. También se observó un vaso engrosado, tortuoso y de color rojo brillante en el filum terminale, que iba en dirección craneal. La superficie externa de la duramadre se exploró bilateralmente a nivel del sacro en busca de un SDAVF. Se identificó un nidus claramente visible a nivel de S3 en el lado izquierdo. Se realizó una prueba empírica para apoyar este hallazgo. Se colocó un clip en la vena arterializada, intraduralmente, durante unos minutos. A continuación, el vaso del filum terminale cambió claramente de color, pasando del rojo vivo al gris azulado, y su tensión disminuyó. A continuación, se desconectó el SDAVF por vía intradural y se coaguló el nido por vía extradural. Además, se cortó el filum terminale y se tomaron muestras del lipoma para su histología. Se suturó la duramadre de forma estanca y se cerró la herida por capas.
El curso postoperatorio no tuvo incidencias. Unos días después, el paciente fue dado de alta. Una resonancia magnética de seguimiento mostró la resolución de los cambios mielopáticos (Figuras 1E-G). En el seguimiento de 1 año, el paciente había mejorado considerablemente, sin incontinencia ni déficit motor.
Caso 2
Un varón de 33 años se presentó con una historia de 2 años de dolor en la columna lumbosacra con debilidad progresiva de los miembros inferiores, frecuencia urinaria e incontinencia. Los síntomas se intensificaban tras el ejercicio y la bipedestación prolongada. La resonancia magnética de la columna lumbar demostró una médula anclada en el nivel L3, un lipoma del filum terminale y un edema en la médula espinal. También mostró venas tortuosas en la superficie posterior de la médula espinal (Figuras 2A,D).
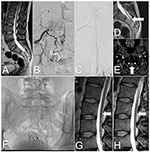
Figura 2. Imágenes de la médula espinal del caso 2, antes y después del tratamiento. (A) RMN ponderada en T2: Médula anclada y lipoma sacro. (B) DSA: SDAVF en el nivel S2-S3 suministrado por las arterias sacras laterales. (C) DSA: Venas tortuosas en la superficie posterior de la médula espinal cervical. (D) RMN ponderada en T2: Vena tortuosa en la superficie posterior de la médula espinal anclada (flecha). (E) RMN TOF: Vena drenante (flecha) a nivel de la unión atlanto-occipital. (F) La radiografía de la zona sacra muestra agentes embólicos después de tres embolizaciones. (G) RMN lumbar ponderada en T2: Tras la última embolización se aprecian vasos tortuosos en la superficie posterior de la médula espinal (flecha). (H) Resonancia magnética de seguimiento: a los 6 meses de la intervención, ya no se observan las venas tortuosas en la superficie posterior de la médula espinal (flecha).
El examen neurológico reveló debilidad bilateral en la flexión de la cadera (grado 4 según el sistema modificado del Consejo de Investigación Médica), debilidad en la flexión plantar (grado 3 según el sistema modificado del Consejo de Investigación Médica) y disminución de la sensibilidad en los dermatomas S2-S3. Los signos de Babinski y Rossolimo estaban presentes bilateralmente. Sobre la base de los signos clínicos y radiológicos, se sospechó una SDAVF. Una DSA confirmó la SDAVF a nivel de S2-S3, en la duramadre abastecida por las arterias sacras laterales y las ramas de las arterias ilíacas internas. Había venas tortuosas que drenaban en la superficie posterior de toda la médula espinal y terminaban intracranealmente (Figuras 2B,C,E).
El paciente fue sometido a tres embolizaciones endovasculares, cada una con un agente diferente. En primer lugar, se realizó una embolización con Onyx™ 18, administrado en dos microcatéteres. Este tratamiento dio lugar a la oclusión de la fístula. La paciente mejoró significativamente, pero debido a la escasa penetración de la vena drenante, al cabo de unas semanas, la fístula se recanalizó y los síntomas volvieron a aparecer.
Se realizó una segunda embolización 4 meses después. El acceso vascular a la fístula fue más complicado. Una inyección del 25% de Phil™ sólo era factible a través de las pequeñas ramas sacras de la arteria ilíaca interna izquierda. Este procedimiento consiguió una reducción significativa del flujo a través de la fístula. Dieciocho meses después se intentó la embolización de la fístula con pegamento diluido. A pesar de la buena oclusión de la fístula observada en una ASD, los vasos tortuosos seguían siendo visibles en la RM de seguimiento (Figuras 2F,G). Los síntomas persistían y el paciente fue calificado para el tratamiento quirúrgico.
El objetivo de la cirugía era ocluir la vena drenante y el alimentador arterial y reducir el lipoma. Con una incisión mediana, se abrió el canal sacro en el lado derecho. La duramadre era gruesa y había múltiples vasos llenos de agentes embólicos. Había un gran vaso de color rojo brillante extraduralmente y otro intraduralmente a nivel de S2-S3. Se colocó un clip en la vena arterializada intraduralmente durante un par de minutos. Después, el vaso cambió de color y la tensión disminuyó. Se coagularon los vasos intra y extradurales. A continuación, se visualizó el lipoma y se extrajo parcialmente. Se suturó la duramadre de forma estanca y se cerró la herida por capas.
El curso postoperatorio no tuvo incidencias y, unos días después, el paciente fue dado de alta. Después de 6 meses, una resonancia magnética de seguimiento mostró la ausencia de vasos tortuosos en la superficie posterior de la médula espinal y una reducción significativa de los cambios mielopáticos (Figura 2H). En el seguimiento, la paciente mejoró considerablemente, sin incontinencia, con cierta frecuencia urinaria y una leve debilidad (grado 4 según el sistema modificado del Consejo de Investigación Médica).
Discusión
La co-ocurrencia de un TCS, un lipoma intradural y un SDAVF a nivel del sacro, aunque excepcional, debe tenerse en cuenta, a la luz del creciente número de casos reportados. En este estudio se describen el quinto y el sexto caso de este tipo, con un TCS y un SDAVF a nivel del sacro (Tabla 1). Recientemente, uno de estos casos fue enumerado por Horiuchi et al. y otros dos fueron añadidos por Talenti et al. (6, 8).

Tabla 1. Revisión bibliográfica sobre la coincidencia de la fístula arteriovenosa dural sacra (FAVS), el síndrome del cordón umbilical (SCM) y el lipoma/lipomielomeningocele del filum terminal.
La causa de esta triple coincidencia es enigmática. Por un lado, se cree que el SDAVF es una entidad adquirida, en contraste con las anomalías espinales primarias. Esta característica sugiere que la coexistencia de estas patologías podría ser accidental. Por otro lado, tanto los lipomas como los angiomas tienen un origen mesenquimal. Informes anteriores de MAV intramedular y lipoma combinados sugieren que puede haber una correlación entre estas etiologías (9, 10). Sin embargo, hasta donde sabemos, ningún estudio previo ha descrito la coexistencia de anomalías disráficas y un SDAVF a nivel del sacro, que se presentó en la infancia. Además, una búsqueda en la base de datos Medline no reveló ningún informe sobre un SDAVF congénito. Sin embargo, varios informes han descrito una SDAVF secundaria a una cirugía o a un traumatismo (11-15). Por lo tanto, teóricamente, una intervención quirúrgica previa por un mielomeningocele podría desencadenar posteriormente la formación de un SDAVF.
Estudios anteriores han informado de que una trombosis del seno venoso con hipertensión intravenosa asociada y una obstrucción del flujo de salida venoso podrían iniciar la formación de shunts (16-18). Por lo tanto, una explicación alternativa de la coexistencia de los trastornos encontrados en nuestros casos podría haber sido que un lipoma causara presión, que obstruyera el flujo de salida venoso y, por lo tanto, promoviera la formación de un SDAVF. Este mecanismo alternativo no estaría relacionado con una historia previa de traumatismo o cirugía.
Los SDAVF adquiridos se localizan típicamente en la región toracolumbar, y la edad media de presentación es de unos 60 años (19). Los SDAVF sacros son raros, y la edad media de presentación de los SDAVF que coexisten con un TCS es de 41 años (Tabla 1). Por lo tanto, también es posible que una anomalía congénita, como un lipoma intradural, pueda promover la formación de un SDAVF a una edad más temprana. Recientemente, Horiuchi et al. describieron dos casos y revisaron nueve casos previamente publicados de SDAVF y MAV que coexistieron con lipomas espinales de diferentes tipos y a diferentes niveles espinales (8). Tanto Djindjian et al. como Horiuchi et al. postularon que el mecanismo más probable que subyace a la formación retardada de un SDAVF podría ser la liberación por parte de los adipocitos de factores angiogénicos; estos factores pueden influir en la angiogénesis (20) y provocar una hipervascularización local (5, 8). Además, Jellema et al. excluyeron los factores protrombóticos en la patogénesis de los SDAVF (21).
La coincidencia sintomática del TCS, el lipoma sacro y los SDAVF da lugar a la pregunta: ¿qué impulsa exactamente los síntomas? Talenti et al. han descrito recientemente las dificultades diagnósticas y terapéuticas de dos casos similares (6). En esos dos pacientes, una desligadura inicial de la médula espinal y la extirpación del lipoma/lipomielomeningocele no dieron lugar a una mejora ni a un deterioro. Tras la angiografía espinal, abordaron la patología vascular espinal. La historia natural del lipoma del filum terminale es benigna; sólo el 5% de los pacientes presentan síntomas de TCS (22). Por lo tanto, el lipoma era la causa menos probable de deterioro neurológico. No obstante, hasta cierto punto, tanto el TCS como el SDAVF podrían causar síntomas similares. Un TCS se vuelve sintomático con más frecuencia en los niños que en los adultos (23). En cambio, las deficiencias relacionadas con los SDAVF se desarrollan en individuos de edad avanzada y media. Además, los SDAVF sacros inducen hiperintensidades de la médula espinal, visibles en las resonancias magnéticas ponderadas en T2, que suelen desaparecer tras un tratamiento exitoso (24). Por lo tanto, la causa más probable del deterioro neurológico es el SDAVF, basándose en la edad media de los pacientes con TCS, lipoma sacro y SDAVF coincidentes (véase la Tabla 1) y basándose en el buen resultado postoperatorio; es decir, la resolución de los cambios intramedulares, demostrada en las RMN. Además, a diferencia del TCS, los síntomas del SDAVF pueden exacerbarse con el esfuerzo físico y con el aumento de la presión intraabdominal, como en los dos casos descritos en el presente estudio.
En los pacientes con esta triple coincidencia, el SDAVF fue siempre la causa directa del aumento de los síntomas. Por lo tanto, el objetivo principal del tratamiento debe ser la oclusión. En la literatura, la embolización endovascular parecía ser igual de eficaz que la cirugía, y la embolización fue el único tratamiento en casos similares (24). Lamentablemente, la embolización fue inviable o ineficaz en nuestros casos. Con la cirugía, tanto el SDAVF como el TCS podrían explorarse y tratarse en un solo procedimiento.
En nuestro primer caso, el objetivo inicial de la cirugía era desatar la médula espinal, porque el SDAVF no se confirmó en una DSA preoperatoria. Sin embargo, la pregunta sigue siendo, ¿por qué el SDAVF estaba oculto en la DSA? Oldfield et al. describieron tres casos de SDAVF que no se detectaron en una DSA, pero que eran altamente sospechosos, basándose en otras modalidades de neuroimagen. Esos SDAVF se desconectaron con éxito durante la cirugía (25). Los factores que impidieron la detección de los SDAVF espinales fueron la obesidad, el aneurisma aórtico, la aterosclerosis aórtica con tortuosidad y la obstrucción del orificio o la tortuosidad de las arterias lumbares. En nuestro caso, una posible explicación de los resultados falsos negativos de la ASD podría ser que la ASD no fue lo suficientemente exhaustiva; por lo tanto, no examinamos el flujo de entrada a nivel sacro.
Los dos casos descritos aquí mostraron que los SDAVF sacros pueden ser difíciles de detectar en las ASD y difíciles de ocluir con embolización endovascular. Los estudios anteriores presentados en la Tabla 1 también describen embolizaciones sin éxito en el tratamiento de los SDAVF (4, 6, 8). En total, ha habido 5 intentos fallidos de oclusión endovascular en 3 de los 6 casos reportados (Tabla 1). Por lo tanto, concluimos que un enfoque quirúrgico podría ser superior a la embolización endovascular, ya que la cirugía ofrece un tratamiento de un solo paso.
Observaciones finales
La concurrencia de TCS, lipoma y SDAVF a nivel del sacro es excepcionalmente rara. Los informes anteriores y nuestros hallazgos revelan que la cirugía podría ser superior a la embolización endovascular para tratar los SDAVF sacros con entidades coexistentes, porque la cirugía ofrece un tratamiento de un solo paso. Un número creciente de casos notificados ha indicado que los síntomas de este triple trastorno pueden ser causados únicamente por el SDAVF, y no por el TCS o el lipoma, que son claramente visibles en la neuroimagen.
Consentimiento
Se obtuvo un consentimiento informado por escrito de los participantes para la publicación de este informe de caso.
Contribuciones de los autores
PK diseñó el proyecto y lo revisó críticamente. ŁP preparó el manuscrito, recogió y revisó los datos. PJ, MZ y MG recogieron los datos de los casos. BC revisó la anatomía. AM hizo la aprobación final de la versión a publicar.
Declaración de conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un potencial conflicto de intereses.
1. Drake JM. Manejo quirúrgico de la médula espinal anclada: caminando por la fina línea. Neurosurg Focus. (2007) 23:E4. doi: 10.3171/FOC-07/08/E4
PubMed Abstract | CrossRef Full Text
2. McCutcheon IE, Doppman JL, Oldfield EH. Anatomía microvascular de las anomalías arteriovenosas durales de la columna vertebral: un estudio microangiográfico. J Neurosurg. (1996) 84:215-20. doi: 10.3171/jns.1996.84.2.0215
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Gailloud P. Variante de fístula arteriovenosa dural espinal (SDAVF) con doble drenaje perimedular y epidural. Eur Spine J. (2017). 27(Suppl 3):375-9. doi: 10.1007/s00586-017-5298-x
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Krisht KM, Karsy M, Ray WZ, Dailey AT. Fístula arteriovenosa dural tipo I extraespinal con un lipomielomeningocele lumbosacro: informe de un caso y revisión de la literatura. Case Rep Neurol Med. (2015) 2015:526321. doi: 10.1155/2015/526321
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Djindjian M, Ayache P, Brugieres P, Poirier J. Lipoma sacro del filum terminale con fístula arteriovenosa dural. Case report. J Neurosurg. (1989) 71(5 Pt 1):768-71. doi: 10.3171/jns.1989.71.5.0768
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Talenti G, Vitale G, Cester G, Della Puppa A, Faggin R, Causin F. Rara asociación entre fístulas arteriovenosas durales espinales y disrafismos: informe de dos casos y revisión de la literatura con un enfoque en las trampas en el diagnóstico y el tratamiento. Intervent Neuroradiol. (2017) 23:458-64. doi: 10.1177/1591019917714636
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Przepiórka Ł, Kunert P, Juszynńska P, Zawadzki M, Ciszek B, Głowacki M, et al. Coincidencia de médula anclada, lipoma del filum terminale y fístula arteriovenosa dural sacra: informe de dos casos y revisión de la literatura. Front Neurol. (2018) 9:807. doi: 10.3389/fneur.2018.00807
CrossRef Full Text | Google Scholar
8. Horiuchi Y, Iwanami A, Akiyama T, Hikata T, Watanabe K, Yagi M, et al. Fístula arteriovenosa espinal coexistente dentro de un lipoma espinal: informe de dos casos. Spinal Cord Series Cases (2017) 3:17079. doi: 10.1038/s41394-017-0011-1
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Weon YC, Chung JI, Roh HG, Eoh W, Byun HS. Combinación de malformación arteriovenosa intramedular espifnal y lipomielomeningocele. Neuroradiology (2005) 47:774-9. doi: 10.1007/s00234-005-1336-1
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Rice JF, Jelsma RK. Combinación de malformación arteriovenosa y lipoma intramedular: cirugía y emboloterapia. Am J Neuroradiol. (1986) 7:171-3.
PubMed Abstract | Google Scholar
11. Asakuno K, Kim P, Kawamoto T, Ogino M. Dural arteriovenous fistula and progressive conus medullaris syndrome as complications of lumbar discectomy. Case report. J Neurosurg. (2002) 97(3 Suppl):375-9. doi: 10.3171/spi.2002.97.3.0375
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Kang JW, Koo JH, Kim DK, Joo YJ, Kim TH, Song SH. Mielopatía causada por la fístula arterio-venosa dural espinal después de la primera fractura del cuerpo vertebral lumbar – un informe de caso. Ann Rehabil Med. (2011) 35:729-32. doi: 10.5535/arm.2011.35.5.729
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Vankan Y, Demaerel P, Heye S, Van Calenbergh F, van Loon J, Maleux G, et al. Fístula arteriovenosa dural como complicación tardía de fractura de columna cervical superior. Case report. J Neurosurg. (2004) 100(4 Suppl Spine):382-4. doi: 10.3171/spi.2004.100.4.0382
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Nishimura Y, Natsume A, Ginsberg HJ. Fístula arteriovenosa dural espinal asociada a espondilolistesis ístmica L-4. J Neurosurg Spine (2014) 20:670-4. doi: 10.3171/2014.3.SPINE13492
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Khaldi A, Hacein-Bey L, Origitano TC. Spinal epidural arteriovenous fistula with late onset perimedullary venous hypertension after lumbar surgery: case report and discussion of the pathophysiology. Spine (2009) 34:E775-9. doi: 10.1097/BRS.0b013e3181ae4a52
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Jablawi F, Nikoubashman O, Mull M. Arterial Hypertension is associated with symptomatic spinal dural arteriovenous fistulas. World Neurosurg. (2017) 103:360-3. doi: 10.1016/j.wneu.2017.04.050
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Borden JA, Wu JK, Shucart WA. Una propuesta de clasificación para las malformaciones fistulosas arteriovenosas durales y craneales e implicaciones para el tratamiento. J Neurosurg. (1995) 82:166-79. doi: 10.3171/jns.1995.82.2.0166
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Lawton MT, Jacobowitz R, Spetzler RF. Papel redefinido de la angiogénesis en la patogénesis de las malformaciones arteriovenosas durales. J Neurosurg. (1997) 87:267-74. doi: 10.3171/jns.1997.87.2.0267
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Wojciechowski J, Kunert P, Nowak A, Dziedzic T, Czernicki T, Wojtowicz K, et al. Tratamiento quirúrgico de las fístulas arteriovenosas durales espinales: Outcome, complications and prognostic factors. Neurol Neurochir Pol. (2017). 51:446-53. doi: 10.1016/j.pjnns.2017.07.001
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Lucarelli E, Sangiorgi L, Benassi S, Donati D, Gobbi GA, Picci P, et al. Angiogénesis en el lipoma: An experimental study in the chick embryo chorioallantoic membrane. Int J Mol Med. (1999) 4:593-6. doi: 10.3892/ijmm.4.6.593
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Jellema K, Tijssen CC, Fijnheer R, de Groot PG, Koudstaal PJ, van Gijn J. Spinal dural arteriovenous fistulas are not associated with prothrombotic factors. Stroke (2004) 35:2069-71. doi: 10.1161/01.STR.0000135766.22285.dc
CrossRef Full Text | Google Scholar
22. Cools MJ, Al-Holou WN, Stetler WR Jr, Wilson TJ, Muraszko KM, Ibrahim M, et al. Lipomas del filum terminale: prevalencia de imágenes, historia natural y posición del cono. J Neurosurg Pediatr. (2014) 13:559-67. doi: 10.3171/2014.2.PEDS13528
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Al-Holou WN, Muraszko KM, Garton HJ, Buchman SR, Maher CO. El resultado de la liberación de la médula anclada en el síndrome de la médula anclada secundaria y de repetición múltiple. J Neurosurg Pediatr. (2009) 4:28-36. doi: 10.3171/2009.2.PEDS08339
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Gioppo A, Farago G, Giannitto C, Caputi L, Saladino A, Acerbi F, et al. Sacral dural arteriovenous fistulas: a diagnostic and therapeutic challenge – single-centre experience of 13 cases and review of the literature. J Neurointerv Surg. (2017). 10:415-21. doi: 10.1136/neurintsurg-2017-013307
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Oldfield EH, Bennett A 3rd Chen MY, Doppman JL. Manejo exitoso de fístulas arteriovenosas durales espinales no detectadas por arteriografía. Report of three cases. J Neurosurg. (2002) 96(2 Suppl):220-9. doi: 10.3171/spi.2002.96.2.0220
PubMed Abstract | CrossRef Full Text | Google Scholar