En la reunión de la Academia Americana de Oftalmología de 2013 participé en un debate sobre los pros y los contras de utilizar medicamentos genéricos frente a los de marca. Se me pidió que argumentara a favor de los medicamentos de marca, pero como en la mayoría de los debates, es una simplificación excesiva tomar ciegamente un lado u otro. La realidad es más complicada. Los genéricos tienen el coste a su favor, pero a veces no proporcionan las mismas especificaciones de tratamiento o los mismos resultados que los medicamentos de marca, a pesar de los esfuerzos de la Administración de Alimentos y Medicamentos para garantizar que así sea.
Aquí me gustaría hablar de algunas de las formas en que los genéricos pueden diferir de los medicamentos de marca a los que sustituyen, y de lo que los médicos deben tener en cuenta.
La cuestión de la bioequivalencia
Los obstáculos necesarios para comercializar un nuevo medicamento «innovador» son sustancialmente diferentes de los de un medicamento genérico de continuación. Por supuesto, esa es parte de la razón por la que un medicamento de marca cuesta más. Mientras que el medicamento innovador inicial tiene que demostrar su seguridad y eficacia mediante ensayos clínicos, un genérico sólo tiene que demostrar su bioequivalencia.
Aunque la bioequivalencia parece implicar la realización de estudios biológicos, la FDA la define como la demostración de que los ingredientes de su versión genérica son una copia exacta de los ingredientes del medicamento original, incluyendo tanto los principios activos como los excipientes. (Si los principios activos y los excipientes no son idénticos, el medicamento no se considera genérico; tiene que pasar por la aprobación normal de la FDA como cualquier medicamento nuevo). La premisa es que esto hará que el genérico tenga la misma seguridad y eficacia que el medicamento de marca.
Desgraciadamente, la idea de que los genéricos son iguales a los medicamentos de marca porque los ingredientes son los mismos no es necesariamente cierta. Muchos de los factores que afectan a la eficacia de un medicamento tópico son independientes de los ingredientes del frasco. Por ejemplo:
– El material del frasco importa. Los ingredientes de muchos medicamentos de marca coinciden con el material del frasco que se utiliza. Este fue ciertamente el caso del latanoprost, donde la compatibilidad con el material del frasco fue una parte importante del proceso de investigación y desarrollo cuando se lanzó Xalatan al mercado. Esto no es algo que investigue directamente la FDA.
– La forma y el tamaño del frasco afectan al uso. Los ensayos de medicamentos innovadores no sólo prueban el fármaco sino también el frasco en el que se entregará a los pacientes, por lo que se ha tenido en cuenta el impacto de la forma y el tamaño del frasco. Sin embargo, los fabricantes de medicamentos genéricos no están obligados a copiar la forma y el tamaño del frasco, y esto puede suponer una diferencia en la facilidad con la que los pacientes pueden utilizar el medicamento.
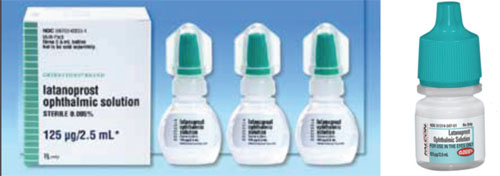
Una cuestión que puede causar confusión al cambiar de un medicamento de marca a uno genérico, o de un genérico a otro, es la diferencia en la forma y el color del tapón.
Por ejemplo, Xalatan se presenta en un frasco plano y pequeño que requiere cierto esfuerzo y delicadeza para apretarlo con el fin de instilar una gota. En cambio, algunos de los frascos genéricos de latanoprost son redondos y más rígidos, lo que hace que el frasco sea más difícil de apretar para el paciente. (Muchos de nuestros pacientes son mayores y tienen limitaciones físicas. Si están acostumbrados a apretar un frasco particular que es plano y ligeramente menos rígido, y luego cambian a un frasco que es redondo y más rígido, el proceso de aplicación -y su adherencia a la medicación- podría ser diferente que cuando usaban el frasco anterior. Además, como la forma y el tamaño del frasco son elegidos por cada fabricante de genéricos, los pacientes pueden recibir a veces el medicamento en un frasco plano y otras veces en un frasco redondo. Esto ha creado mucha confusión con nuestros pacientes.
– El color de la tapa no siempre coincide. Los colores de las tapas de los frascos de los medicamentos oftálmicos están pensados para ser coordinados en función de la categoría del medicamento. La FDA trata de garantizar que el color sea el correcto, pero ha habido casos en los que se ha colado un tapón de otro color. Como resultado, a veces el color de la tapa del frasco del medicamento genérico (así como la forma y el tamaño) es diferente al del medicamento de marca (véase el ejemplo anterior). Esto crea mucha confusión cuando los pacientes intentan recordar cuál de varias gotas deben tomar en cada momento.
Incluso si un paciente nunca ha utilizado el medicamento de marca con el color correcto del tapón, un color alterado sigue siendo un problema; el nuevo color del tapón podría ser en realidad del mismo color que otro medicamento que el paciente está tomando. Por ejemplo, los frascos de análogos de prostaglandinas deben tener tapas de color verde azulado. Si su paciente está utilizando una versión genérica cuyo frasco tiene un tapón blanco, podría confundirlo con otras clases de medicamentos que se supone que tienen un tapón blanco.
Si observa un ejemplo de color de tapón incorrecto, la FDA ha dicho que le gustaría saberlo para poder tomar medidas para corregir la discrepancia.
– El tamaño de las gotas puede ser diferente. Los frascos de gotas tópicas que se comercializan actualmente proporcionan una dosis de 30 a 50 µl por gota. Desgraciadamente, puede haber mucha variabilidad entre las fórmulas de marca y las genéricas simplemente porque la punta puede tener un agujero más grande o más pequeño. Obviamente, esto puede afectar a la cantidad de fármaco que llega al ojo; puede ser menos o más.
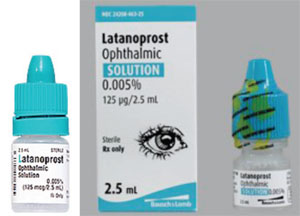
Otro problema son las diferencias en la forma y la rigidez del frasco, que pueden dificultar la aplicación de las gotas para un paciente mayor. Por ejemplo, el xalatán viene en un frasco plano; muchos genéricos del medicamento vienen en frascos redondos que son más difíciles de apretar.
Aún más interesante, hubo un timolol genérico que salió al mercado que no tenía ningún orificio en la punta; el paciente tenía que perforar la punta para sacar la medicación, similar a un tubo de superglue. Esto creaba confusión en muchos pacientes; algunos no se daban cuenta de que debían hacer esto, e intentaban usar las gotas de todos modos. Pensaban que se estaban poniendo una gota, pero nunca habían abierto el frasco, así que no salía nada. Otros pensaron que el frasco estaba defectuoso o vacío. Además, un orificio hecho por uno mismo podría acabar siendo de cualquier tamaño, afectando a la dosis, y el proceso de hacer el orificio podría comprometer fácilmente la esterilidad del contenido.
Todas estas consideraciones -material del frasco, forma y tamaño, color del tapón y diámetro del orificio de la gota- son muy importantes tanto para el médico como para el paciente. Desgraciadamente, estas consideraciones pueden pasarse por alto, porque la atención se centra en intentar demostrar la bioequivalencia.
– El medicamento genérico de un paciente puede tener un aspecto diferente de un mes a otro. Este es otro desafortunado efecto secundario de los medicamentos genéricos. Sucede porque puede haber múltiples fabricantes de un determinado genérico, cada uno con un frasco diferente. Por ejemplo, ahora mismo hay entre seis y ocho fabricantes diferentes de latanoprost genérico en el mercado estadounidense. El que vende una farmacia determinada puede cambiar, porque una cadena como CVS, Walgreens o Walmart suele optar por el fabricante que ofrece al grupo farmacéutico la mejor oferta en un momento dado. En consecuencia, una farmacia puede cambiar el genérico que ofrece cuando llega una oferta más baja de otro fabricante de genéricos. Por lo tanto, aunque el paciente acuda a la misma farmacia, puede acabar recibiendo diferentes versiones genéricas de un medicamento en distintos momentos. Esto puede resultar confuso si los frascos tienen un aspecto y/o un comportamiento diferente. (Incluso podría haber una diferencia en la tolerancia y el control de la PIO entre los dos.)
El prospecto
Históricamente, incluso si un medicamento genérico resulta tener un problema, las normas actuales impiden a los fabricantes alertar a los médicos o pacientes. Existe una norma que obliga a los fabricantes de medicamentos genéricos a incluir una copia exacta del prospecto que se incluye con el medicamento innovador. Aunque esta norma pretendía reflejar la idea de que los medicamentos son bioequivalentes, el efecto secundario involuntario ha sido evitar imponer a los fabricantes de genéricos los mismos requisitos de diligencia y la carga de garantizar la seguridad que exigimos a los fabricantes de marca.
Como resultado, si el fabricante de genéricos introduce un medicamento en el mercado y observa algunos efectos secundarios o adversos que se producen con el producto genérico, no se le permite cambiar el prospecto para alertar a los médicos y pacientes de que puede haber un problema. Además, esta norma puede en realidad reducir la motivación de los fabricantes de genéricos para llevar a cabo un control adecuado de sus productos; después de todo, no existe la amenaza de una demanda si surge un problema.
Afortunadamente, esta cuestión ha llamado la atención de la FDA. En noviembre de 2013, la FDA propuso una norma que permitiría a los fabricantes de medicamentos genéricos actualizar sus etiquetas si reciben información sobre posibles problemas de seguridad. Si se aprueba, esto contribuirá en gran medida a garantizar la seguridad de nuestros pacientes.
Genéricos importados
Otro problema con los genéricos es que muchos de ellos se fabrican fuera de Estados Unidos, donde el control de calidad ha sido a veces una verdadera preocupación. Los problemas han ido desde misteriosas impurezas encontradas en los medicamentos, pasando por una coincidencia imperfecta de los ingredientes, hasta formulaciones francamente fraudulentas que no sirven para nada (lo que en algunos casos puede provocar graves daños a los pacientes).
La realidad es que los genéricos no son necesariamente iguales a los medicamentos de marca, aunque hayan cumplido el requisito de bioequivalencia de la FDA. Eso significa que cuando se utilizan medicamentos genéricos, la carga de garantizar la seguridad y la eficacia recae sobre nosotros y nuestros pacientes.
Según el New York Times, la industria farmacéutica india suministra actualmente el 40% de los medicamentos de venta libre y genéricos que se consumen en Estados Unidos. Muchas de sus fábricas son de categoría mundial y «prácticamente indistinguibles» de las instalaciones de fabricación estadounidenses (según el Times), y producen medicamentos de alta calidad y fiabilidad. Pero al mismo tiempo, la Organización Mundial de la Salud ha calculado que uno de cada cinco medicamentos fabricados en la India son falsos. (Se han registrado problemas similares con medicamentos fabricados en otros países, incluida China.)
Nuestro grupo realizó un estudio hace un par de años en el que se comparaba el latanoprost fabricado en la India con el Xalatan. Descubrimos que la estabilidad de los principios activos no era la misma a lo largo del tiempo ni cuando se sometían al calor. Además, encontramos contaminantes en todos los frascos importados, incluidos filamentos microscópicos parecidos a una cuerda, y lo que denominamos «ovnis».
La cuestión es que la supervisión de las prácticas de fabricación que se llevan a cabo en el extranjero en empresas no radicadas en Estados Unidos, especialmente en empresas que no tienen medicamentos de marca en el mercado, no es la misma.
Algunos médicos pueden suponer que estos medicamentos importados sólo son un problema cuando los pacientes compran medicamentos fuera de Estados Unidos a través de Internet para ahorrar dinero, pero la realidad es que estas importaciones están cada vez más disponibles aquí. Las formulaciones indias de timolol y travoprost están actualmente disponibles a través de distribuidores con sede en Estados Unidos, y otros fármacos como los AINE estarán disponibles pronto. Evidentemente, muchas empresas de fuera de Estados Unidos producen genéricos de alta calidad; lo que preocupa es que algunas no lo hagan. Eso hace que los médicos y los pacientes tengan que asegurarse de que un determinado genérico es seguro y eficaz. (Al menos los medicamentos que están disponibles dentro de los Estados Unidos han pasado por el proceso de bioequivalencia de la FDA; los medicamentos que algunos pacientes compran fuera del país a través de Internet pueden no haberlo hecho, lo que los hace aún más sospechosos.)
Estrategias de clínica
Debido a todas las variables que hemos estado discutiendo, los médicos deben estar muy atentos a lo que sucede con los pacientes cuando cambian de un medicamento de marca a uno genérico, o cambian de un genérico a otro. Tenemos que estar atentos para asegurarnos de que el control de la presión intraocular no se tambalea y que los pacientes no presentan nuevos signos y síntomas de intolerancia a la medicación.
Aquí hay algunas cosas que puede hacer para proteger a sus pacientes (y a su consulta):
– Pedir a los pacientes que traigan sus gotas. Pido a mis pacientes que lo hagan independientemente de los medicamentos que estén utilizando, y muchos de ellos lo hacen. Eso me da la oportunidad de registrar qué fabricante de genéricos están utilizando y hacer todo lo posible para mantener un control sobre eso, de modo que si se produce un problema o algo cambia, puedo buscar una posible conexión.
– Haga que los pacientes que se cambian a un nuevo genérico vuelvan a la clínica antes de lo que usted les haría volver. Esto le permitirá asegurarse de que no se produzcan consecuencias adversas. Esté atento a los cambios de eficacia o a los nuevos signos o síntomas.
– Si observa que surge algún problema cuando un paciente cambia a un genérico, avise a la FDA. Recuerde que esta situación hace recaer en el médico la carga de asegurarse de que el medicamento genérico es realmente seguro y eficaz.
– Si a un paciente no le va tan bien con un genérico, haga el esfuerzo de conseguir que la aseguradora cubra el medicamento de marca. Me he enfrentado a pacientes que toleraban el medicamento de marca pero tenían dificultades para tolerar un genérico debido a efectos secundarios como el enrojecimiento o la irritación. En esos casos, escribimos a la compañía de seguros y hacemos todo lo posible para que el paciente vuelva a la formulación de marca.
Por ejemplo, un medicamento de marca puede contener un conservante específico, mientras que la formulación genérica tiene un conservante alternativo al que el paciente es sensible. Travatan Z es un medicamento de marca fabricado por Alcon que contiene el conservante SofZia en lugar de cloruro de benzalconio; las versiones genéricas contienen BAK porque su bioequivalencia se basó en la versión más antigua de travoprost. Si una farmacia cambia a un paciente alérgico al BAK por el medicamento genérico, se convierte en un problema.
Desgraciadamente, al ver miles de pacientes al año en nuestra consulta, es realmente difícil asegurarse de que ganamos la batalla para cada paciente que acaba en esta situación. Sin embargo, hacemos el esfuerzo.
La carga recae sobre nosotros
Los genéricos están aquí para quedarse, y se están convirtiendo en una parte importante del tratamiento de todas las enfermedades, no sólo en oftalmología. Suelen ser seguros y eficaces, y pueden suponer un ahorro de costes tanto para los pacientes como para el sistema sanitario en general. No nos equivoquemos: soy un gran partidario de la reducción de costes. Si podemos encontrar una forma segura de reducir los costes manteniendo una atención excelente, estoy a favor. Es la segunda parte de esa ecuación la que tenemos que vigilar.
Yo mismo utilizo medicamentos genéricos todos los días, y la inmensa mayoría de mis pacientes los toman ahora. Casi todos lo hacen muy bien, con un buen control de la PIO y una buena tolerancia a los medicamentos. Así que ciertamente no estoy diciendo que debamos evitar el uso de genéricos. Sin embargo, la realidad es que los genéricos no son necesariamente iguales a los medicamentos de marca, aunque hayan cumplido el requisito de bioequivalencia de la FDA. Esto significa que cuando se utilizan medicamentos genéricos, la carga de garantizar la seguridad y la eficacia recae sobre nosotros y nuestros pacientes. REVISIÓN
El Dr. Kahook es titular de la cátedra de oftalmología de la familia Slater y vicepresidente de investigación clínica y traslacional de la Facultad de Medicina de la Universidad de Colorado en Denver. Es consultor de Allergan y Alcon y recibe apoyo para la investigación.