Mi opinión aquí sería que ya tienes la fórmula empírica del ácido tartárico, y que debes encontrar su fórmula molecular utilizando su masa molar.
Suponiendo que el punto de partida aquí es la fórmula empírica del ácido tartárico se ve así
#»C»_2 «H»_3 «O»_3 -># fórmula empírica
Ahora, la fórmula empírica de un compuesto te dice la proporción de números enteros más pequeña que existe entre los átomos de sus elementos constitutivos.
En este caso, sabes que la fórmula molecular, que te dice el número exacto de átomos que forman una molécula de dicho compuesto, contendrá
#color(negro)(«2 átomos de C» color(rojo)(» por cada «) {(«3 átomos de H»),(«3 átomos de O») :}#
En esencia, estás buscando un múltiplo de la fórmula empírica.
Se dice que el ácido tartárico tiene una masa molar de #»150 g mol»^(-1)#. Tu objetivo aquí será determinar la masa molar de su fórmula empírica, y luego usar este valor para determinar la fórmula molecular del compuesto.
En este caso, tendrás
#2 xx «12.011 g mol»^(-1) «»color(azul)(+)#
#3 xx «1,00794 g mol»^(-1)#
#3 xx «15,9994 g mol»^(-1)#
#color(blanco)(aaaaaaaaaaaaaa)/color(blanco)(aaaaaaaaaaaaa)#
#»75.044 g mol»^(-1) -> #la masa molar de la fórmula empírica
Entonces, si la fórmula empírica tiene una masa molar de #»75.044 g mol»^(-1)#, y la masa molar del ácido tartárico es #»150 g mol»^(-1)#, se deduce que habrá que multiplicar la fórmula empírica por
#(150color(rojo)(cancel(color(negro)(«g mol»^(-1)))))/(75.044color(rojo)(cancel(color(negro)(«g mol»^(-1))))) = 1.999 ~~ color(rojo)(2)#
para obtener la fórmula molecular. Esto significa que la fórmula molecular del ácido tartárico será
#(«C»_2 «H»_3 «O»_3)_color(rojo)(2) implica color(verde)(|bar(ul(color(blanco)(a/a) «C»_4 «H»_6 «O»_6color(blanco)(a/a)|))#
Así se ve una molécula de ácido tartárico
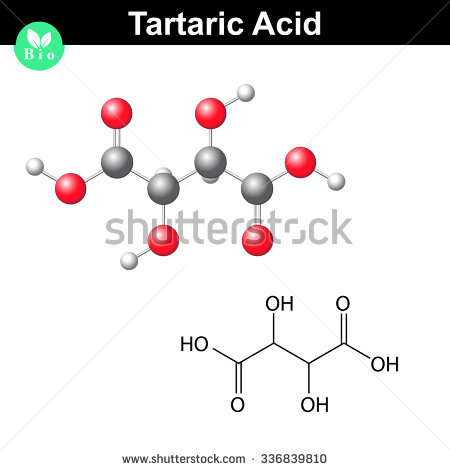
.