Piles photovoltaïques (galvaniques)
Pour illustrer les principes de base d’une cellule galvanique, considérons la réaction du zinc métallique avec l’ion cuivrique (Cu2+) pour donner du cuivre métallique et l’ion Zn2+. L’équation chimique équilibrée est la suivante :
\
Nous pouvons provoquer cette réaction en insérant une tige de zinc dans une solution aqueuse de sulfate de cuivre(II). Au fur et à mesure de la réaction, la tige de zinc se dissout, et une masse de cuivre métallique se forme. Ces changements se produisent spontanément, mais toute l’énergie libérée est sous forme de chaleur plutôt que sous une forme pouvant être utilisée pour effectuer un travail.
Cette même réaction peut être réalisée en utilisant la cellule galvanique illustrée sur la figure \(\PageIndex{3a}\). Pour assembler la cellule, une bande de cuivre est insérée dans un bécher qui contient une solution 1 M d’ions Cu2+, et une bande de zinc est insérée dans un autre bécher qui contient une solution 1 M d’ions Zn2+. Les deux bandes métalliques, qui servent d’électrodes, sont reliées par un fil, et les compartiments sont reliés par un pont salin, un tube en forme de U inséré dans les deux solutions et contenant un électrolyte liquide ou gélifié concentré. Les ions du pont salin sont choisis de manière à ne pas interférer avec la réaction électrochimique en étant eux-mêmes oxydés ou réduits ou en formant un précipité ou un complexe ; les cations et anions couramment utilisés sont Na+ ou K+ et NO3- ou SO42-, respectivement. (Les ions du pont salin ne doivent pas nécessairement être les mêmes que ceux du couple redox dans l’un ou l’autre compartiment). Lorsque le circuit est fermé, une réaction spontanée se produit : le zinc métallique est oxydé en ions Zn2+ à l’électrode de zinc (l’anode), et les ions Cu2+ sont réduits en Cu métallique à l’électrode de cuivre (la cathode). Au fur et à mesure de la réaction, la bande de zinc se dissout et la concentration en ions Zn2+ dans la solution de Zn2+ augmente ; simultanément, la bande de cuivre prend de la masse et la concentration en ions Cu2+ dans la solution de Cu2+ diminue (figure \(\PageIndex{3b}\)). Nous avons donc réalisé la même réaction qu’avec un seul bécher, mais cette fois, les demi-réactions d’oxydation et de réduction sont physiquement séparées l’une de l’autre. Les électrons qui sont libérés à l’anode circulent dans le fil, produisant un courant électrique. Les cellules galvaniques transforment donc l’énergie chimique en énergie électrique qui peut ensuite être utilisée pour effectuer un travail.
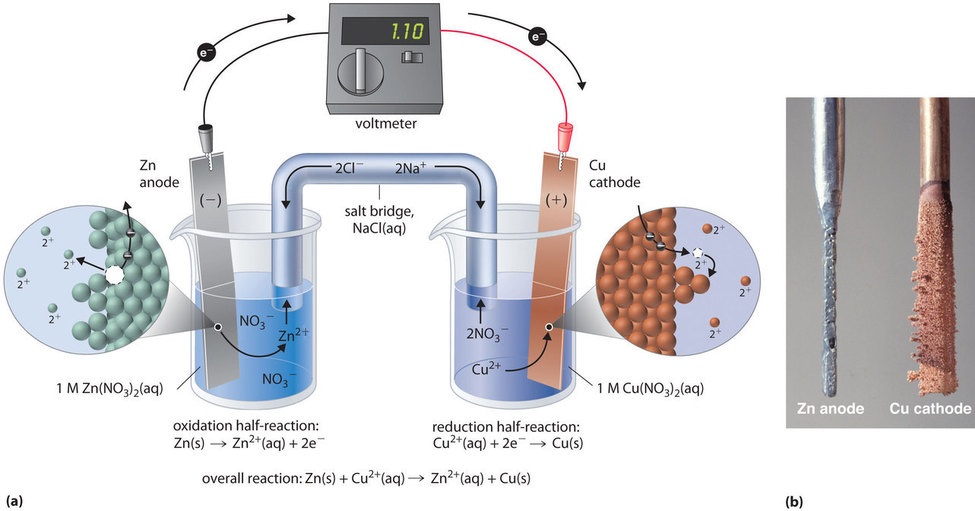
L’électrolyte dans le pont salin a deux fonctions : il complète le circuit en transportant la charge électrique et maintient la neutralité électrique dans les deux solutions en permettant aux ions de migrer entre elles. L’identité du sel dans un pont salin est sans importance, tant que les ions qui le composent ne réagissent pas ou ne subissent pas de réaction d’oxydoréduction dans les conditions de fonctionnement de la cellule. Sans cette connexion, la charge positive totale de la solution de Zn2+ augmenterait au fur et à mesure que le métal zinc se dissout, et la charge positive totale de la solution de Cu2+ diminuerait. Le pont salin permet aux charges d’être neutralisées par un flux d’anions dans la solution de Zn2+ et un flux de cations dans la solution de Cu2+. En l’absence de pont salin ou d’une autre connexion similaire, la réaction cesserait rapidement car la neutralité électrique ne pourrait pas être maintenue.
Un voltmètre peut être utilisé pour mesurer la différence de potentiel électrique entre les deux compartiments. L’ouverture de l’interrupteur qui relie les fils à l’anode et à la cathode empêche le passage d’un courant, aucune réaction chimique ne se produit donc. En revanche, lorsque l’interrupteur est fermé, le circuit externe est fermé et un courant électrique peut circuler de l’anode vers la cathode. Le potentiel (\(E_{cell}\)) de la cellule, mesuré en volts, est la différence de potentiel électrique entre les deux demi-réactions et est lié à l’énergie nécessaire pour déplacer une particule chargée dans un champ électrique. Dans la cellule que nous avons décrite, le voltmètre indique un potentiel de 1,10 V (Figure \(\PageIndex{3a}\)). Comme les électrons de la demi-réaction d’oxydation sont libérés à l’anode, l’anode d’une pile galvanique est chargée négativement. La cathode, qui attire les électrons, est chargée positivement.
Les électrodes ne subissent pas toutes une transformation chimique au cours d’une réaction d’oxydoréduction. L’électrode peut être réalisée à partir d’un métal inerte et très conducteur, tel que le platine, pour éviter qu’il ne réagisse au cours d’un processus d’oxydoréduction, où il n’apparaît pas dans la réaction électrochimique globale. Ce phénomène est illustré dans l’exemple \(\PageIndex{1}\).
Une cellule galvanique (voltaïque) convertit l’énergie libérée par une réaction chimique spontanée en énergie électrique. Une cellule électrolytique consomme de l’énergie électrique provenant d’une source externe pour entraîner une réaction chimique non spontanée.
Exemple \(\PageIndex{1}\)
Un chimiste a construit une cellule galvanique composée de deux béchers. Un bécher contient une bande d’étain immergée dans de l’acide sulfurique aqueux, et l’autre contient une électrode de platine immergée dans de l’acide nitrique aqueux. Les deux solutions sont reliées par un pont salin, et les électrodes sont reliées par un fil. Le courant commence à circuler et des bulles de gaz apparaissent à l’électrode de platine. La réaction d’oxydoréduction spontanée qui se produit est décrite par l’équation chimique équilibrée suivante :
\
Pour cette pile galvanique,
- écrivez la demi-réaction qui se produit à chaque électrode.
- indiquez quelle électrode est la cathode et laquelle est l’anode.
- indiquer quelle électrode est l’électrode positive et quelle est l’électrode négative.
Donné : cellule galvanique et réaction d’oxydoréduction
Demande : demi-réactions, identité de l’anode et de la cathode, et affectation de l’électrode comme positive ou négative
Stratégie :
- Identifier la demi-réaction d’oxydation et la demi-réaction de réduction. Identifiez ensuite l’anode et la cathode à partir de la demi-réaction qui se produit à chaque électrode.
- D’après la direction du flux d’électrons, affectez chaque électrode comme positive ou négative.
Solution
A Dans la demi-réaction de réduction, le nitrate est réduit en oxyde nitrique. (Le monoxyde d’azote réagirait ensuite avec l’oxygène de l’air pour former du NO2, avec sa couleur rouge-brun caractéristique). Dans la demi-réaction d’oxydation, l’étain métallique est oxydé. Les demi-réactions correspondant aux réactions réelles qui se produisent dans le système sont les suivantes :
réduction : \
oxidation : \
Donc le nitrate est réduit en NO, tandis que l’électrode d’étain est oxydée en Sn2+.
Parce que la réaction de réduction se produit à l’électrode de Pt, elle est la cathode. Inversement, la réaction d’oxydation se produit à l’électrode d’étain, elle est donc l’anode.
B Les électrons circulent de l’électrode d’étain à travers le fil jusqu’à l’électrode de platine, où ils se transfèrent au nitrate. Le circuit électrique est complété par le pont salin, qui permet la diffusion des cations vers la cathode et des anions vers l’anode. Comme les électrons partent de l’électrode d’étain, celle-ci doit être électriquement négative. En revanche, les électrons circulent vers l’électrode de Pt, donc cette électrode doit être électriquement positive.
Exercice \(\PageIndex{1}\)
Considérez une cellule galvanique simple constituée de deux béchers reliés par un pont de sel. Un bécher contient une solution de \(\ce{MnO_4^{-}}\) dans de l’acide sulfurique dilué et possède une électrode en Pt. L’autre bécher contient une solution de \(\ce{Sn^{2+}}\) dans de l’acide sulfurique dilué, avec également une électrode en Pt. Lorsque les deux électrodes sont reliées par un fil, le courant circule et il se produit une réaction spontanée décrite par l’équation chimique équilibrée suivante :
\
Pour cette pile galvanique,
- écrivez la demi-réaction qui se produit à chaque électrode.
- indiquez quelle électrode est la cathode et quelle électrode est l’anode.
- indiquez quelle électrode est positive et quelle électrode est négative.
Réponse a
\ \ce{Sn^{2+}(aq)} &→ \ce{Sn^{4+}(aq) + 2e^{-}} \end{align*}\]
Réponse b
L’électrode de Pt dans la solution de permanganate est la cathode ; celle dans la solution d’étain est l’anode.
Réponse c
La cathode (électrode dans le bécher qui contient la solution de permanganate) est positive, et l’anode (électrode dans le bécher qui contient la solution d’étain) est négative.