Le diabète sucré coûte cher, mais la plupart des coûts sont attribués aux complications et aux soins hospitaliers1. Selon l’American Diabetes Association (ADA), en 2012, le coût total estimé du diabète était de 245 milliards de dollars.1 On estime que 43 % de ce coût provenait des frais d’hospitalisation et 18 % des ordonnances pour gérer les complications du diabète.1
La plupart de ces complications peuvent être évitées par un contrôle ciblé de la glycémie. Les données épidémiologiques démontrent que pour chaque point de pourcentage de diminution de l’hémoglobine A1c (HbA1c), il y a une réduction de 35% du risque de complications microvasculaires.2 La bonne nouvelle est que les taux de complications du diabète ont été réduits,3 mais cela a été dépassé par l’augmentation pure et simple du nombre de personnes atteintes de diabète qui évoluent vers des complications.
De nombreuses personnes atteintes de diabète de type 2 peuvent avoir une complication liée au diabète au moment du diagnostic. Dans le diabète de type 1 et de type 2, certaines des complications, comme la rétinopathie et la néphropathie, sont silencieuses. Cela nécessite une approche ciblée agressive car il sera trop tard d’attendre les symptômes. Même la neuropathie diabétique sera asymptomatique chez jusqu’à 50 % des personnes présentant des anomalies mesurables4.
Cet article examinera les recommandations des normes de soins 2017 de l’ADA pour les complications microvasculaires et les déclarations de position pertinentes, et mettra en évidence le dépistage préventif et les perles cliniques pour le médecin de soins primaires qui traite les patients diabétiques.
- Rétinopathie diabétique
- Tableau 1. Stades de la rétinopathie avec description
- Paroles cliniques
- Diabète maladie rénale
- Tableau 2. Sélection d’études marquantes démontrant un contrôle glycémique avec une A1c inférieure à 7%
- Tableau 3. DFG estimé avec stade et description
- Tableau 4. Catégories d’albuminurie dans l’IRC
- Figure 1. Fréquence d’évaluation suggérée (nombre de fois par an) par catégorie de DFGe et d’albuminurie
- Tableau 5. Drapeaux rouges suggérant une maladie glomérulaire non diabétique
- Tableau 6. Ajustements de dose et recommandations pour les agents hypoglycémiants chez les patients atteints d’insuffisance rénale
- Classe
- Médicament
- Paroles cliniques
- Névropathie périphérique diabétique
- Tableau 7. Autres causes de neuropathie67
- Tableau 8. Agents pharmacologiques couramment utilisés pour le DPN4,69
- Paroles cliniques
- Gastroparésie
- Paroles cliniques
- Chéiroarthropathie diabétique
- Conclusion
Rétinopathie diabétique
La rétinopathie diabétique est une complication microvasculaire fréquente du diabète de type 1 et de type 2. On estime que 3,7 millions de personnes dans le monde souffrent d’une déficience visuelle modérée à sévère à cause de la rétinopathie diabétique, et que plus de 800 000 personnes dans le monde sont aveugles à cause de la rétinopathie diabétique.5 C’est la cause la plus fréquente de cécité nouvelle chez les adultes âgés de 20 à 74 ans.6 De fortes corrélations ont été établies avec le contrôle de la glycémie, le contrôle de la pression artérielle et la durée de la maladie. Grâce à un dépistage précoce et régulier et au contrôle de ces facteurs de risque, la rétinopathie diabétique peut être détectée et traitée pour prévenir la déficience visuelle.
La durée du diabète est le plus grand facteur de risque de progression de la rétinopathie diabétique. Dans le cas du diabète de type 1, la rétinopathie est rare au cours des 3 à 5 premières années ou avant la puberté.7 Au cours des 20 années suivantes, presque tous les patients atteints de diabète de type 1 développeront une rétinopathie diabétique.7 Chez les patients atteints de diabète de type 2, jusqu’à 21 % auront un certain degré de rétinopathie au moment du diagnostic.7 L’hyperglycémie chronique, la néphropathie, l’hypertension et la dyslipidémie sont d’autres facteurs qui augmentent le risque de rétinopathie diabétique ou qui y sont associés.8 Jusqu’à 50 % des patients présentant une albuminurie (quel que soit le niveau du débit de filtration glomérulaire estimé) auront une rétinopathie.9 Le tableau 1 décrit les différents stades de la rétinopathie.
Tableau 1. Stades de la rétinopathie avec description |
|
|
Stade |
Description |
|
Médiocre Non.Proliférative |
Microanévrismes présents |
|
Rétinopathie diabétique non proliférante modérée |
Microanévrismes, des hémorragies rétiniennes par points ou par taches, des exsudats durs, ou des taches de coton peuvent etre presentes |
|
Rétinopathie diabétique non proliférante grave |
Hémorragies intrarétiniennes, perles veineuses, ou des anomalies microvasculaires intrarétiniennes peuvent être présentes |
|
Rétinopathie diabétique proliférante |
Néovascularisation, hémorragies vitréennes ou prérétiniennes présentes |
Pathophysiologie. Des anomalies légères et non proliférantes caractérisées par une perméabilité vasculaire accrue peuvent évoluer vers une rétinopathie diabétique non proliférante (NPDR) modérée à sévère.La rétinopathie diabétique proliférante est caractérisée par la prolifération de nouveaux vaisseaux sanguins rétiniens7. L’œdème maculaire, qui est un épaississement central de la rétine avec exsudation et œdème, peut se présenter à n’importe quel stade de la rétinopathie.7 La rétinopathie diabétique peut être accélérée par la grossesse, la puberté, l’absence de contrôle glycémique, l’hypertension et la chirurgie de la cataracte.7
Prévenir la rétinopathie diabétique. Le contrôle de la glycémie est essentiel à la prévention de la rétinopathie diabétique. Dans le cadre de l’essai Diabetes Control and Complications Trial (DCCT), les chercheurs ont évalué l’effet d’un contrôle rigoureux de la glycémie et de la progression d’une rétinopathie nulle ou minime au départ vers une NPDR modérée.10 Pour les patients du groupe de traitement intensif ne présentant aucune rétinopathie au départ, le risque moyen de rétinopathie a été réduit de 76 % sur 36 mois10. Dans l’essai original Action to Control Cardiovascular Risk in Diabetes (ACCORD), les participants atteints de diabète de type 2 depuis 10 ans et présentant une maladie cardiovasculaire connue ont été répartis au hasard entre un traitement intensif et un traitement standard pour la glycémie, la pression artérielle systolique et la dyslipidémie. Quatre ans plus tard, la progression de la rétinopathie était réduite chez ceux qui avaient déjà bénéficié d’un contrôle intensif de la glycémie, indépendamment des niveaux actuels similaires d’HbA1c.11 Des effets d’héritage similaires n’ont pas été observés dans les groupes ayant bénéficié d’un contrôle intensif de la pression artérielle ou sous fénofibrate pour la dyslipidémie.11
Dépistage. L’œdème maculaire et la rétinopathie diabétique proliférante pouvant être asymptomatiques, le dépistage est essentiel pour une détection et un traitement précoces. Pour les patients atteints de diabète de type 1, le dépistage doit être initié cinq ans après le diagnostic.8 Pour ceux atteints de diabète de type 2, le dépistage doit être initié dès le diagnostic.8 Le dépistage doit être réalisé par un ophtalmologiste ou un optométriste expérimenté dans la rétinopathie diabétique. Le dépistage doit être effectué avec les yeux dilatés. Si la rétinopathie est déjà présente, il est recommandé de consulter un ophtalmologiste.8 Une nouvelle évaluation doit être effectuée chaque année si la maladie est minime ou inexistante.8
La grossesse est une période à haut risque pour la rétinopathie proliférative. Chez les femmes enceintes ayant un diabète de type 1 ou de type 2 préexistant, des examens oculaires doivent être effectués avant la conception ou au cours du premier trimestre. Les examens doivent être répétés chaque trimestre et pendant un an après l’accouchement.8 Pour les personnes atteintes de diabète gestationnel, aucun examen oculaire supplémentaire n’est nécessaire après l’accouchement.
La grossesse chez les patientes atteintes d’un diabète de type 1 ou de type 2 préexistant peut entraîner une progression rapide de la rétinopathie diabétique. Cela est particulièrement vrai en cas de mauvais contrôle glycémique au moment de la conception.14 Les femmes diabétiques qui sont enceintes ou qui prévoient de l’être doivent être informées du risque de développement ou de progression de la rétinopathie diabétique et de la nécessité d’un contrôle glycémique avant la conception8. Cependant, une aggravation précoce de la rétinopathie peut survenir avec la mise en œuvre rapide d’un contrôle glycémique intensif si la rétinopathie est déjà présente.Le diabète gestationnel ne semble pas conférer le même risque de développer une rétinopathie diabétique pendant la grossesse.8
Traitement. Outre le contrôle de la glycémie, il a également été démontré que le contrôle de la pression artérielle (< 140 mmHg systolique) diminue la progression de la rétinopathie diabétique, mais il n’y a pas de bénéfice supplémentaire d’un contrôle serré de la pression artérielle systolique < 120 mmHg.12 Le fénofibrate peut également ralentir la progression de la rétinopathie diabétique, notamment en cas de NPDR très légère, chez les patients souffrant de dyslipidémie.13 Il a été démontré que l’aspirine n’avait aucun effet sur la progression de la rétinopathie, le développement d’une hémorragie du vitré ou la durée de l’hémorragie du vitré, et elle peut être utilisée en toute sécurité pour d’autres indications médicales sans compromettre l’œil.7
Le traitement des patients diabétiques doit inclure des recommandations d’exercice. Ceux qui présentent une rétinopathie non proliférante légère peuvent commencer une activité physique en toute sécurité. Cependant, les patients souffrant d’une rétinopathie non proliférante modérée doivent éviter les activités qui augmentent fortement la pression artérielle, comme le powerlifting.15 Les patients souffrant d’une rétinopathie non proliférante ou instable sévère doivent éviter toute activité physique vigoureuse (sauts, secousses), toute activité tête en bas et la rétention de la respiration.15 En cas d’hémorragie du vitré, aucun exercice ne doit être effectué.15
La détection précoce de la rétinopathie diabétique est importante car le traitement peut prévenir ou inverser la perte de vision. Dans l’étude sur la rétinopathie diabétique (DRS), les chercheurs ont constaté que la chirurgie de photocoagulation était un traitement efficace de la rétinopathie diabétique. L’étude sur le traitement précoce de la rétinopathie diabétique et l’étude DRS ont montré que la photocoagulation diminuait le risque de perte de vision, les bénéfices étant les plus importants chez les patients dont la maladie de base était plus avancée.16,17 Les données actuelles prouvent que les agents intravitréens du facteur de croissance de l’endothélium vasculaire (anti-VEGF) sont plus efficaces dans le traitement de l’œdème maculaire que la monothérapie ou la thérapie combinée avec la coagulation au laser.8 De plus, l’anti-VEGF peut améliorer la vision, alors que la photocoagulation ne fait que prévenir une perte de vision supplémentaire.18,19 Un inconvénient de l’anti-VEGF est qu’il nécessite un traitement intravitréen mensuel pendant les 12 premiers mois.
Paroles cliniques
- Il n’y a pas de signes ou de symptômes spécifiques de rétinopathie diabétique précoce.
- Le dépistage de la rétinopathie diabétique devrait avoir lieu chez les patients :
– atteints de diabète de type 1 cinq ans après le diagnostic.
– chez les patients atteints de diabète de type 2 au moment du diagnostic.
- Des conseils et des examens accrus devraient être fournis aux femmes diabétiques qui prévoient de devenir ou deviennent enceintes, car la rétinopathie diabétique peut s’accélérer rapidement pendant la grossesse.
- Un contrôle rigoureux de la glycémie et de la pression artérielle (< 140 mmHg systolique) peut prévenir le développement de la rétinopathie diabétique.
- Jusqu’à 50 % des patients présentant une albuminurie (quel que soit le niveau de DFGe) auront une rétinopathie9.
- Le traitement par photocoagulation peut prévenir la progression de la maladie et le traitement anti-VEGF peut inverser la perte de vision due à l’œdème maculaire.
Diabète maladie rénale
Le diabète maladie rénale (DKD), terminologie privilégiée par l’ADA, est la principale cause de maladie rénale chronique (CKD) aux États-Unis20,21. La DKD a des effets significatifs à long terme sur la qualité de vie des patients diabétiques et est responsable de jusqu’à 40 % des cas d’insuffisance rénale terminale (IRT).20 Sur la base de la Kidney Disease Outcomes Quality Initiative (KDOQI) de la National Kidney Foundation et des normes de soins 2017 de l’ADA, cette section fournira des conseils sur les niveaux cibles d’HbA1c, la gestion des médicaments et le traitement thérapeutique des patients atteints de DKD.
La KDOQI stratifie le niveau cible d’HbA1c en fonction du risque d’hypoglycémie et des comorbidités du patient. Cette initiative est basée sur trois publications démontrant que le contrôle de la glycémie avec un taux d’HbA1c inférieur à 7 % prévient ou diminue la progression de la maladie rénale chez les patients atteints de diabète de type 2.22,23,24 Ces études sont résumées dans le tableau 2. L’ADA recommande, chez les patients présentant un risque plus élevé d’hypoglycémie, de relever l’objectif d’HbA1c au-dessus de 7 %.8 Le KDOQI recommande aux patients atteints de MRC de stade 4 et 5 dont l’espérance de vie est limitée de maintenir une HbA1c supérieure à 7 %.25
Tableau 2. Sélection d’études marquantes démontrant un contrôle glycémique avec une A1c inférieure à 7% |
|
|
Essai |
Résultats |
|
Action dans le diabète et les maladies vasculaires : Preterax and Diamicron Modified Release Controlled Evaluation (ADVANCE) Trial22 |
Réduction de 21% de la nouvelle macroalbuminurie et traitement de substitution rénale avec une A1c inférieure à 7% |
|
Veterans Affairs Diabetes Trial (VADT)23 |
Réduction de 37% de la macroalbuminurie et de 32% de réduction de la microalbuminurie avec une A1c inférieure à 7% |
|
L’étude ACCORD (Action to Control Cardiovascular Risk in Diabetes)24 |
Réduction de 2% de la macroalbuminurie et de 21% de la microalbuminurie avec une A1c inférieure à 7% |
Epidémiologie. Les hommes et les femmes sont également touchés par la NDP.20 Le pic d’incidence de la NDP se situe 15 ans après le diagnostic.21 Les Afro-Américains sont trois à cinq fois plus susceptibles de développer une néphropathie diabétique que les Caucasiens.20 Les Américains d’origine mexicaine et les Indiens Pima ont également un risque plus élevé de développer une NDP.20
La protéinurie est un facteur prédictif de morbidité cardiovasculaire et de mortalité toutes causes confondues dans le diabète.21 La présence d’une NDP est un facteur de risque accru de maladie cardiovasculaire. Les patients atteints de DKD sont systématiquement confrontés à des taux de mortalité par maladie cardiovasculaire plus élevés.26 En outre, la mortalité toutes causes confondues est plus élevée chez les patients atteints de DKD.21
Dans le diabète de type 1, les complications microvasculaires telles que la DKD commencent à se développer environ 10 à 20 ans après le diagnostic ; dans le diabète de type 2, le début exact est souvent inconnu et justifie donc un dépistage plus précoce.27
Pathophysiologie et pathogénie. On pense que l’hyperglycémie induit trois changements histologiques majeurs au niveau des glomérules qui conduisent à la DDC : 1) l’expansion mésangiale, 2) l’épaississement de la membrane basale glomérulaire et 3) la sclérose glomérulaire.28 Bien que la pathogénie exacte de l’apparition de la DDC soit inconnue, on pense que l’hyperglycémie provoque initialement une hyperfiltration et des lésions rénales à la suite de changements histologiques et de l’activation de cytokines20. En règle générale, l’albuminurie peut être le premier signe de la DDC29. L’hyperlipidémie, l’artériosclérose, l’hypertension et l’obésité sont des facteurs aggravants qui contribuent tous aux lésions rénales et au déclin fonctionnel qui s’ensuit. L’obésité centrale conduit à l’hypertension par l’hyperactivation du système rénine-angiotensine-aldostérone et du système nerveux sympathique.20 De plus, lorsque le système vasculaire rénal devient artérioscléreux, la progression de la néphropathie diabétique s’accélère. Une caractéristique distinctive importante de la néphropathie diabétique par rapport aux autres formes d’IRC est que les glomérules et les reins sont généralement normaux ou de taille accrue au départ.20
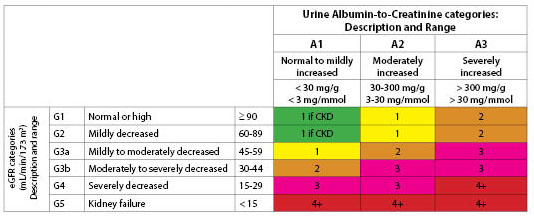
Classification. Le DFGe et la présence d’albuminurie sont tous deux utilisés pour classer l’IRC.30,31 Le DFGe est basé sur la race, l’âge, le sexe, le poids et les taux de créatinine sérique. (Voir tableau 3.) Historiquement, le terme microalbuminurie était utilisé pour définir des taux d’albumine modérément élevés. La National Kidney Foundation recommande maintenant d’utiliser les termes » léger « , » modéré » ou » sévèrement augmenté » pour décrire les niveaux d’albuminurie en fonction des niveaux représentés dans le tableau 4.31 Le rapport albumine-créatinine est le test initial utilisé pour détecter l’albuminurie.
Tableau 3. DFG estimé avec stade et description |
||
|
Stade |
Du DFG (mL/min par 1.73 m2) |
Description |
|
90+ |
Hyperfiltration glomérulaire |
|
|
Fonction rénale légèrement réduite |
||
|
3A |
Fonction rénale modérément réduite |
|
|
3B |
||
|
Fonction rénale sévèrement réduite |
||
|
< 15 ou sous dialyse |
Insuffisance rénale de stade terminal |
|
Tableau 4. Catégories d’albuminurie dans l’IRC |
||
|
Catégorie |
Taux d’albumine en fonction de la créatinine |
Description |
|
A1 |
< 30 |
Normal à légèrement augmenté |
|
A2 |
Modérément accru augmenté |
|
|
A3 |
> 300 |
Sévèrement augmenté |
Les deux schémas de classification représentent la double voie de développement de l’IRC. L’une passe par l’élévation de la créatinine et l’aggravation du DFG. L’autre passe par le développement de l’albuminurie. L’augmentation de l’albuminurie est souvent suivie d’une baisse du DFGe32 ; toutefois, cette situation peut être évitée grâce à l’utilisation d’inhibiteurs de l’enzyme de conversion de l’angiotensine (ECA) ou d’antagonistes des récepteurs de l’angiotensine (ARA) et au contrôle de la glycémie. (Voir figure 1.)
Figure 1. Fréquence d’évaluation suggérée (nombre de fois par an) par catégorie de DFGe et d’albuminurie
Réimprimé avec la permission de Kidney Disease : Improving Global Outcomes (KDIGO).
Symptômes courants . La plupart des personnes ne présentent aucun symptôme de néphropathie diabétique. Souvent, les patients peuvent avoir des preuves ou un diagnostic d’autres complications microvasculaires.20 La DKD précoce est généralement asymptomatique. Une découverte tardive de la NDP est l’urine mousseuse. En outre, si un patient est gravement hypoalbuminémique, il peut présenter un œdème pédieux et de la fatigue20 . Les patients atteints de néphropathie diabétique présentent aussi généralement une rétinopathie et une neuropathie.8
Options diagnostiques. Comme il n’y a pas de symptômes, le dépistage de routine est essentiel. L’ADA recommande un dépistage annuel du rapport albumine urinaire/créatinine.8 En outre, au moins une fois par an, le DFGe doit être testé chez les patients atteints de diabète de type 1 d’une durée de cinq ans et parmi tous les patients atteints de diabète de type 2 ou les patients souffrant d’hypertension et de diabète comorbides.8 Il n’existe pas de recommandation claire concernant l’obtention d’une imagerie, telle qu’une échographie, pour le diagnostic de la DKD.
Diagnostic différentiel. Certains signaux d’alarme peuvent suggérer que le diabète n’est pas la seule cause de l’IRC. Si une personne présente une IRC avancée sans preuve d’autres complications microvasculaires, c’est un avertissement. Une protéinurie manifeste accompagnée d’une apparition soudaine (moins de cinq ans après le début du diabète) d’un sédiment urinaire avec des globules rouges et des plâtres dysmorphiques, ou une baisse brutale du DFG, suggère une maladie rénale d’étiologie non diabétique.20 Une électrophorèse sérique ou urinaire peut être effectuée si l’on craint un myélome multiple. L’absence d’albuminurie avec un DFGe réduit et un diabète nécessite une investigation pour d’autres causes d’IRC que la DKD.21 Le tableau 5 énumère les drapeaux rouges qui suggèrent une maladie glomérulaire non diabétique.
Tableau 5. Drapeaux rouges suggérant une maladie glomérulaire non diabétique
- Début de protéinurie <5 ans après le début documenté du diabète de type 1 ou le début aigu de la maladie rénale
- Dégradation aiguë du DFGe ; Néphropathie diabétique
- Sédiment urinaire contenant des globules rouges dysmorphiques ou des plâtres cellulaires
- Absence d’autres complications microvasculaires telles que neuropathie ou rétinopathie
- Signes et/ou symptômes d’une autre maladie systémique
Traitement. L’une des caractéristiques de la néphropathie diabétique est la gestion du glucose, la réduction du sel, la pression artérielle et la dyslipidémie. En outre, les patients doivent éviter les médicaments et les suppléments néphrotoxiques tels que les aminoglycosides et les anti-inflammatoires non stéroïdiens. Les patients doivent être orientés vers un néphrologue au stade IV de la maladie rénale ou en cas de déclin rapide de la fonction rénale. D’autres indications de référence dépendent de la complexité du cas. Les nouveaux médicaments oraux pour le diabète peuvent aider à prévenir la progression de l’insuffisance rénale.
Contrôle glycémique. Le choix des médicaments, la surveillance et la pharmacologie sont tous affectés chez les patients atteints de néphropathie diabétique. Au fur et à mesure que le DFGe du patient diminue, certains agents oraux nécessiteront un ajustement de la dose. L’insuline reste le traitement central pour le contrôle de la glycémie chez les patients atteints de diabète et d’IRC avancée.31 Le tableau 6 présente les ajustements de dose recommandés pour les médicaments antiglycémiques chez les patients atteints de maladie rénale. En 2016, il a été démontré que l’empagliflozine et la canagliflozine réduisaient toutes deux la progression de l’IRC et la microalbuminurie33,34. L’empagliflozine a diminué les taux de progression de la néphropathie et réduit le risque d’événements cardiovasculaires indésirables majeurs par rapport au placebo lorsqu’elle a été ajoutée aux soins standard du diabète de type 2 dans l’étude de résultats marquante Empagliflozin Cardiovascular Outcome Event Trial in Type 2 Diabetes Mellitus Patients (EMPA-REG).33
Tableau 6. Ajustements de dose et recommandations pour les agents hypoglycémiants chez les patients atteints d’insuffisance rénale |
||
|
Agents hypoglycémiants |
||
|
.de glucose |
Ajustements posologiques en cas d’insuffisance rénale |
|
Classe |
Médicament |
|
|
Biguanides |
Metformine |
Facteur de croissance global (FGF) de 30 à 45 ml/min/1.73 m2 : Il n’est pas recommandé d’initier le traitement. Si après l’initiation, évaluer les bénéfices/risques de la poursuite du traitement. eGFR < 30 mL/min/1,73 m2 : L’utilisation est contre-indiquée |
|
Sulfonylurées |
Glimepiride |
Infirmité légère à modérée : Initier à 1 mg une fois par jour Déficience grave : L’utilisation est contre-indiquée |
|
Glipizide |
La libération prolongée : Initier à 2,5 mg une fois par jour |
|
|
Glyburide |
eGFR < 60 ml/min/1,73 m2 : L’utilisation n’est pas recommandée |
|
|
Méglitinides |
Nateglinide |
Aucun ajustement posologique n’est nécessaire . ajustement posologique nécessaire |
|
Repaglinide |
CrCl 20 à 40 mL/min : Initier à 0.5 mg pendant les repas CrCl < 20 mL/min : Aucune information |
|
|
Thiazolidinediones |
Pioglitazone |
Aucun ajustement posologique nécessaire |
|
Rosiglitazone |
Aucun ajustement de la posologie n’est nécessaire |
|
|
α-Inhibiteurs de glucosidase |
Acarbose |
SCr > 2.0 mg/dL : L’utilisation n’est pas recommandée |
|
Miglitol |
CrCl < 25 mL/min ou SCr >2.0 mg/dL : l’utilisation n’est pas recommandée |
|
|
Inhibiteurs du DDPP-4 |
Alogliptine |
CrCl 30 à 60 mL/min : 12.5 mg une fois par jour CrCl < 30 ml/min : 6,25 mg une fois par jour IRD nécessitant une hémodialyse : 6.25 mg une fois par jour et administrer sans tenir compte du moment de l’hémodialyse |
|
Linagliptine |
Aucune adaptation posologique n’est nécessaire |
|
|
Saxagliptine |
CrCl ≤ 50 mL/min : 2.5 mg une fois par jour IRD nécessitant une hémodialyse : 2.5 mg une fois par jour et administrer après une hémodialyse |
|
|
Sitagliptine |
CrCl 30 à 50 mL/min : 50 mg une fois par jour CrCl < 30 mL/min : 25 mg une fois par jour IRD nécessitant une hémodialyse ou une dialyse péritonéale : 25 mg une fois par jour et administrer sans tenir compte du moment de l’hémodialyse |
|
|
Vildagliptine |
CrCl < 50 mL/min : 50 mg une fois par jour |
|
|
Séquestrants des acides biliaires |
Colesevelam |
Aucun ajustement posologique n’est nécessaire |
|
Dopamine-2 agonistes |
Bromocriptine |
Aucune information |
|
Inhibiteurs du SGLT-2 |
Canagliflozine |
FGFe 45 à 60 ml/min/1.73 m2 : Ne pas dépasser 100 mg une fois par jour eGFR < 45 ml/min/1,73 m2 : Il n’est pas recommandé d’initier le traitement. Si après l’initiation, interrompre le traitement pour les patients dont le DFGe persiste à < 45 ml/min/1,73 m2. FGe < 30 ml/min/1,73 m2/ERD/Hémodialyse : L’utilisation est contre-indiquée |
|
Dapagliflozine |
eGFR < 60 mL/min/1,73 m2 : Il n’est pas recommandé d’initier le traitement. Si après l’initiation, interrompre le traitement pour les patients dont le DFGe se situe de façon persistante entre 30 et < 60 ml/min/1,73 m2. FGe < 30 ml/min/1,73 m2/ERD/Hémodialyse : L’utilisation est contre-indiquée |
|
|
Empagliflozine |
eGFR < 45 mL/min/1,73 m2 : Il n’est pas recommandé d’initier le traitement. Si après l’initiation, interrompre le traitement pour les patients dont le DFGe persiste à être < 45 ml/min/1,73 m2. FGe < 30 ml/min/1,73 m2. IRD/ hémodialyse : L’utilisation est contre-indiquée |
|
|
GLP-1 |
Albiglutide |
Aucune adaptation posologique n’est nécessaire |
|
Dulaglutide |
Aucune adaptation posologique n’est nécessaire |
|
|
Exénatide |
CrCl 30 à 50 mL/min : Aucune information. A utiliser avec précaution. CrCl < 30 mL/min/ IRT : L’utilisation n’est pas recommandée |
|
|
Liraglutide |
Pas d’information |
|
|
Lixisenatide |
FGeGF 15 à 29 mL/min/1.73 m2 : Aucune information. Surveiller l’augmentation des effets indésirables GI pouvant entraîner une déshydratation et une aggravation de la fonction rénale. eGFR <15 mL/min/1.73 m2/ IRT : l’utilisation n’est pas recommandée |
|
|
Amyline mimétique |
Pramlintide |
CrCl ≥15 mL/min : aucune adaptation posologique n’est nécessaire IRT : Aucune information |
|
Insulines |
Angéliques à action rapide-.à action rapide
Action rapide
Action immédiate
.action intermédiaire
Analogues de l’insuline basale
|
Les besoins en insuline peuvent être réduits en raison de modifications de la clairance ou du métabolisme de l’insuline. Surveiller étroitement la glycémie. |
Tension artérielle. Le traitement de la pression artérielle doit commencer à 140/90 mmHg pour les patients atteints de diabète et d’insuffisance rénale diabétique.37 L’étude United Kingdom Prospective Diabetes Study (UKPDS) a constaté une réduction de 12 % du risque de complications diabétiques pour chaque baisse de 10 mmHg de la pression systolique jusqu’à ce que la pression soit de 120 mmHg.38 Les médicaments de choix restent les inhibiteurs de l’ECA ou les ARA pour les personnes souffrant d’hypertension et de diabète, d’insuffisance rénale diabétique et d’insuffisance rénale chronique. Il a été démontré que l’inhibition de l’ECA retardait le développement de l’IRC lorsqu’elle était initiée chez des patients présentant une albuminurie légèrement élevée. La créatinine peut augmenter jusqu’à 30 % à l’initiation d’un inhibiteur de l’ECA ou d’un ARA.39 Envisagez d’évaluer d’autres maladies rénales sous-jacentes si la créatinine s’élève plus que cela.
Le KDOQI recommande de ne pas donner d’ECA/ ARA aux patients diabétiques de type 2 qui sont normotendus et normoalbuminuriques.40,41,42 Les inhibiteurs de l’ECA ou les ARA sont suggérés pour les patients diabétiques qui sont normotendus avec une microalbuminurie.31,37 Il n’y a pas de dose ou de titrage spécifique pour ces personnes. Le double blocage du système rénine-angiotensine par l’ECA et les ARA n’est pas recommandé en raison du risque accru d’hyperkaliémie, d’altération de la fonction rénale et d’hypotension.43
Réduction du sel. Les essais 2012 Reduction of Endpoints in Non-insulin-dependent diabetes mellitus with the Angiotensin II Antagonist Losartan (RENAAL) Trial et Irbesartan Diabetic Nephropathy Trial (IDNT) ont démontré que les régimes à faible teneur en sodium augmentaient les effets néphroprotecteurs et cardioprotecteurs des ARA chez les patients atteints de diabète de type 2 et de néphropathie diabétique.44,45
Dialyse rénale et transplantation rénale. Les patients atteints d’IRT doivent être orientés vers la néphrologie. Les options de traitement comprennent la dialyse péritonéale ou l’hémodialyse, le transport rénal, ou l’option d’arrêter le traitement et de commencer des soins palliatifs ou d’hospice. Une étude d’observation a révélé que les patients qui commençaient la dialyse à un plus jeune âge (< 60 ans) avaient une moins bonne survie.46
Référencement. La figure 1 comprend les indications de référence en fonction de la classification du DFG et de l’albuminurie. Envisager d’autres causes de maladie rénale non liées au diabète, en particulier chez les patients atteints de diabète de type 1 où l’apparition de la rétinopathie ne précède pas le développement de la néphropathie.21 Les néphrologues peuvent aider à clarifier le diagnostic, à contrôler l’hypertension résistante et l’hyperkaliémie, et à préparer les patients à la dialyse.8
Il faut également considérer que le développement de la néphropathie peut ne pas être lié au diabète lui-même. Chez les patients atteints de diabète de type 1, l’apparition de la rétinopathie précède généralement le développement de la néphropathie.47 Une personne qui présente une néphropathie mais pas de rétinopathie doit subir une évaluation pour rechercher d’autres causes. L’orientation vers un néphrologue devrait être faite pour établir la cause de la néphropathie lorsqu’elle est incertaine ou lorsqu’il y a des problèmes difficiles à gérer, liés à l’IRC, y compris l’anémie, l’hyperparathyroïdie et l’évolution de la maladie rénale avec un DFGe < 30 mL/min/1,73 m2.8 Le fait d’avoir un néphrologue consultant lorsque l’IRC de stade 4 se développe (DFGe < 30 mL/min/1,73 m2) est associé à une diminution de la morbidité, à une réduction des coûts de soins de santé et à un report de la dialyse48. Envisager une référence au stade 3B pour préparer les patients plus tôt et pour que la néphrologie puisse traiter médicalement au maximum.
Paroles cliniques
- Le dépistage annuel de la DKD doit se faire par un test d’albumine urinaire et une mesure du DFGe.
- Le contrôle de la pression artérielle et du glucose peut permettre de prévenir la progression de la néphropathie. Maintenir une pression artérielle < 140/90 mmHg chez les patients atteints de diabète et d’IRC. Les inhibiteurs de l’ECA ou les ARA doivent être le traitement de choix.
- Les inhibiteurs de l’ECA et les ARA ne doivent pas être utilisés pour prévenir la néphropathie si la pression artérielle et l’excrétion des protéines sont normales. Les inhibiteurs de l’ECA et les ARA ne doivent pas être utilisés en association.
- Les patients atteints d’IRC aux stades 3 à 5 présentent un risque accru d’hypoglycémie. La prudence est de mise avec les agents oraux tels que les sulfonylurées.
- Chez certains patients atteints d’IRC, il est approprié de fixer l’objectif d’HbA1c >7 %, notamment lorsque le risque d’hypoglycémie est important.
Névropathie périphérique diabétique
Une définition largement acceptée de la neuropathie périphérique diabétique (NDP) dans la pratique clinique est « la présence de symptômes et/ou de signes de dysfonctionnement des nerfs périphériques chez les personnes atteintes de diabète après exclusion d’autres causes. »49 La classification ADA de la polyneuropathie symétrique distale est la suivante : 1) neuropathie principalement à petites fibres, 2) neuropathie principalement à grandes fibres et 3) neuropathie mixte à petites et grandes fibres (la plus courante).
Pathophysiologie et pathogenèse. Le développement et la progression de la NDP découlent des relations complexes entre les nerfs et les cellules qui les entourent.50 Les facteurs vasculaires et les interactions métaboliques contribuent à tous les stades de la NDP.51 La compréhension généralement acceptée du diabète humain menant au développement de la NDP est l’interaction complexe entre l’hyperglycémie, la durée du diabète, les dommages neuronaux liés à l’âge, les degrés de contrôle de la pression artérielle et des lipides sanguins, et le poids.52,53,54,55 L’hyperglycémie active de nombreuses voies biochimiques qui déterminent l’état métabolique d’une cellule nerveuse et se combine à une perfusion nerveuse altérée, contribuant à la progression des neuropathies. Un essai de référence, le DCCT, soutient l’importance de l’hyperglycémie dans la pathogenèse de la neuropathie.10,56,57 Un autre mécanisme lié à l’hyperglycémie conduisant à la NDP est le stress oxydatif et nitrosatif induit par l’hyperglycémie avec une augmentation de la production de radicaux libres58,59.
Symptômes courants. Lorsque l’on s’enquiert des symptômes de la NDP vécus, il faut noter la localisation (le plus souvent ressentie dans les mains et les pieds), les facteurs précipitants, les caractéristiques des gênes, ainsi que l’apparition et la fréquence de l’exacerbation nocturne, car les symptômes sont propres à chaque patient.4 Les petites et les grandes fibres sont toutes deux affectées par l’élévation de la glycémie, et les symptômes vécus varient selon la classe de fibres sensorielles touchées. Lorsque les fibres nerveuses affectées sont principalement de petite taille, les symptômes déclenchés sont généralement la douleur (collante, lancinante, piquante, brûlante, douloureuse, ennuyeuse et excessivement sensible), les dysesthésies (sensations désagréables de brûlure, de picotement, de piqûre et de coup de poignard) et l’engourdissement4.
L’intensité de la gêne peut aller de la sensation de sensations anormales mineures à l’invalidité par la douleur qui peut être exacerbée la nuit et perturber le sommeil, ce qui s’est avéré être associé à la dépression en raison de la perception d’une baisse de la qualité de vie4.
D’autre part, lorsque les grandes fibres sont principalement touchées, les patients peuvent ressentir des engourdissements et des picotements dans les extrémités, avoir une démarche instable et perdre l’équilibre (ce qui entraîne des chutes potentielles).4 Certains patients peuvent voir leurs symptômes s’aggraver à mesure que leur glycémie diminue en raison de l’intensification de la prise en charge thérapeutique du diabète. Les patients peuvent être asymptomatiques mais présenter divers degrés de perte sensorielle ; une conséquence indésirable d’une perte sensorielle sévère due à une neuropathie diabétique peut être une blessure indolore, entraînant un risque accru d’ulcération du pied ou, dans les cas graves, d’amputation.62
La forme la plus courante de neuropathie périphérique diabétique est la polyneuropathie symétrique distale avec une perte progressive des fibres nerveuses sensorielles.4 Le modèle typique de « bas » bilatéral est créé par les dommages qui se produisent sur les parties les plus distales des nerfs les plus longs (étant affectés en premier).63,64,65 Avec le temps, un modèle de « bas-gant », favorisant la perte sensorielle et les symptômes typiques de la NDP, résulte de la procédure proximale des déficits nerveux.4
Diagnostic clinique. Un diagnostic clinique de la NDP peut être posé sur la base des signes et symptômes neuropathiques d’un patient diabétique après avoir exclu d’autres causes de neuropathie.66 La neuropathie périphérique diabétique asymptomatique peut se produire chez jusqu’à 50 % des personnes qui présentent cette complication ; par conséquent, la mise en œuvre de soins préventifs des pieds est essentielle, en particulier pour les personnes qui présentent un risque élevé de blessures dues à des pieds insensibles.4 Le dépistage annuel de la NDP doit être effectué chez tous les patients diabétiques par la piqûre d’épingle, la température, la perception des vibrations (à l’aide d’un diapason de 128 Hz), la sensation de pression du monofilament de 10 g et les réflexes tendineux profonds de la cheville ; les ulcères potentiels du pied peuvent être prédits par une perte de la sensation du monofilament de 10 g (perte de la sensation protectrice) et une diminution de la vibration perçue.63 Les Standards of Medical Care in Diabetes-2017 de l’ADA continuent de recommander un test annuel au monofilament 10-g dans le but d’identifier les patients à risque de développer une ulcération et une amputation.8 En outre, les lignes directrices 2017 de l’ADA recommandent le dépistage de la NDP au moment du diagnostic du diabète de type 2 et cinq ans après le diagnostic du diabète de type 1.8
En 2009, le Toronto Consensus Panel on Diabetic Neuropathies a mis à jour les critères de diagnostic pour fournir des catégories de diagnostic. En outre, plusieurs instruments de dépistage bien validés peuvent être inclus par les prestataires de soins dans le processus de diagnostic, notamment le Michigan Neuropathy Screening Instrument (MNSI), le Toronto Clinical Neuropathy Score et l’Utah Neuropathy Scale. Le tableau 7 décrit les autres causes de neuropathie qui doivent être exclues.
Tableau 7. Autres causes de neuropathie67
- Alcool ou autres toxines
- Médicaments neurotoxiques, notamment la chimiothérapie
- Déficience en vitamine B12
- Hypothyroïdie
- Maladie rénale
- Malignités (myélome multiple, carcinome bronchogénique)
- Virus de l’immunodéficience humaine (VIH)
- Névropathie inflammatoire démyélinisante chronique, neuropathies héréditaires et vascularite
Études diagnostiques. Plusieurs tests diagnostiques existent pour confirmer la présence d’une NDP. Les études de conduction nerveuse sont considérées depuis des années comme le test diagnostique de référence pour la NDP en raison de leurs mesures objectives sans réponse des patients, ce qui entraîne une grande fiabilité.4 Les tests sensoriels quantitatifs évaluent les capacités des patients à détecter le toucher léger, les vibrations et la discrimination de la température, ce qui implique un certain niveau de subjectivité.4 D’autres méthodes, y compris la biopsie cutanée et la densité des fibres nerveuses intraépidermiques et la microscopie confocale cornéenne, n’ont pas été utilisées de manière routinière dans la pratique clinique mais peuvent être utilisées dans des essais cliniques.4
Options de traitement : Traitement pharmacologique. Le traitement pharmacologique de la NDP vise à améliorer les symptômes, les médicaments utilisés ne sont donc pas destinés à prévenir la progression. Le tableau 8 résume les médicaments des trois classes les plus couramment utilisées (anticonvulsivants, antidépresseurs et opioïdes) pour contrôler les symptômes neuropathiques. Bien que plusieurs agents soient couramment utilisés comme approche initiale pour la gestion de la NDP, seules la prégabaline et la duloxétine ont été approuvées par la FDA pour la gestion de cette condition ; ainsi, l’un ou l’autre de ces agents est recommandé comme choix initial pour la douleur neuropathique symptomatique.4 La gabapentine, bien qu’elle n’ait pas été approuvée par la FDA pour être utilisée dans la gestion de la NDP, est souvent utilisée comme approche initiale, et son efficacité est comparable à celle des agents approuvés par la FDA. Les antidépresseurs tricycliques (par exemple, l’amitriptyline) – agents non approuvés par la FDA pour la gestion de la NDP – sont efficaces pour gérer la NDP, mais ils doivent être utilisés avec prudence en raison d’un risque plus élevé d’effets secondaires.
Tableau 8. Agents pharmacologiques couramment utilisés pour le DPN4,69 |
|||||
|
Agent pharmaceutique (intervalle NNT 30-50% d’amélioration*) |
Dose quotidienne maximale de DNP (mg/jour) |
Effets secondaires courants |
Ajustements de dose nécessaires ? |
Contre-indications |
Considérations relatives à la prescription |
|
Anticonvulsivants
|
|||||
|
Pregabalin (3.3-8.3) |
Détourdissements Somnolence Gain de poids Œdème périphérique Vision trouble Constipation |
Rénal : Oui Hépatique : Non |
Hypersensibilité à la prégabaline |
Preuves solides ; approuvé par la FDA ; substance contrôlée |
|
|
Gabapentine (3.3-7.2) |
3,600 |
Etourdissements Ataxie Somnolence Maux de tête Nausea Diarrhée Gain de poids |
Rénal : Oui Hépatique : Non |
Hypersensibilité à la gabapentine |
Preuves modérées ; non approuvé par la FDA |
|
Antidépresseurs
|
|||||
|
Amitriptyline (2.1-4.2) |
Sédation sévère; confusion; effets anticholinergiques (constipation, vision floue) |
Rénal : Non Hépatique : Non Des doses plus faibles sont recommandées pour les patients âgés |
Hypersensibilité à l’amitriptyline ; co-administration avec ou dans les 14 jours de MAOs ; co-administration avec le cisapride ; phase de récupération aiguë après un infarctus du myocarde |
Preuves modérées ; non approuvé par la FDA ; à utiliser avec prudence pour les personnes ayant des antécédents de maladies cardiovasculaires |
|
|
Duloxétine (3.8-11) |
(U.S.) |
Nausea; sédation; somnolence généralisée |
Rénal : Oui Hépatique : Éviter l’utilisation en cas d’insuffisance hépatique |
Hypersensibilité ; co-administration avec ou dans les 14 jours de MAOs ; initiation chez ceux qui reçoivent du linézolide ou du bleu de méthylène IV |
Preuves modérées ; Approuvé par la FDA; peut être ajouté à la prégabaline ou à la gabapentine |
|
Venlafaxine (5.2-8.4) |
Nausea; sédation; somnolence généralisée |
Rénal : Oui Hépatique : Oui |
Preuves faibles; non approuvé par la FDA ; peut être ajouté à la gabapentine |
||
|
Opioïdes
|
|||||
|
Tramadol (2.1-6.4) |
Somnolence Nausea Vomissement Constipation Tête légère Etourdissement Maux de tête |
Rénal : Oui Hépatique : Non |
Hypersensibilité au tramadol, aux opioïdes ou à l’un des composants de la formulation ; Formulation ER : dépression respiratoire significative et asthme aigu ou sévère ; Formulation IR : intoxication aiguë par l’alcool, les hypnotiques, les narcotiques, les analgésiques à action centrale, les opioïdes ou les psychotropes |
Potentiel d’abus moindre (substance contrôlée de l’annexe IV) ; non recommandé comme agent de première ou de deuxième intention |
|
|
Tapentadol (N/A) |
Libération immédiate : Libération prolongée : |
Somnolence Nausea Vomissement Constipation Détourdissement |
Rénal : Utilisation non recommandée lorsque Hépatique : Non |
Hypersensibilité au tapentadol; dépression respiratoire significative; asthme aigu ou sévère; iléus paralytique; dans les 14 jours suivant la prise d’inhibiteurs de la MAO |
Approuvé par la FDA ; substance contrôlée de l’annexe II ; non recommandé comme agent de première ou de deuxième intention |
|
Les informations concernent les agents pharmaceutiques obtenus à partir des notices respectives (référencées par les noms commerciaux) |
|||||
La directive de l’American Academy of Neurology (AAN) recommande les agents topiques suivants : capsaïcine et dinitrate d’isosorbide en spray (preuves modérées) et patch Lidoderm (preuves faibles).69 L’oxcarbazépine, la lamotrigine, le lacosamide, la clonidine, la pentoxifylline et la mexilétine ne sont pas recommandés dans la ligne directrice de l’AAN pour le traitement de la NDP.69
De plus, certains ont recommandé l’utilisation d’opioïdes dans la NDP réfractaire. Les opioïdes recommandés par la ligne directrice de l’AAN comprennent le dextrométhorphane (400 mg/jour), le sulfate de morphine (titré à 120 mg/jour) et l’oxycodone (moyenne de 37 mg/jour, maximum de 120 mg/jour) ; cependant, il n’existe pas de données suffisantes pour suggérer l’utilisation d’un agent plutôt qu’un autre.69 Les auteurs de cet article recommandent de n’utiliser les opioïdes que dans les cas réfractaires sévères avec une surveillance étroite des patients qui obtiennent une véritable amélioration fonctionnelle grâce aux opioïdes. Les auteurs suivent la déclaration de position de 2016 des Centers for Disease Control and Prevention selon laquelle les opioïdes ont une utilisation limitée à long terme dans la douleur de type non cancéreux.70
L’un des défis du traitement pharmacologique de la NDP est l’insuffisance d’études en tête-à-tête intégrant les résultats de la qualité de vie.4 Une étude récente comparant une thérapie de huit semaines entre la prégabaline à forte dose, la duloxétine à forte dose, ou en combinaison n’a trouvé aucune différence significative dans le changement moyen de la douleur entre la monothérapie et la thérapie combinée.71 Plus d’études comparant deux agents actifs sont nécessaires pour fournir un aperçu de l’amélioration des soins pour ceux qui souffrent de neuropathie périphérique diabétique.
Traitement non pharmacologique. Procédures. La ligne directrice de l’ANN suggère d’envisager la stimulation électrique percutanée des nerfs pendant trois à quatre semaines pour le traitement de la NDP.69 Un essai pilote, randomisé, contrôlé, à deux styles d’acupuncture72 et un essai randomisé, en simple aveugle, contrôlé par placebo73 évaluant l’efficacité de l’acupuncture dans la NDP ont tous deux montré des améliorations dans les mesures de résultats associées à la douleur. Cependant, d’autres études sont nécessaires pour confirmer le rôle de l’acupuncture dans la gestion de la NDP.
Acide alpha-lipoïque. Certaines preuves suggèrent que l’utilisation de l’acide alpha-lipoïque antioxydant pourrait aider à réduire le stress oxydatif médié par les radicaux libres et apporter les avantages suivants : cibler la pathogenèse, ralentir le développement et améliorer les symptômes de la NDP.74,75
Prévention. Il a été démontré que les modifications du mode de vie, axées sur une alimentation saine et l’activité physique, diminuent continuellement la prévalence du diabète et de ses complications, y compris la neuropathie diabétique périphérique.68 Il a été démontré qu’un contrôle glycémique intensif contribue à réduire le risque de neuropathie diabétique chez les patients diabétiques en améliorant la fonction nerveuse.61,76,77 Le DCCT a établi le rôle du contrôle glycémique dans la prévention et l’arrêt de la progression de la neuropathie diabétique dans le diabète de type 1.10,56
Paroles cliniques
- Jusqu’à 50% des patients pourraient avoir une neuropathie périphérique indolore ou asymptomatique.
- Il est recommandé aux patients atteints de neuropathie de recevoir une éducation sur les soins des pieds (auto-inspection quotidienne des pieds) et des soins podologiques réguliers pour certains patients.
- Les patients atteints de NDP qui présentent des signes de perte de sensation protectrice avec ou sans déformation doivent être invités à suivre un médecin tous les trois à six mois pour des mesures préventives64.
- Pour gérer efficacement les symptômes de la NDP, une approche multidisciplinaire devient essentielle ; cette approche globale pourrait inclure une thérapie pharmacologique, psychologique et/ou physique.
- Une nouvelle déclaration de position sur la neuropathie diabétique publiée par l’ADA recommande le dépistage de la NDP chez les patients prédiabétiques présentant des symptômes de neuropathie périphérique4.
- Des soins spécialisés sont nécessaires pour les personnes présentant une maladie périphérique, une neuropathie non sensorielle ou un pied de Charcot.
Gastroparésie
Une autre forme de neuropathie diabétique est la gastroparésie. Cette affection est associée à des symptômes gastro-intestinaux supérieurs, notamment des nausées, des vomissements, une satiété précoce ou une plénitude postprandiale, des douleurs abdominales et des ballonnements, mais en l’absence d’obstruction de l’orifice de sortie. Bien qu’il existe un certain nombre de causes de gastroparésie, on estime que le diabète est responsable d’environ un tiers de tous les cas.78
Pathophysiologie. Les mécanismes physiopathologiques proposés pour la gastroparésie diabétique comprennent un mauvais contrôle glycémique, une neuropathie des ganglions sympathiques vagaux ou prévertébraux, des anomalies des cellules interstitielles de Cajal, une perte d’oxyde nitrique synthase et, éventuellement, une myopathie.79,80
Présentation clinique. Au début de cette affection, les patients sont généralement asymptomatiques. Il n’y a pas de relation linéaire entre les symptômes et la sévérité de la neuropathie. La grande variété des symptômes rend difficile le diagnostic de l’affection. Les autres présentations cliniques comprennent l’anorexie, la malnutrition, la perte de poids et l’hypoglycémie due au décalage entre l’absorption des aliments et l’insuline. La douleur peut en fait être sous-estimée mais significative pour de nombreuses personnes. Dans un consortium financé par le NIH, 72% des patients atteints de gastroparésie présentaient des douleurs abdominales.81 C’était le symptôme dominant chez 18% de ces patients. La douleur était induite par l’alimentation (72 %), était nocturne (74 %) et interférait avec le sommeil (66 %) pour ces patients.81
Combien la gastroparésie diabétique est-elle fréquente ? L’incidence cumulée sur 10 ans de la gastroparésie a été estimée à 5,2 % dans le diabète de type 1 et à 1 % dans le diabète de type 2 parmi les patients diabétiques de la communauté82. D’autres études ont trouvé des taux compris entre 5 et 12 %.83,84 Cependant, les taux sont beaucoup plus élevés lorsque le diagnostic est basé sur les symptômes plutôt que sur l’étude de vidange gastrique.
La gastroparésie est plus fréquente dans le diabète de type 1 que dans le diabète de type 2, et elle est le plus souvent observée après que la personne ait été diabétique pendant plus de 10 ans et ait développé les autres complications microvasculaires que sont la rétinopathie, la néphropathie et la neuropathie périphérique. Si un patient présente une gastroparésie plus tôt que prévu, d’autres étiologies doivent être explorées, le plus souvent une lésion périopératoire du nerf vagal ou les effets pharmacologiques des agents à base d’incrétine – agonistes des récepteurs du peptide-1 de type glucagon (GLP-1RA) et inhibiteurs de la dipeptidyl-peptidase 4 (DPP-4).
Une fois qu’un patient développe des symptômes de gastroparésie, ceux-ci persistent généralement et sont stables pendant 12 à 25 ans. Cela est vrai même en cas d’amélioration du contrôle de la glycémie85, sauf dans le cas d’une greffe de pancréas et de rein.86 Bien qu’il n’y ait pas de preuves claires que la gastroparésie augmente la mortalité en elle-même, elle réduit considérablement tous les aspects de la qualité de vie.87
Diagnostics. Un certain nombre de tests peuvent aider au diagnostic. L’étalon-or pour ce diagnostic est la scintigraphie gastro-œsophagienne. Elle est non invasive, teste la physiologie et fournit des résultats quantitatifs. La gastroparésie peut être diagnostiquée s’il y a au moins 35 % de rétention d’un repas standard faible en gras quatre heures après l’ingestion.80
Pour obtenir les résultats les plus précis, le protocole pré-test doit inclure l’arrêt de tous les médicaments altérant la motilité pendant au moins deux à trois jours avant le test, y compris les prokinétiques, les opiacés et les anticholinergiques. Les agents incrétines, tels que les agonistes du GLP-1 et les inhibiteurs de la DPP-4, doivent également être arrêtés, car ils sont connus pour retarder la vidange gastrique. Il a également été démontré que l’hyperglycémie retarde la vidange gastrique, et le taux de glucose doit être inférieur à 275 mg/dL avant de commencer l’étude.79,88
Les patients doivent s’abstenir de fumer et de consommer de l’alcool le jour du test, car ces deux facteurs peuvent ralentir la vidange gastro-œsophagienne.89 En outre, les GLP-1RA peuvent exacerber la gastroparésie car ils ralentissent la vidange gastrique. De plus, certaines personnes peuvent avoir une gastroparésie subclinique qui est découverte lors de l’instauration d’un GLP-1RA.
Traitement. Le traitement de la gastroparésie dépend largement de la sévérité des symptômes. Les principes généraux du traitement comprennent les traitements de soutien (fluides, électrolytes, contrôle du glucose et nutrition), les traitements médicaux (prokinétiques, antiémétiques et soulagement de la douleur) et les traitements invasifs (chirurgie, injections de Botox, stimulation gastrique ou stimulation électrique).79
Le traitement de soutien est généralement commencé à l’hôpital et se concentre sur la normalisation des troubles liquidiens, électrolytiques et nutritionnels. Lors de l’apport d’un soutien nutritionnel, l’alimentation entérale est préférable à l’alimentation parentérale, car elle est plus physiologique et peut aider à maintenir la flore intestinale. En outre, les changements de régime alimentaire peuvent être très utiles en cas de gastroparésie. Les régimes pauvres en fibres, en graisses et en résidus sont recommandés pour les patients atteints de gastroparésie.85 Les régimes riches en fibres peuvent augmenter les symptômes, car ils nécessitent une plus grande digestion.
Médicaments. Prokinétiques : Aux États-Unis, le métoclopramide et l’érythromycine sont les médicaments les plus couramment utilisés pour traiter la gastroparésie. Cependant, le métoclopramide fait l’objet d’un avertissement boîte noire en raison du risque de dyskinésie tardive. L’apparition de cette affection est directement liée à la durée d’utilisation du métoclopramide et au nombre de doses prises. Lorsque vous utilisez ce médicament, il est préférable de l’utiliser uniquement chez les patients symptomatiques et de commencer par la dose efficace la plus faible, 15 minutes avant les repas. Les congés médicamenteux peuvent parfois aider à prolonger la durée des effets.90
La dompéridone est un agoniste dopaminergique plus sélectif qui est aussi efficace que le métoclopramide mais qui a moins d’effets secondaires sur le système nerveux central.91
Antiémétiques : Les antiémétiques peuvent être utilisés pour aider à soulager les symptômes. Cependant, le risque d’interactions médicamenteuses est important et doit être surveillé attentivement.
La gestion de la douleur peut être un défi chez les patients atteints de gastroparésie. Les antidépresseurs tricycliques sont souvent utilisés comme traitement de première intention pour la douleur dans la gastroparésie. Les approches de deuxième ligne sont l’agoniste faible des récepteurs mu-opioïdes, le tramadol, qui libère également la sérotonine et inhibe la recapture de la norépinéphrine, et l’analogue de l’acide gamma-aminobutyrique, la gabapentine. Cependant, l’utilisation de narcotiques dans la gastroparésie n’est pas recommandée, car elle peut contribuer à la constipation et à l’aggravation des symptômes.
Traitements invasifs : Les injections de Botox sont couramment utilisées dans le traitement de la gastroparésie, mais leur utilisation n’est pas étayée par des essais cliniques.92,93
Le dispositif de stimulation électrique gastrique a été approuvé par la FDA dans le cadre d’une exemption pour dispositif humanitaire en 2000.94 Le dispositif de stimulation électrique gastrique délivre une stimulation électrique à haute fréquence et à faible énergie à l’estomac. Il est plus utile dans la gastroparésie diabétique que dans la gastroparésie idiopathique. Une méta-analyse a montré des bénéfices substantiels sur les symptômes des patients. Le mécanisme exact de ses bienfaits n’est toujours pas connu.95 Il a été proposé que la stimulation électrique gastrique entraîne des changements dans les mécanismes centraux qui contrôlent les nausées et les vomissements, augmente la fonction vagale et entraîne une diminution de la sensibilité à la distension.97 Les patients qui répondent bien réagissent généralement rapidement. Cela a conduit certains à recommander d’abord un essai de placement temporaire d’électrodes avant une mise en œuvre à long terme.
Paroles cliniques
- La gastroparésie diabétique est plus fréquente chez les personnes atteintes de diabète de longue date et chez celles qui présentent d’autres complications microvasculaires.
- Le diagnostic de référence pour la gastroparésie est la scintigraphie gastro-œsophagienne.
- Des régimes pauvres en fibres, en graisses et en résidus sont recommandés dans la gastroparésie diabétique.
- Les traitements pharmacologiques et interventionnels ont des bénéfices limités et un risque significatif à long terme.
Chéiroarthropathie diabétique
L’une des complications moins connues du diabète est la chéiroarthropathie. Cette affection se caractérise par une mobilité articulaire limitée en raison de l’épaississement de la peau chez les personnes atteintes de diabète de longue date. Elle a probablement été la première complication identifiée du diabète de type 1. Les taux de prévalence varient largement de 8 à 50 %.98
La chéiroarthropathie serait causée par la glycosylation et la réticulation du collagène. Elle peut affecter la peau et les tendons et se traduire par une mobilité articulaire limitée, le plus souvent par une extension des doigts, une raideur et une douleur. Le signe classique de la chéiropathie diabétique à l’examen physique est le « signe de la prière ». Dans ce cas, une personne est incapable d’aplatir complètement ses mains pour « prier », laissant un espace entre les doigts de la main gauche et de la main droite. Il est prouvé que les personnes qui développent une chéiropathie ont un risque trois fois plus élevé de complications microvasculaires.99
La chéiropathie diabétique est généralement plus grave chez les personnes dont la glycémie est de longue date ou mal contrôlée. Heureusement, de nombreuses personnes voient leurs symptômes soulagés et leur mobilité améliorée lorsque le contrôle de la glycémie s’améliore.100
Conclusion
La prise en charge des complications du diabète nécessite une équipe multidisciplinaire. Le dépistage précoce de la rétinopathie, de la néphropathie et de la neuropathie est essentiel, étant donné la nature asymptomatique de la maladie. La marque de fabrique de la gestion du diabète pour toutes les complications reste le contrôle de la glycémie et de la pression artérielle.
- American Diabetes Association. Cost of Diabetes. Disponible sur : http://www.diabetes.org/advocacy/news-events/cost-of-diabetes.html?referrer=https://www.google.com/. Mise à jour le 22 juin 2015. Consulté le 8 février 2017.
- UK Prospective Diabetes Study Group. Contrôle intensif de la glycémie par les sulfonylurées ou l’insuline par rapport au traitement conventionnel et risque de complications chez les patients atteints de diabète de type 2. Lancet 1998;352:837-853.
- Gregg EW, Yanfed L, Wang J. Changements dans les complications liées au diabète aux États-Unis, 1990-2010. N Engl J Med 2014;370:1514-1523.
- Pop-Busui R, Boulton A, Feldman E, et al. Diabetes neuropathy : Une déclaration de position de l’Association américaine du diabète. Diabetes Care 2017;40:136-154.
- Leasher JL, Bourne RR, Flaxman SR, et al. Estimations mondiales du nombre de personnes aveugles ou malvoyantes en raison d’une rétinopathie diabétique : Une méta-analyse de 1990 à 2010. Diabetes Care 2016;39:1643-1649.
- National Eye Institute. Faits concernant la maladie oculaire diabétique. Disponible sur : https://nei.nih.gov/health/diabetic/retinopathy. Mis à jour en septembre 2015. Consulté le 8 février 2017.
- Fong, DS, Aiello L, Gardner TW, et al. Retinopathy in diabetes. Diabetes Care 2004;27(Suppl 1):S84-S87.
- American Diabetes Association. Normes de soins médicaux dans le diabète-2017. Diabetes Care 2017;40 :(Suppl 1):S4-S5.
- Doggen K, Nobels F, Scheen AJ, et al. Facteurs de risque et complications cardiovasculaires associés à l’albuminurie et à l’altération de la fonction rénale dans le diabète insulinotraité. J Diabetes Complications 2013;27:370-375.
- Le groupe de recherche sur l’essai de contrôle et de complications du diabète. L’effet du traitement intensif du diabète sur le développement et la progression des complications à long terme dans le diabète sucré insulinodépendant. N Engl J Med 1993;329:977-986.
- Groupe d’étude sur l’œil et le groupe d’étude Action to Control Cardiovascular Risk in Diabetes Follow-On (ACCORDION). Effets persistants du contrôle glycémique intensif sur la rétinopathie dans le diabète de type 2 dans l’étude de suivi Action to Control Cardiovascular Risk in Diabetes (ACCORD). Diabetes Care 2016;39:1089-1100.
- Groupe d’étude ACCORD, groupe d’étude ACCORD Eye, Chew EY, et al. Effets des traitements médicaux sur la progression de la rétinopathie dans le diabète de type 2. N Engl J Med 2010;363:233-244.
- Chew EY, Davis MD, Danis RP, et al. Les effets de la prise en charge médicale sur la progression de la rétinopathie diabétique chez les personnes atteintes de diabète de type 2 : The Action to Control Cardiovascular Risk in Diabetes (ACCORD) Eye Study. Ophtalmology 2014;121:2443-2451.
- Groupe de recherche sur l’essai de contrôle et de complications du diabète. Effet de la grossesse sur les complications microvasculaires dans l’essai de contrôle et de complications du diabète. Diabetes Care 2000;23:1084-1091.
- Colberg SR, Sigal RJ, Yardley JE, et al. Activité physique/exercice et diabète : Une déclaration de position de l’Association américaine du diabète. Diabetes Care 2016;39:2065-2079.
- Le groupe de recherche sur l’étude de la rétinopathie diabétique. Rapport préliminaire sur les effets de la thérapie de photocoagulation. Am J Ophthalmol 1976;81:383-396.
- Groupe de recherche sur l’étude de la rétinopathie diabétique à traitement précoce. Photocoagulation pour l’œdème maculaire diabétique : Rapport numéro 1 de la Early Treatment Diabetic Retinopathy Study. Arch Ophthalmol 1985;103:1796-1806.
- Nguyen QD, Brown DM, Marcus DM, et al. Ranibizumab pour l’œdème maculaire diabétique : Résultats de 2 essais randomisés de phase III : RISE et RIDE. Ophtalmology 2012;119:789-801.
- Wong TY, Cheung CMG, Larsen M, et al. Rétinopathie diabétique. Nat Rev Disease Prim doi:10.1038/nrdp.2016.12 ; publié en ligne le 17 mars 2016.
- Batuman V, Soman AS, Schmidt RJ, Soman SS. La néphropathie liée au diabète. Medscape Disponible à : http://emedicine.medscape.com/article/238946-overview. Mise à jour le 30 septembre 2016. Consulté le 12 février 2017.
- Tuttle KR, Bakris GL, Bilous RW, et al. Diabetic kidney disease : Un rapport d’une conférence de consensus de l’ADA. Diabetes Care 2014;37:2864-2883. https://doi.org/10.2337/dc14-1296
- Patel A, MacMahon S, Chalmers J, et al. Contrôle intensif de la glycémie et résultats vasculaires chez les patients atteints de diabète de type 2. N Engl J Med 2008;358:2560-2572.
- Duckworth W, Abraira C, Moritz T, et al. Glucose control and vascular complications in veterans with type 2 diabetes. N Engl J Med 2009;360:129-139.
- Ismail-Beigi F, Craven T, Banerji MA, et al. Effet du traitement intensif de l’hyperglycémie sur les résultats microvasculaires dans le diabète de type 2 : An analysis of the ACCORD randomised trial. Lancet 2010;376:419-430.
- National Kidney Foundation. Guide de pratique clinique KDOQI pour le diabète et l’IRC : mise à jour 2012. Am J Kidney Dis 2012;60:850-886.
- Fox CS, Matsushita K, Woodward M, et al. Chronic Kidney Disease Prognosis Consortium. Associations des mesures de la maladie rénale avec la mortalité et l’insuffisance rénale terminale chez les individus avec et sans diabète : A meta-analysis. Lancet 2012;380:1662-1673.
- Hahr AJ, Molitch ME. Gestion du diabète sucré chez les patients atteints de maladie rénale chronique. Clin Diabetes Endocrinol 2015. doi : 10.1186/s40842-015-0001-9.
- Alsaad KO, Herzenberg AM. Distinguer la néphropathie diabétique des autres cas de glomérulosclérose : An update. J Clin Catholic 2007;60:18-26.
- Narva AS, Bilous RW. Évaluation en laboratoire de la maladie rénale diabétique. Diabetes Spectr 2015;28:162-166.
- Levey AS, Stevens LA, Schmid CH, et al. Une nouvelle équation pour estimer le débit de filtration glomérulaire. Ann Intern Med 2009;150:604-612.
- National Kidney Foundation. Directives de pratique clinique KDOQI pour la maladie rénale chronique : Évaluation, classification et stratification. Am J Kidney Dis 2002;39(2 Suppl 1):S1-S266.
- de Boer IH, Rue TC, Cleary PA, et al. Long-term renal outcomes of patients with type 1 diabetes mellitus and microalbuminuria : Une analyse de la cohorte Diabetes Control and Complications Trial/Epidemiology of Diabetes Interventions and Complications. Arch Intern Med 2011;171:412-420.
- Wanner C, Inzucchi SE, Lachin JM, et al. Empagliflozin et progression de la maladie rénale dans le diabète de type 2. N Engl J Med 2016;375:323-334.
- Heerspink HJL, Desai M, Jardine M, et al. La canagliflozine ralentit la progression du déclin de la fonction rénale indépendamment des effets glycémiques. J Am Soc Nephrol 2016;28:1-8.
- Lexi-Drugs. Lexicomp. Wolters Kluwer Health, Inc. Riverwoods, IL. Disponible à : http://online.lexi.com. Consulté le 31 octobre 2016.
- Micromedex Solutions. Truven Health Analytics, Inc. Ann Arbor, MI. Disponible à : http://www.micromedexsolutions.com. Consulté le 31 octobre 2016.
- James PA, Oparil S, Carter BL, et al. 2014 evidence-based guideline for the management of high blood pressure in adults. JAMA 2014;311:507-520.
- King P, Peacock I, Donnelly R. The United Kingdom Prospective Diabetes Study (UKPDS) : Implications cliniques et thérapeutiques pour le diabète de type 2. Br J Clin Pharmacol 1999;48:643-648.
- Jackevicius CA, Wong J, Aroustamian I, et al. Rates and predictors of ACE inhibitor discontinuation subsequent to elevated serum creatinine : Une étude de cohorte rétrospective. BMJ Open 2014;4:e005181.
- Mauer M, Zinman B, Gardiner R, et al. Effets rénaux et rétiniens de l’énalapril et du losartan dans le diabète de type 1. N Engl J Med 2009;361:40-51.
- Bilous R, Chaturvedi N, Sjølie AK, et al. Effet du candésartan sur la microalbuminurie et le taux d’excrétion d’albumine dans le diabète : Three randomized trials. Ann Intern Med 2009;151:11-20.
- Haller H, Ito S, Izzo JL Jr, et al. Olmesartan pour le retard ou la prévention de la microalbuminurie dans le diabète de type 2. N Engl J Med 2011;364:907-917.
- Makani H, Bangalore S, Desouza KA, et al. Efficacité et sécurité du double blocage du système rénine-angiotensine : Méta-analyse d’essais randomisés. BMJ 2013;346:f360.
- Miao Y, Ottenbros SA, Laverman GD, et al. Effet d’une réduction de l’acide urique sur les résultats rénaux pendant le traitement au losartan : Une analyse post-hoc de la réduction des paramètres dans le diabète sucré non insulino-dépendant avec l’essai de l’antagoniste de l’angiotensine II Losartan. Hypertension 2011;58:2-7.
- Lewis EJ, Hunsicker LG, Clarke WR, et al. Effet réprotecteur de l’antagoniste des récepteurs de l’angiotensine irbesartan chez les patients atteints de néphropathie due au diabète de type 2. N Eng J Med 2001;354:851-860.
- Adler A, Casula A, Steenkamp R, et al. Association entre la glycémie et la mortalité chez les personnes diabétiques sous traitement de substitution rénale au Royaume-Uni. Diabetes Care 2014;37:1304-1311.
- Sharma SG, Bomback AS, Radhakrishnan J, et al. Le spectre moderne des résultats de biopsie rénale chez les patients diabétiques. Clin J Am Soc Nephrol 2013;8:1718-1724.
- Smart NA, Dieberg G, Ladhani M, Titus T. Orientation précoce vers des services spécialisés en néphrologie pour prévenir la progression vers l’insuffisance rénale terminale. Cochrane Database Syst Rev 2014;6:CD007333.
- Boulton AJM, Gries FA, Jervell JA. Lignes directrices pour le diagnostic et la gestion ambulatoire de la neuropathie périphérique diabétique. Diabet Med 1998;15:508-514.
- O’Brien PD, Hinder LM, Sakowski SA, Feldman EL. Stress ER dans la neuropathie périphérique diabétique : Une nouvelle cible thérapeutique. Antioxid Redox Signal 2014;21:621-633.
- Cameron NE, Cotter MA. Mécanismes pro-inflammatoires dans la neuropathie diabétique : Focus sur la voie du facteur nucléaire kappa B. Curr Drug Targets 2008;9:60-67.
- Tesfaye S, Chaturvedi N, Eaton SE, et al. Vascular risk factors and diabetic neuropathy. N Engl J Med 2005;352:341-350.
- Wiggin TD, Sullivan KA, Pop-Busui R, et al. Les triglycérides élevés sont corrélés à la progression de la neuropathie diabétique. Diabetes 2009;58:1634-1640.
- Stella P, Ellis D, Maser RE, Orchard TJ. Neuropathie autonome cardiovasculaire (rapport expiration et inspiration) dans le diabète de type 1. Incidence et facteurs prédictifs. J Diabetes Complications 2000;14:1-6.
- Witten DR, Tesfaye S, Chaturvedi N, et al. Risk factors for cardiac autonomic neuropathy in type 1 diabetes mellitus. Diabetologia 2005;48:164-171.
- Groupe de recherche sur le contrôle et les complications du diabète (DCCT). Effet du traitement intensif du diabète sur la conduction nerveuse dans l’essai de contrôle et de complications du diabète. Ann Neurol 1995;38:869-880.
- Groupe de recherche sur le contrôle du diabète et les complications (DCCT). L’effet de la thérapie intensive du diabète sur les mesures de la fonction du système nerveux autonome dans l’essai de contrôle et de complications du diabète (DCCT). Diabetologia 1998;41:416-423.
- Edwards JL, Vincent AM, Cheng HT, Feldman EL. Diabetic neuropathy : Des mécanismes à la prise en charge. Pharmacol Ther 2008;120:1-34.
- Vincent AM, Callaghan BC, Smith AL, Feldman EL. La neuropathie diabétique : Mécanismes cellulaires une cible thérapeutique. Nat Rev Neurol 2011;7:573-583.
- Kellogg AP, Wiggin T, Larkin D, et al. Effets protecteurs de l’inactivation du gène de la cyclooxygénase-2 contre le dysfonctionnement des nerfs périphériques et la perte de fibres nerveuses intraépidermiques dans le diabète expérimental. Diabetes 2007;56:2997-3005.
- Callaghan BC, Cheng HT, Stables CL, et al. Diabetic neuropathy : Manifestations cliniques et traitements actuels. Lancet Neurol 2012;11:521-534.
- Boulton AJM, Kirsner RS, Vileikyte L. Pratique clinique : Ulcères neuropathiques du pied diabétique. N Eng J Med 2004;351:48-55.
- Boulton AJM, Vinik AI, Arezzo JC, et al. Diabetic neuropathies : Une déclaration de l’Association américaine du diabète. Diabetes Care 2005;28:956-962.
- Boulton AJM, Armstrong DG, Albert SF, et al. Examen complet des pieds et évaluation des risques : Un rapport du groupe de travail du groupe d’intérêt sur les soins des pieds de l’American Diabetes Association, avec l’aval de l’American Association of Clinical Endocrinologists. Diabetes Care 2008;31:1679-1685.
- Tesfaye S, Boulton AJ, Dyck PJ, et al. Diabetic neuropathies : Mise à jour des définitions, des critères de diagnostic, de l’estimation de la gravité et des traitements. Diabetes Care 2010;33:2285-2293.
- Dyke PJ, Albers JW, Andersen H, et al. Diabetic polyneuropathies : Mise à jour de la définition de la recherche, des critères de diagnostic et de l’estimation de la gravité. Diabetes Metab Res Rev 2011;27:620-628.
- Freeman R. Toutes les neuropathies du diabète ne sont pas d’étiologie diabétique : Diagnostic différentiel de la neuropathie diabétique. Curr Diabe Rep 2009;9:423-431.
- Balducci S, Iacobellis G, Parisi L, et al. Exercise training can modify the natural history of diabetic peripheral neuropathy. J Diabetes Complications 2006;20:216-223.
- Bril V, England J, Franklin GM, et al. Evidence-based guideline : Traitement de la neuropathie diabétique douloureuse. Rapport de l’Académie américaine de neurologie, de l’Association américaine de médecine neuromusculaire et électrodiagnostique et de l’Académie américaine de médecine physique et de réadaptation. Neurology 2011;76:1758-1765.
- Dowell D, Haegerich TM, Chou R. CDC Guideline for prescribing opioids for chronic pain – United States 2016. MMWR Recomm Rep 2016;65:1-49.
- Tesfaye S, Wilhelm S, Lledo A, et al. Duloxétine et prégabaline : monothérapie à haute dose ou leur association ? L’étude « COMBO-DN » – une étude multinationale, randomisée, en double aveugle et en groupes parallèles chez des patients souffrant de douleurs neuropathiques périphériques diabétiques. Pain 2013;154:2616-2625.
- Ahn AC, Bennani T, Freeman R, et al. Deux styles d’acupuncture pour traiter la neuropathie diabétique douloureuse – un essai pilote de contrôle randomisé. Acupunct Med 2007;25:11-17.
- Garrow A, Xing M, Vere J, et al. Role of acupuncture in the management of diabetic painful neuropathy (DPN) : Un essai pilote randomisé. Acupunct Med 2014;32:242-249.
- Ziegler D, Nowak H, Kempler P, et al. Traitement de la polyneuropathie diabétique symptomatique avec l’acide alpha-lipoïque antioxydant : A meta-analysis. Diabet Med 2004;21:114-121.
- Ziegler D, Low PA, Litchy WJ, et al. Efficacité et sécurité du traitement antioxydant par l’acide alpha-lipoïque sur 4 ans dans la polyneuropathie diabétique : l’essai NATHAN 1. Diabetes Care 2011;34:2054-2060.
- Kuwabara S, Ogawara K, Harrori T, et al. Les effets aigus du contrôle glycémique sur l’excitabilité axonale dans les nerfs diabétiques humains. Intern Med 2002;41:360-365.
- Peltier A, Goutman SA, Callaghan BC. La neuropathie diabétique douloureuse. BMJ 2014;348:g1799.
- Soykan I, Sivri B, Sarosiek I, et al. Démographie, caractéristiques cliniques, profils psychologiques et d’abus, traitement et suivi à long terme des patients atteints de gastroparésie. Dig Dis Sci 1998;43:2398-2404.
- Camilleri M, Bharucha AE, Farrugia G. Epidemiology, mechanisms, and management of diabetic gastroparesis. Clin Gastroenterol Hepatol 2011;9:5-12.
- Shin AS, Camilleri M. Évaluation diagnostique de la gastroparésie diabétique. Diabetes 2013;62:2667-2673.
- Hasler WL, Wilson L, Parkman HP, Lee L. Importance de la douleur abdominale comme symptôme dans la gastroparésie : Relation avec les facteurs cliniques, la gravité de la maladie, la qualité de vie, la rétention gastrique et l’utilisation de médicaments. Gastroenterology 2010;138. doi : 10.1016/S0016-5085(10)62131-2.
- Choung RS, Locke GR 3rd, Schleck CD, et al. Risk of gastroparesis in subjects with type 1 and 2 diabetes in the general population. Am J Gastroenterol 2012;107:82-88.
- Maleki D, Locke GR III, Camilleri M, et al. Symptômes du tractus gastro-intestinal chez les personnes atteintes de diabète sucré dans la communauté. Arch Intern Med 2000;160:2808-2816.
- Bytzer P, Talley NJ, Leemon M, et al. Prévalence des symptômes gastro-intestinaux associés au diabète sucré : Une enquête en population auprès de 15 000 adultes. Arch Intern Med 2001;161:1989-1996.
- Jones KL, Russo A, Berry MK, et al. Une étude longitudinale de la vidange gastrique et des symptômes gastro-intestinaux supérieurs chez les patients atteints de diabète sucré. Am J Med 2002;113:449-455.
- Gaber AO, Hathaway DK, Abell T, et al. Improved autonomic and gastric function in pancreas-kidney vs kidney-alone transplantation contributes to quality of life. Transplant Proc 1994;26:515-516.
- Punkkinen J, Färkkilä M, Mätzke S, et al. Symptômes abdominaux supérieurs chez les patients atteints de diabète de type 1 : Sans rapport avec une altération de la vidange gastrique causée par une neuropathie autonome. Diabet Med 2008;25:570-577.
- Schvarcz E, Palmer M, Aman J, et al. L’hyperglycémie physiologique ralentit la vidange gastrique chez les sujets normaux et les patients atteints de diabète sucré insulinodépendant. Gastroenterology 1997;113:60-66.
- Miller G, Palmer KR, Smith B, et al. Smoking delays gastric emptying of solids. Gut 1989;30:50-53.
- Rao AS, Camilleri M. Article de synthèse : Métoclopramide et dyskinésie tardive. Aliment Pharmacol Ther 2010;31:11-19.
- Patterson D, Abell T, Rothstein R, et al. Une comparaison multicentrique en double aveugle de la dompéridone et du métoclopramide dans le traitement des patients diabétiques présentant des symptômes de gastroparésie. Am J Gastroenterol 1999;94:1230-1234.
- Arts J, Holvoet L, Caenepeel P, et al. Essai clinique : Une étude croisée randomisée et contrôlée de l’injection intrapylorique de toxine botulique dans la gastroparésie. Aliment Pharmacol Ther 2007;26:1251-1258.
- Friedenberg FK, Palit A, Parkman HP, et al. Toxine botulique A pour le traitement du retard de vidange gastrique. Am J Gastroenterol 2008;103:416-423.
- Humanitarian Device Exemption for Enterra Device. Fed Reg 2000;65:78495-78496.
- O’Grady G, Egbuji JU, Du P, et al. Stimulation électrique gastrique à haute fréquence pour le traitement de la gastroparésie : A meta-analysis. World J Surg 2009;33:1693-1701.
- Reddymasu SC, Sarosiek I, McCallum RW. Gastroparésie sévère : Traitement médical ou stimulation électrique gastrique. Clin Gastroenterol Hepatol 2010;8:117-124.
- McCallum RW, Dusing RW, Sarosiek I, et al. Mécanismes d’amélioration symptomatique après stimulation électrique gastrique chez les patients gastroparétiques. Neurogastroenterol Motil 2010;22:161-167.
- Douloumpakas I, Pyrpasopoulou A, Triantafyllou A, et al. Prévalence des troubles musculo-squelettiques chez les patients atteints de diabète sucré de type 2 : A pilot study. Hippokratia 2007;11:216-218.
- Rosenbloom AL, Silverstein JH, Lezotte DC. La mobilité limitée des articulations dans le diabète sucré de l’enfance indique un risque accru de maladie microvasculaire. N Engl J Med 1981;305;191-194.
- Lister DM, Graham-Brown RAC, Burden AC. Résolution de la chéiroarthropathie diabétique. Br Med J 1986;293:1537.