La capacité de drainer complètement la cavité thoracique, de briser les localisations de liquide pleural, de visualiser complètement tous les aspects de l’espace pleural et d’éviter la morbidité d’une thoracotomie a rendu la thoracoscopie attrayante dans la gestion des empyèmes et des hémothorax.
Sélection des patients
La capacité de drainer complètement la cavité thoracique, de briser les localisations de liquide pleural, de visualiser complètement tous les aspects de l’espace pleural et d’éviter la morbidité d’une thoracotomie a rendu la thoracoscopie attrayante dans la gestion de l’empyème et de l’hémothorax.
Tableau 1 : Critères de laboratoire pour le drainage de l’empyème
Un épanchement occupant plus de 50% de l’hémithorax ou un épanchement localisé;
Une coloration ou une culture de Gram positive du liquide pleural;
Un liquide pleural purulent dont le pH est inférieur à 7.20 ou un glucose inférieur à 60,
Un taux d’acide lactique déshydrogénase supérieur à trois fois la limite normale supérieure du sérum.
Les patients dont il est prouvé qu’ils ont un épanchement pleural infecté par thoracentèse et qui répondent aux critères de laboratoire pour une intervention sont candidats à une décortication thoracoscopique.
Lorsque l’empyème est au stade exsudatif ou fibrinopurulent et qu’il est présent depuis une durée d’environ 3 semaines ou moins, l’intervention thoracoscopique est généralement réussie (Vidéo 1, Vidéo 2 ci-dessous). Lorsque l’empyème est présent depuis plus de 3 semaines (phase d’organisation), il peut être plus difficile de réaliser une décortication adéquate en raison d’adhérences plus denses et de la présence d’un pelage viscéral pulmonaire adhérent . Les patients présentant un empyème exsudatif ou fibrinopurulent peuvent presque toujours être abordés par thoracoscopie ; la tomodensitométrie n’est pas utile pour prédire les patients qui devront subir une thoracotomie. La conversion en thoracotomie ouverte est effectuée lorsque cela est nécessaire et ne doit pas être considérée comme un échec de la thoracoscopie, mais plutôt comme l’exercice d’un jugement chirurgical mature. La thoracoscopie est également indiquée lorsque la nature du processus pleural n’est pas diagnostiquée, car elle permet une biopsie pleurale dirigée qui est susceptible de poser le diagnostic tout en évitant la morbidité d’une thoracotomie. D’autres indications pour la décortication thoracoscopique comprennent l’hémothorax et le débridement médiastinal chez les patients présentant une médiastinite descendante .
Une thoracotomie antérieure, une pleurodèse antérieure au talc et un empyème antérieur sont des contre-indications relatives à la thoracoscopie. L’incapacité à tolérer une ventilation à poumon unique et la présence d’un fibrothorax sont des contre-indications à la réalisation d’une décortication thoracoscopique. Les patients qui développent un empyème à la suite d’une perforation œsophagienne ne doivent pas être pris en charge par thoracoscopie mais par thoracotomie.
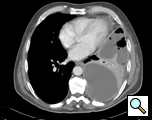
Figure 1 : Scanner montrant un empyème
Le scanner du thorax fournit des informations sur la localisation, le degré de localisation, l’étendue de l’empyème et le parenchyme pulmonaire sous-jacent (figure 1). Il n’est pas rare qu’un organisme ne soit pas identifié sur la culture du liquide pleural et, par conséquent, une couverture antibiotique à large spectre doit être instaurée lorsque le diagnostic d’empyème est posé. Ceci peut être modifié si les données de la culture identifient un organisme. Les antibiotiques sont poursuivis pendant la période périopératoire.
Une évaluation de l’état nutritionnel du patient doit être faite et des alimentations complémentaires sont initiées si nécessaire. Une bronchoscopie doit être réalisée avant la décortication pour exclure une obstruction endobronchique dans la partie du poumon qui est piégée par l’empyème.
Étapes opératoires
L’anesthésie générale est instituée et l’isolation pulmonaire est réalisée à l’aide d’une sonde endotrachéale à double lumière ou d’une sonde à simple lumière avec un bloqueur bronchique. Cela permet l’expansion et le collapsus du poumon selon les besoins pendant la décortication. La surveillance peropératoire comprend une ligne de pression artérielle, un accès intraveineux de gros calibre, une sonde de Foley et une oxymétrie de pouls. Le patient est positionné comme pour une thoracotomie postérolatérale.

Figure 3. Radiographie thoracique postopératoire après décortication par VATS, avec tubes de drainage pleural gauche en place.

Figure 2b : Utilisation d’un écarteur pour maintenir ouvert le port de travail.
Le port de la caméra est placé dans le 7e ou 6e espace intercostal dans la ligne de l’épine iliaque antéro-supérieure ou juste en avant de celle-ci. La décortication VATS et/ou l’évacuation de l’hémothorax peuvent être effectuées par 2 ou 3 ports. Le port de travail doit être placé au-dessus du 5e espace intercostal entre les lignes axillaires moyenne et antérieure. (Figure 2a) L’incision intercostale doit permettre l’introduction de 3 doigts. Un Weitlaner est utilisé pour rétracter les tissus mous (Figure 2b). Un troisième port peut être placé postérieurement, positionné pour permettre l’accès à la partie antérieure de la cavité pleurale.
Une fois le thorax pénétré, une aspiration de Yankauer est utilisée pour drainer le thorax de l’épanchement ou du sang (Vidéo 3, Vidéo 4 ci-dessous) et avec un doigt utilisé pour briser les localisations simples (Vidéo 5 ci-dessous). Le scanner préopératoire permet de guider ce drainage initial « en aveugle » et de créer un espace pleural fonctionnel pour les instruments thoracoscopiques. Les dépôts gélatineux fibrineux et les caillots sanguins sont retirés à l’aide d’une pince à anneau courbe (Vidéo 6, Vidéo 7 ci-dessous). Le peeling pleural viscéral peut être débridé à l’aide de pinces à anneaux, d’une curette (Vidéo 8 ci-dessous) et d’un dissecteur de cacahuète comme dans une décortication ouverte.
Une fois qu’un espace pleural a été créé, l’élimination du matériel fibrineux est effectuée sur la partie latérale de la cavité pleurale en partant de l’apex du poumon et en allant vers le diaphragme ou vice versa. La ventouse et la pince à anneau sont utilisées ensemble pour retirer le matériel fibrineux de la cavité pleurale et la curette, la cacahuète et la pince à anneau sont utilisées pour disséquer la couenne sur le poumon. A la face inférieure de la cavité pleurale, il est utile d’identifier et de séparer le lobe inférieur du poumon du diaphragme (Vidéo 9 ci-dessous). Ce plan est développé postérieurement et antérieurement permettant au poumon de remplir le sillon costodiaphragmatique une fois la décortication terminée. Ensuite, la face postérieure de l’espace pleural est débridée et le poumon sous-jacent est décortiqué. L’exposition est facilitée en roulant le patient vers l’avant. Enfin, la face antérieure de la cavité pleurale est débridée et le poumon libéré de l’endroit où il adhère au médiastin. Cette exposition est améliorée en roulant le patient vers l’arrière. Sur la gauche, il faut veiller à protéger le nerf phrénique.
La ventilation intermittente du poumon permet d’évaluer le caractère complet de la décortication au fur et à mesure de la dissection. Si les progrès ne sont pas suffisants ou si l’expansion du poumon est inadéquate pour remplir le thorax, une conversion en décortication ouverte doit être effectuée. Un soin particulier doit être apporté à l’hémostase (vidéo 10, vidéo 11 ci-dessous) à la fois sur la plèvre pariétale et viscérale.
Une fois qu’un débridement adéquat a été réalisé, une irrigation est effectuée et l’expansion du poumon est visualisée pour s’assurer que la cavité pleurale est remplie par le poumon (vidéo 12 ci-dessous). Des tubes thoraciques peuvent être placés antérieurement et postérieurement pour le drainage de l’air et des fluides. S’il y a un petit espace au-dessus du diaphragme, un tube à angle droit est placé dans cette position pour assurer le drainage et permettre une expansion pulmonaire progressive.
Les tubes thoraciques sont maintenus en aspiration pour s’assurer qu’il y a une expansion pulmonaire complète et un drainage adéquat de l’espace pleural (Figure 3). Lorsque le drainage est inférieur à 200cc/24h, les tubes peuvent être retirés. Pour les patients avec un empyème, les antibiotiques intraveineux sont poursuivis pendant le cours postopératoire et pendant 14 jours supplémentaires d’antibiotiques oraux une fois que le patient est sorti. Pour les patients présentant un hémothorax, les antibiotiques sont poursuivis en postopératoire pendant 48 heures.
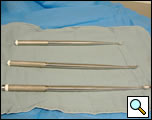
Figure 5. Curettes longues à utiliser pour la décortication VATS.

Figure 4b : Pince à anneau courbe ouverte.
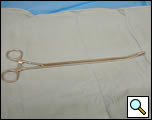
Figure 4a. Pince à anneaux courbes fermée (panneau de gauche) et ouverte (panneau de droite).
Carte de préférence
- Thoracoscope 30 degrés
- Pince à anneau courbé pour thoracoscopie (figures 4a, 4b)
- Suceuse Yankauer
- Dissecteur de cacahuètes
- Curettes longues (figure 5)
Conseils & Pièges
- Utiliser une ventouse / un doigt / un bâtonnet d’éponge amygdalienne pour créer « à l’aveugle » un espace de travail dans la cavité pleurale.
- Vérifier que le poumon se réexpanse pour remplir adéquatement la poitrine avant de quitter la salle d’opération.
- En cas de doute sur la progression de l’opération, le saignement, la taille de la fuite d’air et la réexpansion du poumon, procéder à une décortication ouverte.
Résultats
La décortication par thoracoscopie est maintenant éprouvée dans la prise en charge des empyèmes et le temps écoulé entre l’origine de l’empyème et l’intervention chirurgicale est probablement le plus prédictif de la capacité à réaliser l’opération avec succès . La tomodensitométrie n’est pas utile à cet égard, mais elle aide à placer le port et à déterminer la direction de la décortication dans le thorax. Les principes de la décortication ouverte doivent être suivis en utilisant la technologie thoracoscopique. Toutes les zones de matériel fibrineux doivent être drainées et le poumon sous-jacent libéré d’une pellicule pleurale restrictive pour permettre une ré-expansion complète. Les taux de réussite sont élevés et la durée du tube thoracique, la durée du séjour à l’hôpital, la douleur postopératoire et la récupération sont améliorées par rapport à la thoracotomie. Les taux de mortalité sont faibles, tout comme les taux de récidive et les complications. Les conversions en thoracotomie ouverte sont plus fréquentes qu’après d’autres procédures thoracoscopiques, mais cela doit être considéré comme un exercice de jugement chirurgical sain plutôt qu’un échec de la technique.
La décortication thoracoscopique étend la polyvalence du chirurgien thoracique dans son traitement des infections de l’espace pleural et peut être utilisée pour le diagnostic et le traitement de ces dernières avec d’excellents résultats.
Vidéo 1
Vidéo 2
Vidéo 3
Vidéo 4
Vidéo 5
Vidéo 6
Vidéo 7
Video 8
Video 9
Video 10
Video 11
Video 12
- Light RW. Épanchements parapneumoniques et empyème. Proc Am Thorac Soc 2006;3:75-80.
- Cassina PC et al. La thoracoscopie vidéo-assistée dans le traitement de l’empyème pleural : gestion et résultats basés sur le stade. J Thorac Cardiovasc Surg 1999;117:234-8.
- Lardinois D et al. Delayed referral and gram-negative organisms increase the conversion thoracotomy rate in patients undergoing video-assisted thoracoscopic surgery for empyema. Ann Thorac Surg 2005;79:1851-6.
- Roberts JR. La chirurgie mini-invasive dans le traitement de l’empyème : prise de décision peropératoire. Ann Thorac Surg 2003;76:225-30.
- Navsaria PH, Vogel RJ, Nicol AJ. Évacuation par thoracoscopie d’un hémothorax post-traumatique retenu. Ann Thorac Surg 2004;78:282-6.
- Shimizu K, et al. Successful video-assisted mediastinoscopic drainage of descending necrotizing mediastinitis. Ann Thorac Surg 2006;81:2279-81.
- Hope WW, Bolton WD, Stephenson JE. L’utilité et le moment de l’intervention chirurgicale pour l’empyème parapneumonique à l’ère de la thoracoscopie vidéo-assistée. Am Surg 2005;71:512-4.
- Luh SP, et al. Video-assisted thoracoscopic surgery in the treatment of complicated parapneumonic effusions or empyemas : outcome of 234 patients. Chest 2005;127:1427-32.
- Wurnig PN, et al. Chirurgie thoracique vidéo-assistée pour empyème pleural. Ann Thorac Surg 2006;81:309-13.