Introduction
Le syndrome du cordon captif (SCC) est un trouble neurologique du développement causé par un conus medullaris anormalement bas. Il se manifeste généralement dans l’enfance, mais il peut persister sans être détecté jusqu’à l’âge adulte, et il peut être associé à un lipome intradural. Les patients présentant des anomalies coexistantes (par exemple, myéloméningocèle) et des symptômes cliniques clairs (par exemple, faiblesse progressive des jambes, incontinence urinaire) peuvent nécessiter un traitement chirurgical. L’objectif de la chirurgie est de détacher la moelle épinière afin de soulager l’étirement de la moelle épinière. Néanmoins, les indications de la chirurgie restent controversées (1).
En revanche, la fistule artérioveineuse durale rachidienne (FAVD) est une affection acquise. C’est la malformation vasculaire la plus fréquente dans la colonne vertébrale chez l’adulte. Elle est formée dans le foramen neural par une connexion anormale et directe entre l’artère durale (qui alimente le manchon de la racine durale et la dureté spinale adjacente) et la veine médullaire (qui draine le plexus veineux coronal) (2, 3).
Elle peut se présenter avec des douleurs dorsales et un déficit neurologique progressif. Un SDAVF nécessite généralement une prise en charge chirurgicale ou endovasculaire.
La coïncidence d’un SCT, d’un lipome (ou d’une lipomyéloméningocèle) et d’un SDAVF au niveau du sacrum est très rare. Dans cette communication, nous rapportons deux patients de ce type. (4-6).
Cas matériel
Cas 1
Une femme de 30 ans s’est présentée avec une histoire de 10 ans de douleur dans la colonne lombo-sacrée ; elle avait eu une radiation occasionnelle aux deux membres inférieurs. Après son premier accouchement, elle a développé des douleurs dorsales. L’IRM a mis en évidence une moelle épinière au niveau de L4 et un lipome du filum terminale. L’IRM a également montré des veines tortueuses à la surface de la moelle épinière (figure 1C). Neuf ans plus tard, lors de la deuxième grossesse, elle a noté une faiblesse et une perte sensorielle, un déséquilibre avec incontinence urinaire et fécale. À l’admission, elle présentait une faiblesse bilatérale en flexion plantaire (grade 4 selon le système modifié du Medical Research Council) et une réduction de la sensation dans les régions fessières et les jambes, ainsi qu’une réponse plantaire. Les signes de Babinski et de Rossolimo étaient présents de manière bilatérale. Une IRM répétée a révélé des changements hyperintenses T2 intraspinaux dans la colonne thoracique et le conus (Figures 1A, B, D). Ces changements étaient compatibles avec un déficit neurologique et, après exclusion des maladies inflammatoires démyélinisantes, sur la base d’une IRM cérébrale et d’un test d’anticorps anti-aquaporine-4, un diagnostic de myélopathie a été posé. En raison de la description de veines tortueuses à la surface de la moelle épinière (figure 1B), le patient a subi une angiographie par soustraction numérique (DSA) de la colonne vertébrale. La portée de l’ASN allait du niveau Th6 à l’artère coccygienne. Les résultats n’ont pas révélé de malformation vasculaire. Par conséquent, le diagnostic préliminaire était un SCT symptomatique et un lipome du filum terminale. Au vu de la faiblesse et du déficit neurologique, une désinsertion chirurgicale de la moelle épinière, sans résection du lipome, a été planifiée.
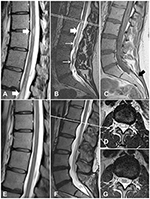
Figure 1. Images RM de la moelle épinière du cas 1, avant et après traitement. (A) Changements myélopathiques dans la moelle épinière thoracique (flèches blanches) (B) Changements myélopathiques dans le conus medullaris (flèche épaisse) et vaisseaux tortueux épaissis (flèches fines). (C)La séquence T1WI montre un lipome du filum terminale (flèche noire). (D) Une coupe transversale au niveau L1/L2 montre des changements myélopathiques. (E-G) Les images de suivi montrent la résolution des changements myélopathiques et la disparition des veines épaissies.
Le canal sacré a été ouvert avec une incision médiane. La dure-mère était fine et transparente. Après une incision médiane de la dure-mère et de l’arachnoïde, on a visualisé une tumeur qui semblait être un lipome. Elle englobait le filum terminale et les racines nerveuses spinales caudalement, jusqu’au niveau S2. Les racines nerveuses S1 et S2 étaient positionnées latéralement à la tumeur. Un vaisseau épais, tortueux et rouge vif a également été noté sur le filum terminale, s’étendant dans la direction crâniale. La surface externe de la dure-mère a été explorée bilatéralement au niveau du sacrum à la recherche d’un SDAVF. Un nidus clairement visible a été identifié au niveau de S3 du côté gauche. Un test empirique a été effectué pour confirmer cette découverte. Un clip a été placé sur la veine artérialisée, en intradural, pendant quelques minutes. Ensuite, le vaisseau sur le filum terminale a clairement changé de couleur, passant du rouge vif au gris bleuté, et sa tension a diminué. Le SDAVF a ensuite été déconnecté par voie intra-durale, et le nidus a été coagulé par voie extra-durale. En outre, le filum terminale a été coupé, et des échantillons de lipome ont été prélevés pour l’histologie. La dure-mère a été suturée de manière étanche, et la plaie a été fermée en couches.
L’évolution postopératoire a été sans incident. Quelques jours plus tard, le patient est sorti de l’hôpital. Une IRM de suivi a montré la résolution des changements myélopathiques (Figures 1E-G). Au suivi d’un an, le patient s’était considérablement amélioré, sans incontinence ni déficit moteur.
Cas 2
Un homme de 33 ans s’est présenté avec une histoire de deux ans de douleur dans la colonne lombosacrée avec une faiblesse progressive des membres inférieurs, une fréquence urinaire et une incontinence. Les symptômes s’intensifiaient après l’exercice et la station debout prolongée. L’IRM de la colonne lombaire a montré une moelle attachée au niveau L3, un lipome du filum terminale et un œdème dans la moelle épinière. Elle a également montré des veines tortueuses sur la surface postérieure de la moelle épinière (Figures 2A,D).
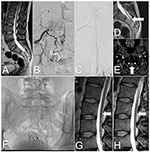
Figure 2. Images de la moelle épinière du cas 2, avant et après traitement. (A) IRM pondérée en T2 : Moelle épinière attachée et lipome sacré. (B) DSA : SDAVF au niveau S2-S3 alimenté par les artères sacrées latérales. (C) DSA : Veines tortueuses sur la face postérieure de la moelle épinière cervicale. (D) IRM pondérée en T2 : Veine tortueuse sur la face postérieure de la moelle épinière attachée (flèche). (E) IRM TOF : Veine drainante (flèche) au niveau de la jonction atlanto-occipitale. (F) La radiographie de la région sacrée montre des agents emboliques après trois embolisations. (G) IRM lombaire pondérée en T2 : Après la dernière embolisation, des vaisseaux tortueux sont visibles sur la face postérieure de la moelle épinière (flèche). (H) IRM de suivi : à 6 mois après la chirurgie, les vaisseaux tortueux ne sont plus observés sur la surface postérieure de la moelle épinière (flèche).
L’examen neurologique a révélé une faiblesse bilatérale de la flexion de l’articulation de la hanche (grade 4 selon le système modifié du Conseil de la recherche médicale), une faiblesse de la flexion plantaire (grade 3 selon le système modifié du Conseil de la recherche médicale) et une sensation réduite dans les dermatomes S2-S3. Les signes de Babinski et de Rossolimo étaient présents de manière bilatérale. Sur la base des signes cliniques et radiologiques, un SDAVF a été suspecté. Un DSA a confirmé le SDAVF au niveau S2-S3, dans la dure-mère alimentée par les artères sacrées latérales et les branches des artères iliaques internes. Des veines drainantes tortueuses étaient présentes sur la face postérieure de toute la moelle épinière et se terminaient en intracrânien (Figures 2B,C,E).
Le patient a subi trois embolisations endovasculaires, chacune avec un agent différent. Tout d’abord, une embolisation a été réalisée avec Onyx™ 18, administré dans deux microcathéters. Ce traitement a permis l’occlusion de la fistule. Le patient s’est nettement amélioré, mais en raison d’une mauvaise pénétration de la veine drainante, après quelques semaines, la fistule s’est recanalisée et les symptômes sont revenus.
Une deuxième embolisation a été réalisée 4 mois plus tard. L’accès vasculaire à la fistule était plus compliqué. Une injection de 25% de Phil™ n’était réalisable que par les petites branches sacrées de l’artère iliaque interne gauche. Cette procédure a permis d’obtenir une réduction significative du flux à travers la fistule. Dix-huit mois plus tard, une embolisation de la fistule a été tentée avec de la colle diluée. Malgré la bonne occlusion de la fistule observée dans un DSA, les vaisseaux tortueux sont restés visibles dans l’IRM de suivi (Figures 2F,G). Les symptômes ont persisté, et le patient a été qualifié pour un traitement chirurgical.
Le but de la chirurgie était d’occlure la veine drainante et l’artère nourricière et de réduire le lipome. Avec une incision médiane, le canal sacré a été ouvert sur le côté droit. La dure-mère était épaisse, et il y avait de multiples vaisseaux remplis d’agents emboliques. Il y avait un gros vaisseau rouge vif extradural et un intradural au niveau de S2-S3. Un clip a été placé sur la veine artérialisée intra-durale pendant quelques minutes. Après cela, le vaisseau a changé de couleur et la tension a diminué. Les vaisseaux intra- et extra-duraux ont été coagulés. Ensuite, le lipome a été visualisé et partiellement retiré. La dure-mère a été suturée de manière étanche, et la plaie a été fermée en plusieurs couches.
L’évolution postopératoire a été sans incident, et quelques jours plus tard, le patient est sorti de l’hôpital. Après 6 mois, une IRM de suivi a montré l’absence de vaisseaux tortueux sur la surface postérieure de la moelle épinière et une réduction significative des changements myélopathiques (figure 2H). Lors du suivi, le patient s’est considérablement amélioré, sans incontinence, avec une certaine fréquence urinaire et une légère faiblesse (grade 4 selon le système modifié du Medical Research Council).
Discussion
La cooccurrence d’un SCT, d’un lipome intradural et d’un SDAVF au niveau sacré, bien qu’exceptionnelle, doit être gardée à l’esprit, à la lumière du nombre croissant de cas rapportés. Cette étude décrit les cinquième et sixième cas de ce type, avec un TCS et un SDAVF au niveau du sacrum (Tableau 1). Récemment, un de ces cas a été répertorié par Horiuchi et al. et deux autres ont été ajoutés par Talenti et al. (6, 8).

Tableau 1. Revue de la littérature sur la coïncidence de la fistule artérioveineuse durale sacrée (FAVS), du syndrome du cordon captif (SCT) et du lipome/lipomyéloméningocèle du filum terminale.
La cause de cette triple coïncidence est énigmatique. D’une part, le SDAVF est considéré comme une entité acquise, contrairement aux anomalies spinales primaires. Cette caractéristique a suggéré que la coexistence de ces pathologies pourrait être accidentelle. D’autre part, les lipomes et les angiomes sont tous deux d’origine mésenchymateuse. Des rapports précédents de MAV intramédullaire et de lipomes combinés suggèrent qu’il pourrait y avoir une corrélation entre ces étiologies (9, 10). Cependant, à notre connaissance, aucune étude antérieure n’a décrit la coexistence d’anomalies dysraphiques et d’une MAVS au niveau du sacrum, qui s’est présentée dans l’enfance. De même, une recherche dans la base de données Medline n’a révélé aucun rapport sur un SDAVF congénital. Cependant, plusieurs rapports ont décrit un SDAVF secondaire à une chirurgie ou à un traumatisme (11-15). Par conséquent, en théorie, une chirurgie antérieure pour un myéloméningocèle pourrait déclencher ultérieurement la formation d’un SDAVF.
Des études antérieures ont rapporté qu’une thrombose du sinus veineux avec une hypertension intraveineuse associée et une obstruction du débit veineux pourrait initier la formation de shunts (16-18). Par conséquent, une explication alternative de la coexistence des troubles trouvés dans nos cas pourrait être qu’un lipome a causé une pression, qui a obstrué la sortie veineuse, et ainsi, a favorisé la formation d’un SDAVF. Ce mécanisme alternatif ne serait pas lié à une histoire antérieure de traumatisme ou de chirurgie.
Les SDAVF acquis sont typiquement localisés dans la région thoraco-lombaire, et l’âge moyen de présentation est d’environ 60 ans (19). Les FVADS sacrés sont rares, et l’âge moyen de présentation des FVADS qui coexistent avec un SCT est de 41 ans (tableau 1). Par conséquent, il est également possible qu’une anomalie congénitale, telle qu’un lipome intradural, puisse favoriser la formation d’un SDAVF à un plus jeune âge. Récemment, Horiuchi et al. ont décrit deux cas et passé en revue neuf cas précédemment publiés de SDAVF et de MAV qui coexistaient avec des lipomes spinaux de différents types et à différents niveaux de la colonne vertébrale (8). Djindjian et al. et Horiuchi et al. ont tous deux postulé que le mécanisme le plus probable à l’origine de la formation tardive d’un SDAVF pourrait être la libération par les adipocytes de facteurs angiogéniques ; ces facteurs peuvent influencer l’angiogenèse (20) et entraîner une hypervascularisation locale (5, 8). De plus, Jellema et al. ont exclu les facteurs prothrombotiques dans la pathogenèse des SDAVF (21).
La coïncidence symptomatique du SCT, du lipome sacré et du SDAVF donne lieu à la question suivante : qu’est-ce qui motive exactement les symptômes ? Talenti et al. ont récemment décrit les difficultés diagnostiques et thérapeutiques de deux cas similaires (6). Chez ces deux patients, une désolidarisation initiale de la moelle épinière et l’ablation du lipome/lipomyéloméningocèle n’ont entraîné ni amélioration ni détérioration. Après une angiographie de la colonne vertébrale, ils ont ensuite abordé la pathologie vasculaire spinale. L’histoire naturelle du lipome du filum terminale est bénigne ; seuls 5 % des patients présentent des symptômes de SCT (22). Ainsi, le lipome était la cause la moins probable de l’atteinte neurologique. Néanmoins, dans une certaine mesure, le TCS et le SDAVF pourraient causer des symptômes similaires. Un SCT devient symptomatique plus fréquemment chez les enfants que chez les adultes (23). En revanche, les déficiences liées aux SDAVF se développent chez les personnes âgées et d’âge moyen. De plus, les SDAVF sacrés induisent des hyperintensifications de la moelle épinière, visibles sur les IRM pondérées en T2, qui disparaissent généralement après un traitement réussi (24). Par conséquent, la cause la plus probable de la détérioration neurologique est le SDAVF, d’après l’âge moyen des patients présentant une coïncidence entre un SCT, un lipome sacré et un SDAVF (voir tableau 1) et d’après le bon résultat postopératoire, c’est-à-dire la résolution des changements intramédullaires, démontré par les IRM. En outre, contrairement au SCT, les symptômes du SDAVF peuvent s’exacerber avec l’effort physique et avec l’augmentation de la pression intra-abdominale, comme dans les deux cas décrits dans la présente étude.
Chez les patients présentant cette triple coïncidence, le SDAVF était toujours la cause directe de l’augmentation des symptômes. Par conséquent, l’objectif principal du traitement doit être l’occlusion. Dans la littérature, l’embolisation endovasculaire semblait être aussi efficace que la chirurgie, et l’embolisation était le seul traitement dans des cas similaires (24). Malheureusement, l’embolisation était soit irréalisable, soit inefficace dans nos cas. Avec la chirurgie, le SDAVF et le TCS ont pu être explorés et traités en une seule procédure.
Dans notre premier cas, l’objectif initial de la chirurgie était de détacher la moelle épinière, car le SDAVF n’était pas confirmé sur un DSA préopératoire. Cependant, la question demeure : pourquoi le SDAVF était-il obscurci sur l’AVD ? Oldfield et al. ont décrit trois cas de SDAVF qui n’ont pas été détectés par un DSA, mais qui étaient fortement suspectés, sur la base d’autres modalités de neuro-imagerie. Ces SDAVF ont été déconnectés avec succès pendant la chirurgie (25). Les facteurs qui entravaient la détection des DSA spinaux étaient l’obésité, l’anévrisme aortique, l’athérosclérose aortique avec tortuosité, et l’obstruction de l’orifice ou la tortuosité des artères lombaires. Dans notre cas, une explication potentielle des résultats faussement négatifs de l’ASD pourrait être que l’ASD n’était pas suffisamment approfondie ; ainsi, nous n’avons pas examiné l’influx au niveau sacré.
Les deux cas décrits ici ont montré que les SDAVF sacrés peuvent être difficiles à détecter dans les ASD et difficiles à occlure par embolisation endovasculaire. Des études précédentes présentées dans le tableau 1 ont également décrit des embolisations infructueuses dans le traitement des FVASD (4, 6, 8). Au total, il y a eu 5 tentatives infructueuses d’occlusion endovasculaire dans 3 des 6 cas rapportés (tableau 1). Ainsi, nous avons conclu qu’une approche chirurgicale pourrait être supérieure à l’embolisation endovasculaire, car la chirurgie offre un traitement en une seule étape.
Marques finales
La cooccurrence d’un SCT, d’un lipome et d’un SDAVF au niveau du sacrum est exceptionnellement rare. Les rapports précédents et nos résultats révèlent que la chirurgie pourrait être supérieure à l’embolisation endovasculaire pour traiter les SDAVF sacrés avec des entités coexistantes, car la chirurgie offre un traitement en une seule étape. Un nombre croissant de cas rapportés ont indiqué que les symptômes de ce triple trouble peuvent être causés uniquement par le SDAVF, et non par le SCT ou le lipome, qui sont clairement visibles en neuro-imagerie.
Consentement
Un consentement éclairé écrit a été obtenu des participants pour la publication de ce rapport de cas.
Contributions de l’auteur
PK a conçu le projet et l’a revu de manière critique. ŁP a préparé le manuscrit, collecté et examiné les données. PJ, MZ et MG ont recueilli les données des cas. BC a revu l’anatomie. AM a fait l’approbation finale de la version à publier.
Déclaration de conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière qui pourrait être interprétée comme un conflit d’intérêts potentiel.
1. Drake JM. Gestion chirurgicale de la moelle épinière attachée-walking the fine line. Neurosurg Focus. (2007) 23:E4. doi : 10.3171/FOC-07/08/E4
PubMed Abstract | CrossRef Full Text
2. McCutcheon IE, Doppman JL, Oldfield EH. Anatomie microvasculaire des anomalies artério-veineuses durales de la colonne vertébrale : une étude microangiographique. J Neurosurg. (1996) 84:215-20. doi : 10.3171/jns.1996.84.2.0215
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Gailloud P. Variante de fistule artérioveineuse durale rachidienne (SDAVF) avec double drainage périmédullaire et épidural. Eur Spine J. (2017). 27(Suppl 3):375-9. doi : 10.1007/s00586-017-5298-x
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Krisht KM, Karsy M, Ray WZ, Dailey AT. Extraspinal type I dural arteriovenous fistula with a lumbosacral lipomyelomeningocele : a case report and review of the literature. Case Rep Neurol Med. (2015) 2015:526321. doi : 10.1155/2015/526321
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Djindjian M, Ayache P, Brugieres P, Poirier J. Lipome sacré du filum terminale avec fistule artério-veineuse durale. Case report. J Neurosurg. (1989) 71(5 Pt 1):768-71. doi : 10.3171/jns.1989.71.5.0768
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Talenti G, Vitale G, Cester G, Della Puppa A, Faggin R, Causin F. Rare association between spinal dural arteriovenous fistulas and dysraphisms : report of two cases and review of the literature with a focus on pitfalls in diagnosis and treatment. Intervent Neuroradiol. (2017) 23:458-64. doi : 10.1177/1591019917714636
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Przepiórka Ł, Kunert P, Juszynńska P, Zawadzki M, Ciszek B, Głowacki M, et al. Coincidence d’une moelle attachée, d’un lipome du filum terminale et d’une fistule artérioveineuse durale sacrée : rapport de deux cas et revue de la littérature. Front Neurol. (2018) 9:807. doi : 10.3389/fneur.2018.00807
CrossRef Full Text | Google Scholar
8. Horiuchi Y, Iwanami A, Akiyama T, Hikata T, Watanabe K, Yagi M, et al. Fistule artério-veineuse spinale coexistant au sein d’un lipome spinal : rapport de deux cas. Spinal Cord Series Cases (2017) 3:17079. doi : 10.1038/s41394-017-0011-1
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Weon YC, Chung JI, Roh HG, Eoh W, Byun HS. Combined spifnal intramedullary arteriovenous malformation and lipomyelomeningocele. Neuroradiology (2005) 47:774-9. doi : 10.1007/s00234-005-1336-1
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Rice JF, Jelsma RK. Malformation artério-veineuse et lipome intramédullaire combinés : chirurgie et embolothérapie. Am J Neuroradiol. (1986) 7:171-3.
PubMed Abstract | Google Scholar
11. Asakuno K, Kim P, Kawamoto T, Ogino M. Dural arteriovenous fistula and progressive conus medullaris syndrome as complications of lumbar discectomy. Case report. J Neurosurg. (2002) 97(3 Suppl):375-9. doi : 10.3171/spi.2002.97.3.0375
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Kang JW, Koo JH, Kim DK, Joo YJ, Kim TH, Song SH. Myélopathie causée par une fistule artério-veineuse spinale durale après une première fracture du corps vertébral lombaire – un rapport de cas. Ann Rehabil Med. (2011) 35:729-32. doi : 10.5535/arm.2011.35.5.729
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Vankan Y, Demaerel P, Heye S, Van Calenbergh F, van Loon J, Maleux G, et al. Fistule artério-veineuse durale comme complication tardive d’une fracture de la colonne cervicale supérieure. Case report. J Neurosurg. (2004) 100(4 Suppl Spine):382-4. doi : 10.3171/spi.2004.100.4.0382
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Nishimura Y, Natsume A, Ginsberg HJ. Fistule artérioveineuse durale spinale associée à un spondylolisthésis isthmique L-4. J Neurosurg Spine (2014) 20:670-4. doi : 10.3171/2014.3.SPINE13492
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Khaldi A, Hacein-Bey L, Origitano TC. Spinal epidural arteriovenous fistula with late onset perimedullary venous hypertension after lumbar surgery : case report and discussion of the pathophysiology. Spine (2009) 34:E775-9. doi : 10.1097/BRS.0b013e3181ae4a52
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Jablawi F, Nikoubashman O, Mull M. Arterial Hypertension is associated with symptomatic spinal dural arteriovenous fistulas. World Neurosurg. (2017) 103:360-3. doi : 10.1016/j.wneu.2017.04.050
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Borden JA, Wu JK, Shucart WA. Une classification proposée pour les malformations fistuleuses artérioveineuses durales spinales et crâniennes et les implications pour le traitement. J Neurosurg. (1995) 82:166-79. doi : 10.3171/jns.1995.82.2.0166
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Lawton MT, Jacobowitz R, Spetzler RF. Rôle redéfini de l’angiogenèse dans la pathogenèse des malformations artérioveineuses durales. J Neurosurg. (1997) 87:267-74. doi : 10.3171/jns.1997.87.2.0267
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Wojciechowski J, Kunert P, Nowak A, Dziedzic T, Czernicki T, Wojtowicz K, et al. Traitement chirurgical des fistules artérioveineuses durales spinales : Outcome, complications and prognostic factors. Neurol Neurochir Pol. (2017). 51:446-53. doi : 10.1016/j.pjnns.2017.07.001
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Lucarelli E, Sangiorgi L, Benassi S, Donati D, Gobbi GA, Picci P, et al. Angiogenesis in lipoma : Une étude expérimentale dans la membrane chorioallantoïque de l’embryon de poulet. Int J Mol Med. (1999) 4:593-6. doi : 10.3892/ijmm.4.6.593
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Jellema K, Tijssen CC, Fijnheer R, de Groot PG, Koudstaal PJ, van Gijn J. Spinal dural arteriovenous fistulas are not associated with prothrombotic factors. Stroke (2004) 35:2069-71. doi : 10.1161/01.STR.0000135766.22285.dc
CrossRef Full Text | Google Scholar
22. Cools MJ, Al-Holou WN, Stetler WR Jr, Wilson TJ, Muraszko KM, Ibrahim M, et al. Filum terminale lipomas : imaging prevalence, natural history, and conus position. J Neurosurg Pediatr. (2014) 13:559-67. doi : 10.3171/2014.2.PEDS13528
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Al-Holou WN, Muraszko KM, Garton HJ, Buchman SR, Maher CO. Le résultat de la libération du cordon ombilical dans le syndrome du cordon ombilical secondaire et multiple répété. J Neurosurg Pediatr. (2009) 4:28-36. doi : 10.3171/2009.2.PEDS08339
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Gioppo A, Farago G, Giannitto C, Caputi L, Saladino A, Acerbi F, et al. Sacral dural arteriovenous fistulas : a diagnostic and therapeutic challenge – single-centre experience of 13 cases and review of the literature. J Neurointerv Surg. (2017). 10:415-21. doi : 10.1136/neurintsurg-2017-013307
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Oldfield EH, Bennett A 3rd Chen MY, Doppman JL. Gestion réussie des fistules artério-veineuses durales spinales non détectées par l’artériographie. Report of three cases. J Neurosurg. (2002) 96(2 Suppl):220-9. doi : 10.3171/spi.2002.96.2.0220
PubMed Abstract | CrossRef Full Text | Google Scholar