L’iode contenu dans les aliments est absorbé par l’organisme et se concentre préférentiellement dans la thyroïde où il est nécessaire au fonctionnement de cette glande. Lorsque le 131I est présent à des niveaux élevés dans l’environnement en raison des retombées radioactives, il peut être absorbé par les aliments contaminés et s’accumulera également dans la thyroïde. En se désintégrant, il peut causer des dommages à la thyroïde. Le principal risque lié à l’exposition au 131I est un risque accru de cancer radio-induit à un âge avancé. Les autres risques comprennent la possibilité de croissances non cancéreuses et de thyroïdite.
Le risque de cancer de la thyroïde à un âge avancé semble diminuer avec l’augmentation de l’âge au moment de l’exposition. La plupart des estimations du risque sont basées sur des études dans lesquelles les expositions aux rayonnements ont eu lieu chez des enfants ou des adolescents. Lorsque des adultes sont exposés, il a été difficile pour les épidémiologistes de détecter une différence statistiquement significative dans les taux de maladies thyroïdiennes par rapport à ceux d’un groupe similaire mais autrement non exposé.
Le risque peut être atténué par la prise de suppléments d’iode, augmentant la quantité totale d’iode dans le corps et, par conséquent, réduisant l’absorption et la rétention dans le visage et la poitrine et diminuant la proportion relative d’iode radioactif. Cependant, ces suppléments n’ont pas été systématiquement distribués à la population vivant le plus près de la centrale nucléaire de Tchernobyl après la catastrophe, bien qu’ils aient été largement distribués aux enfants en Pologne.
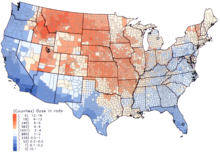
Aux États-Unis, les doses les plus élevées de retombées de 131I sont survenues dans les années 1950 et au début des années 1960 chez des enfants ayant consommé du lait frais provenant de sources contaminées à la suite d’essais en surface d’armes nucléaires. Le National Cancer Institute fournit des informations supplémentaires sur les effets sur la santé de l’exposition à l’131I présent dans les retombées, ainsi que des estimations individualisées, pour les personnes nées avant 1971, pour chacun des 3070 comtés des États-Unis. Les calculs sont tirés des données recueillies concernant les retombées des essais d’armes nucléaires effectués sur le site d’essai du Nevada.
Le 27 mars 2011, le département de la santé publique du Massachusetts a signalé que du 131I avait été détecté en très faibles concentrations dans l’eau de pluie provenant d’échantillons prélevés dans le Massachusetts, aux États-Unis, et que cela provenait probablement de la centrale de Fukushima. Les agriculteurs proches de la centrale ont déversé du lait cru, tandis que des tests aux États-Unis ont trouvé 0,8 pico-curies par litre d’iode-131 dans un échantillon de lait, mais les niveaux de rayonnement étaient 5 000 fois inférieurs au « niveau d’intervention défini » de la FDA.Les niveaux devaient baisser relativement rapidement
Traitement et préventionModifié
Une méthode de traitement courante pour prévenir l’exposition à l’iode-131 consiste à saturer la thyroïde avec de l’iode-127 régulier et non radioactif, sous forme d’iodure ou de sel d’iodate. L’iode élémentaire libre ne doit pas être utilisé pour saturer la thyroïde car il s’agit d’un oxydant corrosif dont l’ingestion en quantité nécessaire est toxique. La thyroïde n’absorbera que très peu d’iode-131 radioactif après avoir été saturée avec de l’iodure non radioactif, évitant ainsi les dommages causés par les radiations de l’iode radioactif.
Méthode de traitement couranteModifier
La méthode de traitement la plus courante consiste à donner de l’iodure de potassium aux personnes à risque. La posologie pour les adultes est de 130 mg d’iodure de potassium par jour, administré en une seule dose, ou divisé en portions de 65 mg deux fois par jour. Cela équivaut à 100 mg d’iode, soit environ 700 fois plus que la dose nutritionnelle d’iode, qui est de 0,150 mg par jour (150 microgrammes par jour). Voir iodure de potassium pour plus d’informations sur la prévention de l’absorption de l’iode radioactif par la thyroïde lors d’un accident nucléaire, ou pour des raisons de médecine nucléaire. Les doses d’iodure de potassium approuvées par la FDA à cette fin sont les suivantes : nourrissons de moins de 1 mois, 16 mg ; enfants de 1 mois à 3 ans, 32 mg ; enfants de 3 ans à 18 ans, 65 mg ; adultes 130 mg. Cependant, certaines sources recommandent d’autres schémas posologiques.
| Age | KI en mg | KIO3 en mg |
|---|---|---|
| Plus de 12 ans | 130 | 170 |
| 3-12 ans | 65 | 85 |
| 1-36 mois | 32 | 42 |
| <. Enfant de 1 mois | 16 | 21 |
L’ingestion d’iodure et d’iodate de prophylaxie n’est pas sans danger, Il y a lieu d’être prudent quant à la prise de suppléments d’iodure de potassium ou d’iode, car leur utilisation inutile peut provoquer des troubles tels que le phénomène de Jod-Basedow et l’effet Wolff-Chaikoff, déclencher et/ou aggraver respectivement l’hyperthyroïdie et l’hypothyroïdie, et finalement provoquer des troubles thyroïdiens temporaires ou même permanents. Il peut également provoquer une sialadénite (une inflammation de la glande salivaire), des troubles gastro-intestinaux, des réactions allergiques et des éruptions cutanées.
Plaquette d’iodeEdit
L’utilisation d’une « tablette d’iode » particulière utilisée dans la purification de l’eau portable a également été déterminée comme étant quelque peu efficace pour réduire l’absorption d’iode radioactif. Dans une petite étude sur des sujets humains qui, pour chacun de leur essai de 90 jours, ont ingéré quatre comprimés d’eau de 20 milligrammes d’hydroperiodure de tétraglycine (TGHP), chaque comprimé libérant 8 milligrammes (ppm) d’iode libre titrable ; on a constaté que l’absorption biologique d’iode radioactif chez ces sujets humains a chuté à et est restée à une valeur inférieure à 2 % du taux d’absorption d’iode radioactif de celui observé chez les sujets témoins qui ont été entièrement exposés à l’iode radioactif sans traitement.
GoitrogenEdit
L’administration de substances goitrogènes connues peut également être utilisée comme prophylaxie pour réduire la bio-absorption de l’iode, (qu’il s’agisse de l’iode nutritionnel non radioactif-127 ou de l’iode radioactif, le radio-iode – le plus souvent l’iode-131, car l’organisme ne peut pas discerner les différents isotopes de l’iode). Il a été démontré que les ions perchlorate, un contaminant de l’eau courant aux États-Unis en raison de l’industrie aérospatiale, réduisent l’absorption de l’iode et sont donc classés parmi les goitrogènes. Les ions perchlorate sont un inhibiteur compétitif du processus par lequel l’iodure est activement déposé dans les cellules folliculaires de la thyroïde. Des études portant sur des volontaires adultes en bonne santé ont déterminé qu’à des niveaux supérieurs à 0,007 milligramme par kilogramme et par jour (mg/(kg-d)), le perchlorate commence à inhiber temporairement la capacité de la glande thyroïde à absorber l’iode de la circulation sanguine (« inhibition de l’absorption de l’iodure », le perchlorate est donc un goitrogène connu). La réduction du pool d’iodure par le perchlorate a un double effet : réduction de la synthèse excessive d’hormones et hyperthyroïdie, d’une part, et réduction de la synthèse des inhibiteurs thyroïdiens et hypothyroïdie, d’autre part. Le perchlorate reste très utile comme application à dose unique dans les tests mesurant la décharge de radio-iode accumulée dans la thyroïde à la suite de nombreuses perturbations différentes du métabolisme ultérieur de l’iodure dans la glande thyroïde.
ThyrotoxicoseModifier
Le traitement de la thyrotoxicose (y compris la maladie de Basedow) avec 600-2 000 mg de perchlorate de potassium (430-1 400 mg de perchlorate) par jour pendant des périodes de plusieurs mois ou plus était autrefois une pratique courante, en particulier en Europe, et l’utilisation du perchlorate à des doses plus faibles pour traiter les problèmes thyroïdiens se poursuit à ce jour. Bien que 400 mg de perchlorate de potassium divisés en quatre ou cinq doses quotidiennes aient été utilisés initialement et trouvés efficaces, des doses plus élevées ont été introduites lorsqu’on a découvert que 400 mg/jour ne contrôlait pas la thyrotoxicose chez tous les sujets.
Les régimes actuels de traitement de la thyrotoxicose (y compris la maladie de Graves), lorsqu’un patient est exposé à des sources supplémentaires d’iode, comprennent généralement 500 mg de perchlorate de potassium deux fois par jour pendant 18 à 40 jours.
La prophylaxie avec de l’eau contenant du perchlorate à des concentrations de 17 ppm, ce qui correspond à un apport personnel de 0,5 mg/kg-jour, si l’on pèse 70 kg et que l’on consomme deux litres d’eau par jour, s’est avérée réduire de 67 % l’absorption d’iode radioactif de base Cela équivaut à l’ingestion d’un total de seulement 35 mg d’ions perchlorate par jour. Dans une autre étude connexe où les sujets buvaient seulement 1 litre d’eau contenant du perchlorate par jour à une concentration de 10 ppm, c’est-à-dire que 10 mg quotidiens d’ions perchlorate étaient ingérés, une réduction moyenne de 38% de l’absorption d’iode a été observée.
Cependant, lorsque l’absorption moyenne de perchlorate chez les travailleurs des usines de perchlorate soumis à la plus forte exposition a été estimée à environ 0,5 mg/kg-jour, comme dans le paragraphe ci-dessus, une réduction de 67% de l’absorption d’iode serait attendue. Les études sur les travailleurs exposés de façon chronique n’ont cependant pas permis jusqu’à présent de détecter d’anomalies de la fonction thyroïdienne, y compris de l’absorption d’iode. Cela pourrait bien être attribuable à une exposition quotidienne suffisante ou à l’absorption d’iode-127 sain chez les travailleurs et à la courte demi-vie biologique de 8 heures du perchlorate dans l’organisme.
Absorption de l’iode-131Modification
Bloquer complètement l’absorption de l’iode-131 par l’ajout volontaire d’ions perchlorate dans l’approvisionnement en eau d’une population, en visant des doses de 0,5 mg/kg-jour, soit une concentration dans l’eau de 17 ppm, serait donc largement insuffisant pour réduire réellement l’absorption d’iode radioactif. Les concentrations d’ions perchlorate dans l’approvisionnement en eau d’une région devraient donc être beaucoup plus élevées, avec une dose totale d’au moins 7,15 mg/kg de poids corporel par jour, ce qui est réalisable pour la plupart des adultes en consommant 2 litres d’eau par jour avec une concentration d’eau de 250 mg/kg d’eau, ou 250 ppm d’ions perchlorate par litre ; ce n’est qu’à ce niveau que la consommation de perchlorate offrirait une protection adéquate et serait vraiment bénéfique à la population pour prévenir la bioaccumulation lorsqu’elle est exposée à un environnement d’iode radioactif. Ceci étant entièrement indépendant de la disponibilité des médicaments à base d’iodate ou d’iodure.
L’ajout continu de perchlorate à l’approvisionnement en eau devrait se poursuivre pendant pas moins de 80-90 jours, en commençant immédiatement après la détection de la libération initiale d’iode radioactif ; après 80-90 jours, l’iode-131 radioactif libéré se sera désintégré à moins de 0.1% de sa quantité initiale, et donc le danger de la bioprécipitation de l’iode-131 est essentiellement terminé.
Rejet d’iode radioactifEdit
En cas de rejet d’iode radioactif, l’ingestion d’iodure ou d’iodate de potassium en prophylaxie, s’il est disponible, aurait à juste titre la priorité sur l’administration de perchlorate, et serait la première ligne de défense pour protéger la population d’un rejet d’iode radioactif. Cependant, dans le cas d’un rejet d’iode radioactif trop massif et trop étendu pour être contrôlé par le stock limité de médicaments prophylactiques à base d’iodure & iodate, alors l’ajout d’ions perchlorate à l’approvisionnement en eau, ou la distribution de comprimés de perchlorate, servirait de deuxième ligne de défense bon marché et efficace contre la bioaccumulation d’iode radioactif cancérigène.
L’ingestion de médicaments goitrogènes n’est, un peu comme l’iodure de potassium, pas non plus sans danger, comme l’hypothyroïdie. Dans tous ces cas cependant, malgré les risques, les avantages prophylactiques d’une intervention avec de l’iodure, de l’iodate ou du perchlorate l’emportent sur le grave risque de cancer lié à la bioaccumulation de l’iode radioactif dans les régions où l’iode radioactif a suffisamment contaminé l’environnement.