Lors de la réunion de l’Académie américaine d’ophtalmologie de 2013, j’ai participé à un débat concernant les avantages et les inconvénients de l’utilisation de médicaments génériques par rapport aux médicaments de marque. On m’a demandé de plaider en faveur des médicaments de marque, mais comme dans la plupart des débats, c’est une simplification excessive que de prendre aveuglément un côté ou l’autre. La réalité est plus complexe. Les génériques ont un coût en leur faveur, mais ils ne fournissent parfois pas les mêmes spécifications de traitement ou les mêmes résultats que les médicaments de marque, malgré les efforts de la Food and Drug Administration pour s’en assurer.
J’aimerais ici parler de certaines des façons dont les génériques peuvent différer des médicaments de marque qu’ils remplacent, et de ce à quoi les cliniciens doivent être attentifs.
La question de la bioéquivalence
Les obstacles à franchir pour mettre un nouveau médicament « innovateur » sur le marché sont sensiblement différents de ceux d’un médicament générique de suivi. Bien sûr, c’est en partie la raison pour laquelle un médicament de marque coûte plus cher. Alors que le médicament innovant initial doit prouver son innocuité et son efficacité par le biais d’essais cliniques, un générique doit seulement démontrer sa bioéquivalence.
Bien que la bioéquivalence semble impliquer la réalisation d’études biologiques, la FDA la définit comme signifiant que vous devez démontrer que les ingrédients de votre version générique sont une copie exacte des ingrédients du médicament original, y compris les ingrédients actifs et les excipients. (Si les ingrédients actifs et les excipients ne sont pas identiques, le médicament n’est pas considéré comme un générique ; il doit passer par l’approbation régulière de la FDA comme tout nouveau médicament). La prémisse est que le générique aura ainsi la même sécurité et la même efficacité que le médicament de marque.
Malheureusement, l’idée que les génériques sont égaux aux médicaments de marque parce que les ingrédients sont les mêmes n’est pas nécessairement vraie. De nombreux facteurs qui affectent l’efficacité d’un médicament topique sont indépendants des ingrédients contenus dans le flacon. Par exemple :
– Le matériau du flacon est important. Les ingrédients de nombreux médicaments de marque sont adaptés au matériau du flacon utilisé. C’était certainement le cas avec le latanoprost, où la compatibilité avec le matériau du flacon était une grande partie du processus de recherche et de développement lors de la mise sur le marché du Xalatan. Ce n’est pas quelque chose qui est directement étudié par la FDA.
– La forme et la taille du flacon affectent l’utilisation. Les essais de médicaments innovants testent non seulement le médicament mais aussi le flacon dans lequel il sera délivré aux patients, l’impact de la forme et de la taille du flacon a donc été pris en compte. Cependant, les fabricants de médicaments génériques ne sont pas tenus de copier la forme et la taille du flacon, et cela peut faire une différence dans la facilité avec laquelle les patients peuvent utiliser le médicament.
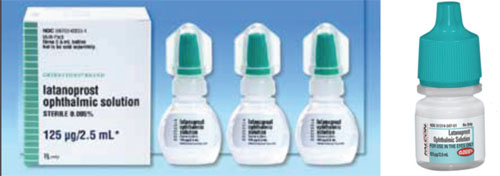
Un problème qui peut causer de la confusion lors du passage d’un médicament de marque à un générique, ou d’un générique à un autre, est la différence de forme et de couleur du bouchon.
Par exemple, le Xalatan se présente dans un petit flacon plat qui demande un certain effort et une certaine finesse pour le presser afin d’instiller une goutte. En revanche, certains des flacons génériques de latanoprost sont ronds et plus rigides, ce qui rend le flacon plus difficile à presser pour le patient. (Voir les exemples sur la page suivante.) Beaucoup de nos patients sont âgés et ont des limitations physiques. S’ils ont l’habitude de presser un flacon plat et légèrement moins rigide, et qu’ils passent ensuite à un flacon rond et plus rigide, le processus d’application – et leur adhésion au médicament – peut être différent de ce qu’il était lorsqu’ils utilisaient le flacon précédent. En outre, comme la forme et la taille des flacons sont choisies par chaque fabricant de génériques, les patients peuvent parfois recevoir le médicament dans un flacon plat et d’autres fois dans un flacon rond. Cela a créé beaucoup de confusion chez nos patients.
– La couleur du bouchon ne correspond pas toujours. Les couleurs des bouchons des flacons de médicaments ophtalmiques sont destinées à être coordonnées en fonction de la catégorie de médicament. La FDA essaie de s’assurer que la couleur est correcte, mais il y a eu des cas où un bouchon de couleur différente s’est glissé. Par conséquent, il arrive que la couleur du bouchon du médicament générique (ainsi que sa forme et sa taille) soit différente de celle du médicament de marque (voir exemple ci-dessus). Cela crée beaucoup de confusion lorsque les patients essaient de se rappeler lesquelles de plusieurs gouttes ils sont censés prendre à quel moment.
Même si un patient n’a jamais utilisé le médicament de marque avec la bonne couleur de bouchon, une couleur altérée reste un problème ; la nouvelle couleur de bouchon peut en fait être de la même couleur qu’un autre médicament que le patient prend. Par exemple, les flacons d’analogues de prostaglandine sont censés avoir un bouchon de couleur sarcelle. Si votre patient utilise une version générique dont le flacon a un bouchon blanc, il pourrait le confondre avec d’autres classes de médicaments qui sont censés avoir un bouchon blanc.
Si vous remarquez un exemple de couleur de bouchon incorrecte, la FDA a dit qu’elle aimerait en être informée afin que des mesures puissent être prises pour corriger la divergence.
– La taille des gouttes peut être différente. Les flacons de gouttes topiques sur le marché actuellement fournissent une dose de 30 à 50 µl par goutte. Malheureusement, il peut y avoir beaucoup de variabilité entre les formulations de marque et les formulations génériques, simplement parce que l’embout peut avoir un trou plus ou moins grand. Évidemment, cela peut affecter la quantité de médicament qui arrive effectivement dans l’œil ; elle peut être moindre, elle peut être plus importante.
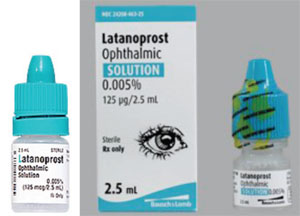
Un autre problème concerne les différences de forme et de rigidité des flacons, qui peuvent rendre l’application des gouttes plus difficile pour un patient âgé. Par exemple, le xalatan est présenté dans un flacon plat ; de nombreux génériques du médicament sont présentés dans des flacons ronds, plus difficiles à presser.
Plus intéressant encore, il y avait un timolol générique qui est arrivé sur le marché et qui n’avait pas du tout de trou dans l’embout ; le patient devait percer l’embout pour faire sortir le médicament, comme pour un tube de superglue. Cela a créé une confusion chez de nombreux patients ; certains n’ont pas réalisé qu’ils étaient censés faire cela, et ont essayé d’utiliser les gouttes quand même. Ils pensaient qu’ils mettaient une goutte, mais ils n’avaient jamais ouvert le flacon et rien ne sortait. D’autres ont pensé que le flacon était défectueux ou vide. De plus, un trou fait par soi-même pouvait finir par être de n’importe quelle taille, affectant la dose, et le processus de fabrication du trou pouvait facilement compromettre la stérilité du contenu.
Toutes ces considérations – matériau, forme et taille du flacon, couleur du bouchon et diamètre de l’ouverture de la goutte – sont très importantes pour le médecin et le patient. Malheureusement, ces considérations peuvent être négligées, car on cherche avant tout à prouver la bioéquivalence.
– Le médicament générique d’un patient peut avoir une apparence différente d’un mois à l’autre. C’est un autre effet secondaire malheureux des médicaments génériques. Il se produit parce qu’il peut y avoir plusieurs fabricants d’un générique donné, chacun ayant un flacon différent. Par exemple, il existe actuellement six à huit fabricants différents de latanoprost générique sur le marché américain. Celui qu’une pharmacie donnée vend peut changer, car une chaîne telle que CVS, Walgreens ou Walmart choisira généralement le fabricant qui offre la meilleure offre au groupe de pharmacies à un moment donné. Par conséquent, une pharmacie peut changer le générique qu’elle propose lorsqu’une offre plus basse est faite par un autre fabricant de génériques. Ainsi, même si le patient se rend dans la même pharmacie, il peut se retrouver avec différentes versions génériques d’un médicament à différents moments. Cela peut prêter à confusion si les flacons ont une apparence et/ou un comportement différents. (Il pourrait même y avoir une différence de tolérance et de contrôle de la PIO entre les deux.)
La notice
Ironiquement, même si un médicament générique s’avère avoir un problème, les règles actuelles empêchent les fabricants d’alerter les médecins ou les patients. Il existe une règle qui oblige les fabricants de médicaments génériques à inclure une copie exacte de la notice qui accompagne le médicament innovateur. Alors que cette règle visait à refléter l’idée que les médicaments sont bioéquivalents, l’effet secondaire involontaire a été d’éviter d’imposer aux fabricants de médicaments génériques les mêmes exigences de diligence et le même fardeau d’assurer la sécurité que nous exigeons des fabricants de médicaments de marque.
Génériques importés
Un autre problème avec les génériques est que beaucoup d’entre eux sont fabriqués en dehors des États-Unis, où le contrôle de la qualité a parfois été une véritable préoccupation. Les problèmes sont allés de la découverte d’impuretés mystérieuses dans les médicaments, à la correspondance imparfaite des ingrédients, en passant par des formulations carrément frauduleuses qui ne servent aucun objectif bénéfique (ce qui peut dans certains cas entraîner un préjudice grave pour les patients).
La réalité est que les génériques ne sont pas nécessairement les mêmes que les médicaments de marque – même s’ils ont satisfait à l’exigence de bioéquivalence de la FDA. Cela signifie que lorsqu’on utilise des médicaments génériques, la charge d’assurer la sécurité et l’efficacité repose sur nous et nos patients.
Selon le New York Times, l’industrie pharmaceutique indienne fournit actuellement 40 % des médicaments en vente libre et des médicaments génériques sur ordonnance consommés aux États-Unis. Nombre de ses usines sont de classe mondiale et « pratiquement impossibles à distinguer » des installations de fabrication américaines (selon le Times), produisant des médicaments fiables et de haute qualité. Mais en même temps, l’Organisation mondiale de la santé a estimé qu’un médicament sur cinq fabriqué en Inde est un faux. (Des problèmes similaires ont été signalés avec des médicaments fabriqués dans d’autres pays, notamment en Chine.)
Notre groupe a réalisé il y a quelques années une étude comparant le latanoprost fabriqué en Inde au Xalatan. Nous avons constaté que la stabilité des principes actifs n’était pas la même dans le temps ou lorsqu’ils étaient soumis à la chaleur. En outre, nous avons trouvé des contaminants dans toutes les bouteilles importées, y compris des filaments microscopiques ressemblant à de la ficelle, et ce que nous avons surnommé des « ovnis ».
Le point est que la surveillance des pratiques de fabrication qui se produisent à l’étranger dans les entreprises non basées aux États-Unis, en particulier les entreprises qui n’ont pas de médicaments de marque sur le marché, n’est tout simplement pas la même.
Certains médecins peuvent supposer que ces médicaments importés ne sont un problème que lorsque les patients achètent des médicaments hors des États-Unis via Internet afin d’économiser de l’argent, mais la réalité est que ces importations sont de plus en plus disponibles ici. Les formulations indiennes du timolol et du travoprost sont actuellement disponibles auprès de distributeurs basés aux États-Unis, et d’autres médicaments tels que les AINS le seront bientôt. De toute évidence, de nombreuses sociétés hors des États-Unis produisent des génériques de haute qualité ; le problème est que quelques-unes d’entre elles ne le font pas. Il incombe donc aux médecins et aux patients de s’assurer qu’un générique donné est sûr et efficace. (Au moins, les médicaments disponibles à l’intérieur des États-Unis sont passés par le processus de bioéquivalence de la FDA ; les médicaments que certains patients achètent à l’extérieur du pays via Internet ne l’ont peut-être pas fait, ce qui les rend encore plus suspects.)
Stratégies cliniques
En raison de toutes les variables dont nous avons discuté, les médecins doivent rester très attentifs à ce qui se passe avec les patients lorsqu’ils passent d’un médicament de marque à un générique, ou d’un générique à un autre. Nous devons être vigilants pour nous assurer que le contrôle de la pression intraoculaire ne vacille pas et que les patients ne présentent pas de nouveaux signes et symptômes d’intolérance au médicament.
Voici quelques mesures que vous pouvez prendre pour protéger vos patients (et votre cabinet) :
– Demandez aux patients d’apporter leurs gouttes. Je demande à mes patients de le faire, quels que soient les médicaments qu’ils utilisent, et beaucoup d’entre eux le font. Cela me donne l’occasion de noter quel fabricant de génériques ils utilisent et de faire de mon mieux pour garder un œil dessus, de sorte que si un problème survient ou si quelque chose change, je peux rechercher un lien possible.
– Demandez aux patients qui passent à un nouveau générique de revenir à la clinique plus tôt que vous ne le feriez autrement. Cela vous permettra de vous assurer qu’aucune conséquence fâcheuse ne se produit. Restez attentif aux changements d’efficacité ou aux nouveaux signes ou symptômes.
– Si vous constatez des problèmes lorsqu’un patient passe à un générique, alertez la FDA. N’oubliez pas que cette situation fait peser sur le médecin la charge de s’assurer que le médicament générique est vraiment sûr et efficace.
– Si un patient ne se porte pas aussi bien avec un générique, faites l’effort de faire en sorte que l’assureur couvre le médicament de marque. J’ai été confronté à des patients qui toléraient bien le médicament de marque mais avaient du mal à tolérer un générique en raison d’effets secondaires tels que des rougeurs ou des irritations. Dans ces cas-là, nous écrivons à la compagnie d’assurance et faisons tout ce que nous pouvons pour que le patient revienne à la formulation de marque.
Par exemple, un médicament de marque peut contenir un conservateur spécifique, alors que la formulation générique contient un conservateur alternatif auquel le patient est sensible. Travatan Z est un médicament de marque fabriqué par Alcon qui contient le conservateur SofZia au lieu du chlorure de benzalkonium ; les versions génériques contiennent du BAK parce que leur bioéquivalence était basée sur l’ancienne version du travoprost. Si une pharmacie fait passer un patient allergique au BAK au médicament générique, cela devient un problème.
Malheureusement, voyant des milliers de patients par an dans notre cabinet, il est vraiment difficile de s’assurer de gagner la bataille pour chaque patient qui se retrouve dans cette situation. Cependant, nous faisons l’effort.
Le fardeau est sur nous
Les génériques sont là pour rester, et ils sont en train de devenir une partie importante du traitement de toutes les maladies, pas seulement en ophtalmologie. Ils sont généralement sûrs et efficaces, et peuvent permettre de réaliser des économies, tant pour les patients que pour le système de santé en général. Ne vous méprenez pas, je suis un grand partisan de la réduction des coûts. Si nous pouvons trouver un moyen sûr de réduire les coûts tout en maintenant d’excellents soins, je suis tout à fait d’accord. C’est la deuxième partie de cette équation que nous devons surveiller.
J’utilise moi-même des médicaments génériques tous les jours, et l’écrasante majorité de mes patients en prennent maintenant. Ils se portent presque tous très bien, avec un bon contrôle de la PIO et une bonne tolérance aux médicaments. Je ne dis donc certainement pas qu’il faut éviter d’utiliser des génériques. Cependant, la réalité est que les génériques ne sont pas nécessairement les mêmes que les médicaments de marque, même s’ils ont satisfait aux exigences de bioéquivalence de la FDA. Cela signifie que lorsqu’on utilise des médicaments génériques, la charge d’assurer la sécurité et l’efficacité repose sur nous et nos patients. REVUE
Le Dr Kahook est titulaire de la chaire dotée de la famille Slater en ophtalmologie et vice-président de la recherche clinique et translationnelle à la faculté de médecine de l’Université du Colorado à Denver. Il est consultant et reçoit un soutien à la recherche d’Allergan et d’Alcon.