Voltaikus (galván) elemek
A galvánelem alapelveinek szemléltetésére tekintsük a fémes cink reakcióját a rézionnal (Cu2+) rézfém és Zn2+ ion keletkezésével. A kiegyensúlyozott kémiai egyenlet a következő:
\
Ezt a reakciót úgy idézhetjük elő, hogy egy cinkrudat réz(II)szulfát vizes oldatába helyezünk. A reakció előrehaladtával a cinkrúd feloldódik, és fémes réztömeg képződik. Ezek a változások spontán módon mennek végbe, de a felszabaduló energia hő formájában jelentkezik, nem pedig olyan formában, amelyet munkára lehetne használni.
Ez a reakció a \(\PageIndex{3a}\) ábrán látható galvánelem segítségével is elvégezhető. A cella összeállításához egy rézcsíkot helyezünk egy 1 M Cu2+ ion oldatot tartalmazó főzőpohárba, és egy cinkcsíkot egy másik főzőpohárba, amely 1 M Zn2+ ion oldatot tartalmaz. A két fémcsíkot, amelyek elektródaként szolgálnak, egy drót köti össze, a rekeszeket pedig egy sóhíd köti össze, egy U alakú cső, amelyet mindkét oldatba helyeznek, és amely koncentrált folyékony vagy zselés elektrolitot tartalmaz. A sóhídban lévő ionokat úgy választják ki, hogy ne zavarják az elektrokémiai reakciót azáltal, hogy maguk is oxidálódnak vagy redukálódnak, vagy csapadékot vagy komplexet képeznek; az általánosan használt kationok és anionok a Na+ vagy K+, illetve az NO3- vagy SO42-. (A sóhídban lévő ionoknak nem kell azonosnak lenniük a redoxpárban lévő ionokkal egyik rekeszben sem). Amikor az áramkört bezárjuk, spontán reakció megy végbe: a cinkfém a cinkelektródon (az anódon) Zn2+ ionokká oxidálódik, a Cu2+ ionok pedig a rézelektródon (a katódon) Cu fémmé redukálódnak. A reakció előrehaladtával a cinkcsík feloldódik, és a Zn2+ -ionok koncentrációja a Zn2+ -oldatban nő; ezzel egyidejűleg a rézcsík tömeget nyer, és a Cu2+ -ionok koncentrációja a Cu2+ -oldatban csökken (\(\(\PageIndex{3b}\) ábra). Tehát ugyanazt a reakciót hajtottuk végre, mint egyetlen főzőpohárral, de ezúttal az oxidatív és reduktív félreakciókat fizikailag elválasztottuk egymástól. Az anódon felszabaduló elektronok a dróton keresztül áramlanak, elektromos áramot termelve. A galvánelemek tehát a kémiai energiát elektromos energiává alakítják át, amely aztán munkára használható.
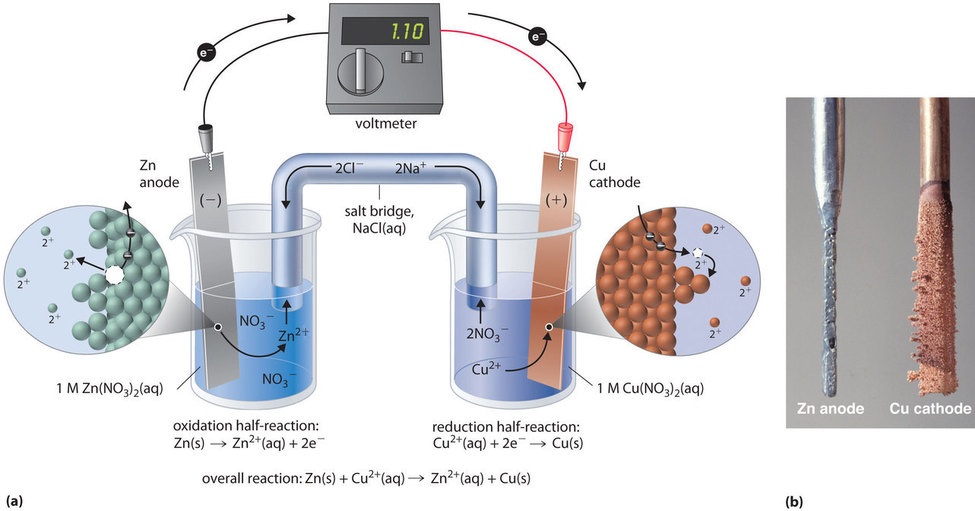
A sóhídban lévő elektrolit két célt szolgál: az elektromos töltés hordozásával kiegészíti az áramkört, és fenntartja az elektromos semlegességet mindkét oldatban, mivel lehetővé teszi az ionok vándorlását közöttük. A sóhídban lévő só azonossága mindaddig lényegtelen, amíg az alkotó ionok nem lépnek reakcióba, illetve nem mennek át redoxireakción a cella működési körülményei között. Ilyen kapcsolat nélkül a Zn2+ oldat teljes pozitív töltése növekedne a cinkfém oldódásával, a Cu2+ oldat teljes pozitív töltése pedig csökkenne. A sóhíd lehetővé teszi a töltések semlegesítését azáltal, hogy az anionok a Zn2+ oldatba, a kationok pedig a Cu2+ oldatba áramlanak. Sóhíd vagy más hasonló kapcsolat hiányában a reakció gyorsan leállna, mert az elektromos semlegességet nem lehetne fenntartani.
Voltmérővel mérhető a két tér közötti elektromos potenciálkülönbség. Az anódhoz és a katódhoz vezető vezetékeket összekötő kapcsoló kinyitása megakadályozza, hogy áram folyjon, így nem következik be kémiai reakció. Ha azonban a kapcsoló zárva van, a külső áramkör zárva van, és elektromos áram folyhat az anódtól a katódig. A cella potenciálja (\(E_cell}\)), amelyet voltban mérünk, a két félreakció közötti elektromos potenciálkülönbség, és az elektromos térben egy töltött részecske mozgatásához szükséges energiával függ össze. Az általunk leírt cellában a feszültségmérő 1,10 V potenciált mutat (\(\(\PageIndex{3a}\) ábra). Mivel az oxidációs félreakcióból származó elektronok az anódon szabadulnak fel, a galvánelem anódja negatív töltésű. Az elektronokat vonzó katód pozitív töltésű.
A redoxireakció során nem minden elektródon megy végbe kémiai átalakulás. Az elektród készülhet inert, nagy vezetőképességű fémből, például platinából, hogy megakadályozza a redoxi folyamat során bekövetkező reakciót, ahol nem jelenik meg a teljes elektrokémiai reakcióban. Ezt a jelenséget a \(\PageIndex{1}\) példa szemlélteti.
A galván (voltaikus) cella a spontán kémiai reakcióban felszabaduló energiát elektromos energiává alakítja. Az elektrolitikus cella külső forrásból származó elektromos energiát használ fel egy nem spontán kémiai reakció meghajtására.
Példa \(\PageIndex{1}\)
A vegyész két főzőpohárból álló galváncellát épített. Az egyik főzőpohárban egy vizes kénsavba merített óncsík, a másikban pedig egy vizes salétromsavba merített platinaelektród van. A két oldatot sóhíd köti össze, az elektródákat pedig egy drót köti össze. Áram kezd folyni, és a platinaelektródon gázbuborékok jelennek meg. A bekövetkező spontán redoxireakciót a következő kiegyensúlyozott kémiai egyenlet írja le:
\
Ezért a galvánelemért,
- írja le az egyes elektródokon lejátszódó félreakciót.
- mutassa meg, melyik elektród a katód és melyik az anód.
- mutassa meg, melyik elektróda a pozitív és melyik a negatív elektróda.
Adott: galvánelem és redoxireakció
Kérdések: félreakciók, az anód és katód azonossága, az elektródok hozzárendelése pozitívnak vagy negatívnak
Stratégia:
- azonosítsa az oxidációs félreakciót és a redukciós félreakciót. Ezután az egyes elektródokon lejátszódó félreakciók alapján azonosítsa az anódot és a katódot.
- Az elektronáramlás iránya alapján rendelje az egyes elektródokat pozitív vagy negatív elektródnak.
Solution
A redukciós félreakcióban a nitrát nitrogén-oxiddá redukálódik. (A nitrogén-oxid ezután a levegő oxigénjével reakcióba lépve NO2-t képezne, amelynek jellegzetes vörös-barna színe van). Az oxidációs félreakcióban a fémes ón oxidálódik. A rendszerben ténylegesen lejátszódó reakcióknak megfelelő félreakciók a következők:
redukció: \
oxidáció: \
A nitrát tehát NO-ra redukálódik, míg az ónelektród Sn2+ -ra oxidálódik.
Mivel a redukciós reakció a Pt-elektródon megy végbe, az a katód. Ezzel szemben az oxidációs reakció az ónelektródon megy végbe, ezért az az anód.
B Az elektronok az ónelektródról a dróton keresztül a platinaelektródra áramlanak, ahol átmennek a nitrátra. Az elektromos áramkört a sóhíd zárja le, amely lehetővé teszi a kationok diffúzióját a katód felé és az anionokét az anód felé. Mivel az elektronok az ónelektródról áramlanak, annak elektromosan negatívnak kell lennie. Ezzel szemben az elektronok a Pt-elektród felé áramlanak, ezért ennek az elektródnak elektromosan pozitívnak kell lennie.
GYakorlat \(\PageIndex{1}\)
Fogalmazzunk meg egy egyszerű galvánelemet, amely két, sóhíddal összekötött főzőpohárból áll. Az egyik főzőpohár \(\ce{MnO_4^{-}}\) oldatát tartalmazza híg kénsavban, és egy Pt elektróda van rajta. A másik főzőpohár \(\ce{Sn^{2+}}}\) oldatát tartalmazza híg kénsavban, szintén Pt elektróddal. Amikor a két elektródát egy dróttal összekötjük, áram folyik, és spontán reakció megy végbe, amelyet a következő kiegyensúlyozott kémiai egyenlet ír le:
\
Ezért a galvánelemért,
- írjuk le az egyes elektródokon lejátszódó félreakciót.
- mutassa meg, melyik elektróda a katód és melyik az anód.
- mutassa meg, melyik elektróda a pozitív és melyik a negatív.
Válasz a
\ \ce{Sn^{2+}(aq)} &→ \ce{Sn^{4+}(aq) + 2e^{-}} \end{align*}\]
Válasz b
A permanganátoldatban lévő Pt-elektród a katód, az ónoldatban lévő az anód.
Válasz c
A katód (a permanganátoldatot tartalmazó pohárban lévő elektród) pozitív, az anód (az ónoldatot tartalmazó pohárban lévő elektród) negatív.