糖尿病には費用がかかるが、そのほとんどは合併症と病院での治療に起因している1。 米国糖尿病協会(ADA)によると、2012年の糖尿病の推定総費用は2450億ドルでした。1 そのうち43%は入院患者の病院費用、さらに18%は糖尿病の合併症を管理するための処方箋によるものと推定されています1
これらの合併症の大部分は、目標とする血糖コントロールによって予防することが可能です。 疫学的データでは、ヘモグロビンA1c(HbA1c)が1%低下するごとに、微小血管合併症のリスクが35%低下することが示されています2。糖尿病の合併症率が低下していることは良いニュースですが3、合併症が進行する糖尿病患者の数が非常に増えていることが、これを上回っています
2型糖尿病の多くの人は、診断時点で糖尿病に関連した合併症を発症している可能性があります。 1型糖尿病、2型糖尿病ともに、網膜症や腎症などの合併症の中には、沈黙を守っているものもあります。 そのため、症状を待っていては手遅れになるため、積極的なターゲットアプローチが必要です。 糖尿病性神経障害でさえ、測定可能な異常があっても、最大で50%の人は無症状です4。
この記事では、微小血管合併症に関するADA 2017 Standards of Careからの推奨事項と関連するポジションステートメントをレビューし、糖尿病患者を治療するプライマリケア医のための予防スクリーニングと臨床パールを紹介します。
糖尿病網膜症
糖尿病網膜症は1型および2型糖尿病の共通の微小血管合併症であり、糖尿病網膜症は、糖尿病患者における糖尿病網膜症の予防と治療に重要な役割を果たします。 5 糖尿病網膜症は、20~74 歳の成人において、新たに発症する失明の最も多い原因となっています。6 血糖コントロール、血圧コントロール、罹病期間との強い相関が確認されています。 糖尿病の罹病期間は、糖尿病網膜症進行の最大の危険因子であり、早期かつ定期的なスクリーニングとこれらの危険因子のコントロールにより、糖尿病網膜症の発見と視覚障害予防のための治療が可能となります。 1型糖尿病では、最初の3~5年または思春期前には網膜症はほとんどみられません。7 その後20年間で、1型糖尿病患者のほぼ全員が糖尿病性網膜症を発症します。7 2型糖尿病患者では、診断時に21%もの患者がある程度の網膜症を有しているといわれています。 8 アルブミン尿のある患者(推定糸球体濾過量のレベルにかかわらず)の最大50%が網膜症を発症します9。 網膜症のステージと説明
Stage
Description
Mild Non-
微小動脈瘤あり
中等度非増殖性糖尿病網膜症
微小動脈瘤あること。 網膜点状出血や網膜滲出液、硬い滲出液。 または綿毛斑が存在する場合がある
重度の非増殖糖尿病網膜症
網膜内出血、静脈ビーディングがある。 または網膜内微小血管異常が存在する場合がある
増殖糖尿病網膜症
新生血管、硝子体または網膜前出血がある
病態生理学的。 血管透過性の亢進を特徴とする軽度の非増殖性異常は、中等度から重度の非増殖性糖尿病網膜症(NPDR)に進行します。7 増殖性糖尿病網膜症は、新しい網膜血管の増殖によって特徴付けられます。 滲出液や浮腫を伴う網膜中心部の肥厚である黄斑浮腫は、網膜症のどの段階でも認められます。7
糖尿病網膜症の予防 妊娠、思春期、血糖コントロール不足、高血圧、白内障手術により糖尿病網膜症は加速します。 糖尿病性網膜症の予防には、血糖コントロールが重要である。 Diabetes Control and Complications Trial(DCCT)では、厳格な血糖コントロールとベースラインの網膜症なしまたは最小から中等度のNPDRへの進行の効果が評価された。10 ベースラインで網膜症のない集中治療群の患者では、網膜症の平均リスクは36ヵ月間で76%減少した。 10 最初のAction to Control Cardiovascular Risk in Diabetes(ACCORD)試験では、10年間2型糖尿病を患っており、心血管疾患が判明している参加者を、血糖値、収縮期血圧、脂質異常の集中治療群と標準治療群に無作為に割り付けました。 4年後、現在のHbA1c値が同程度であっても、血糖値を集中的にコントロールした群では網膜症の進行が抑制された。11
スクリーニング。 黄斑浮腫や増殖糖尿病網膜症は無症状の場合もあるため、早期発見・早期治療にはスクリーニングが欠かせない。 1型糖尿病患者については、診断から5年後にスクリーニングを開始すべきである8。2型糖尿病患者については、診断時にスクリーニングを開始すべきである8。スクリーニングは、糖尿病網膜症の経験が豊富な眼科医または検眼士が行うべきである。 スクリーニングは、眼球を拡張して行う必要があります。 8
妊娠中は増殖性網膜症のリスクが高い時期であるため、妊娠中に網膜症を発症した場合は、眼科医に紹介することが推奨される。 1型または2型糖尿病の既往がある妊婦では、妊娠前または妊娠第1期に眼科検診を実施する必要がある。 妊娠糖尿病患者については、出産後に眼科検診を追加する必要はない。 妊娠中または妊娠を計画している糖尿病患者には、妊娠前に糖尿病網膜症の発症・進展のリスクと血糖コントロールの必要性について助言する必要がある。 しかし、すでに網膜症が存在する場合は、集中的な血糖管理を迅速に実施することにより、網膜症の早期悪化が起こる可能性がある。8
治療 妊娠糖尿病は、妊娠中の糖尿病網膜症の発症リスクを同様に与えるとは考えられない。 血糖コントロールに加え、血圧コントロール(収縮期血圧<5526>140mmHg)も糖尿病網膜症の進行を抑えることが示されているが、収縮期血圧<5526>120mmHgの厳格なコントロールによる追加効果はない12 フェノフィブラートも、脂質異常のある患者において、特に非常に軽いNPDRで糖尿病網膜症の進行を抑えることができる13。 アスピリンは、網膜症の進行、硝子体出血の発生、硝子体出血の持続時間には影響を与えないことが示されており、眼球を損なうことなく他の医療適応に安全に使用することができます7
糖尿病患者の治療には運動の推奨を含める必要があります。 軽度の非増殖性網膜症患者は、安全に運動を開始することができる。 しかし、中等度の非増殖性網膜症の患者は、パワーリフティングのような血圧を大きく上昇させる活動を避けるべきです。15重度の非増殖性または不安定網膜症の患者は、激しい運動(ジャンプ、衝撃)、頭を下げる活動、息止めを避けるべきです。15
治療によって視力低下を予防または回復できるため、糖尿病網膜症の早期発見が重要である。 糖尿病網膜症研究(DRS)では、光凝固手術が糖尿病網膜症に効果的な治療法であることがわかりました。 現在のデータでは、黄斑浮腫の治療には抗血管内皮増殖因子製剤(抗VEGF)が単独療法やレーザー凝固療法との併用療法よりも有効であるという証拠が示されています8。
クリニカル・パールズ
- 初期の糖尿病網膜症に特異的な徴候や症状はない。
- 糖尿病網膜症のスクリーニングは、診断後5年目の1型糖尿病患者、
診断時の2型糖尿病患者で行うべきである:– 1型糖尿病の患者では。
- 糖尿病網膜症は妊娠中に急速に進行するため、妊娠を予定している、または妊娠した糖尿病女性にはカウンセリングと検査の強化を行うべきである。
- 厳格な血糖コントロールと血圧コントロール(5526>収縮期140mmHg未満)は糖尿病網膜症の発症を防ぐ。
- (eGFRレベルにかかわらず)アルブミン尿の患者の最大50%が網膜症を持つだろう。9
- 光凝固による治療は病気の進行を防ぎ、抗VEGF治療は黄斑浮腫による視力低下を回復させます。
糖尿病性腎疾患
ADAによって好ましい用語である糖尿病性腎疾患(DKD)は、米国における慢性腎臓病(CKD)の主要原因になっています20,21。 DKDは、糖尿病患者のQOLに長期的に大きな影響を与え、末期腎不全(ESRD)の最大40%の原因ともなっています。20全米腎臓財団のKDOQI(Kidney Disease Outcomes Quality Initiative)とADA 2017 Standards of Careに基づき、DKD患者の目標HbA1c値、投薬管理、治療法に関する指針を示す。
KDOQIでは患者の低血糖リスクと共存疾患によって目標HbA1c値の層別化を行っています。 この取り組みは、HbA1cを7%未満に血糖コントロールすることで、2型糖尿病患者の腎臓病の進行を予防または減少させることを証明した3つの論文に基づいている22,23,24。これらの研究は表2に要約されている。 ADAは、低血糖のリスクが高い患者には、HbA1cの目標値を7%以上にすることを推奨している。8 KDOQIは、CKDステージ4および5の患者で、余命が限られている場合は、HbA1cを7%以上に維持することを推奨している25
Table 2. A1cが7%未満で血糖コントロールが実証されたランドマーク的な研究を選択する
Trial
Results
Action in Diabetes and Vascular Disease.A: Glycemic Control of the Dies and Vascular Disease: Preterax and Diamicron Modified Release Controlled Evaluation (ADVANCE) Trial22
マクロアルブミン尿を21%減少、A1c7%未満で腎代替療法
Veterans Affairs Diabetes Trial (VADT)23
マクロアルブミン尿37%減少、A2C7%未満で腎臓移植療法
マクロアルブミン尿37%減少、A1c7%未満で腎臓移植療法。 A1c7%未満で微量アルブミン尿32%減少
The Action to Control Cardiovascular Risk in Diabetes (ACCORD) study24
A1c7%未満でマクロアルブミン尿2%減少、マイクロアルブミン尿21%減少
疫学。 21 アフリカ系アメリカ人は、白人よりも3~5倍糖尿病性腎症を発症しやすい。20 メキシコ系アメリカ人とピマ・インディアンもDKD発症リスクが高い。20
蛋白尿は、糖尿病における心血管疾患と全死因死亡の予測因子であり、21 DKDの存在は心血管疾患リスク増大の要因である。 21
1型糖尿病では、DKDなどの微小血管合併症は診断後約10~20年で発症し始める。2型糖尿病では、正確な発症が不明な場合が多いため、早めのスクリーニングが必要となる27
病態生理と病態形成。 高血糖は、DKDにつながる糸球体の3つの主要な組織学的変化を引き起こすと考えられている:1)メサンギウムの膨張、2)糸球体基底膜の肥厚、3)糸球体硬化。28 DKDがなぜ起こるかの正確な病態は不明だが、高血糖は最初に組織学の変化とサイトカインの活性化の結果として過濾過と腎臓損傷を生じると考えられている20。 典型的には、アルブミン尿がDKDの最初の徴候となる。29
高脂血症、動脈硬化、高血圧、肥満が併存する結果、さらに悪化し、これらはすべて腎障害とその後の機能低下に寄与する。 さらに、腎血管の動脈硬化が進行すると、糖尿病性腎症が進行しやすくなります。 糖尿病性腎症の特徴として、他の腎臓病と異なり、糸球体や腎臓の大きさは通常、初期には正常または増大しています20
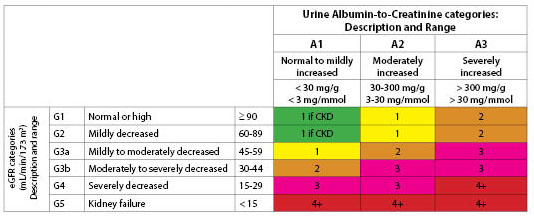
分類。 30,31 eGFRは、人種、年齢、性別、体重、および血清クレアチニン値に基づいている。 (歴史的には、微量アルブミン尿という用語が、アルブミン値の中程度の上昇を定義するために使われてきた。 アルブミン/クレアチニン比は、アルブミン尿を検出するための最初の検査である。 ステージと説明による推定GFR
Stage
GFR (mL/min per 1.73 m2)
Description
90+
Glomerular hyperfiltration
軽度の腎機能低下
3A
中等度の腎機能低下
3B
重度の腎機能低下
< 15または透析中
エンド-エンド腎不全
表4. CKDにおけるアルブミン尿のカテゴリー
カテゴリー
アルブミン対クレアチニン値
説明
A1
< 30
の場合
正常~軽度増加
A2
適度な増加 4676>
A3
> 300
重度
この二つの分類法はCKD発症の二つの経路を表すものです。 一つはクレアチニンの上昇とGFRの悪化によるものである。 もうひとつはアルブミン尿の発現である。 アルブミン尿の増加は、しばしばeGFRの低下をもたらすが32、アンジオテンシン変換酵素(ACE)阻害薬やアンジオテンシン受容体拮抗薬(ARB)の使用や血糖コントロールにより、これを回避することが可能である。 (図1参照)
Figure 1. eGFRとアルブミン尿のカテゴリー別の評価頻度の目安(年間回数)
Kidney Diseaseより許可を得て転載しています。 Improving Global Outcomes (KDIGO).
Common Symptoms. ほとんどの人は、糖尿病性腎症による症状はありません。 多くの場合、患者は他の微小血管合併症の証拠または診断を有する場合がある。20 初期のDKDは一般的に無症状である。 DKDの晩期所見として、泡状の尿がある。 さらに、患者が重度の低アルブミン血症である場合、足浮腫と疲労を呈することがある。20 DKDの患者は、通常、全身性高血圧を有する。 糖尿病性腎症の患者は、一般的に網膜症や神経障害を併発する。 自覚症状がないため、日常的なスクリーニングが重要である。 ADAは、尿中アルブミン/クレアチニン比の年1回のスクリーニングを推奨している。8 さらに、5年間継続した1型糖尿病患者、2型糖尿病患者、高血圧と糖尿病を併存するすべての患者において、少なくとも年1回はeGFRを検査する必要がある。 いくつかのレッドフラッグは、糖尿病がCKDの唯一の原因ではないことを示唆しているかもしれない。 他の微小血管合併症の証拠がなく、CKDが進行している場合、これは警告である。 突然の発症(糖尿病発症後5年未満)で異形赤血球や鋳型を含む尿沈渣を伴う顕性蛋白尿、またはGFRの急激な低下は、糖尿病以外の病因による腎疾患を示唆する20。多発性骨髄腫が懸念される場合、血清または尿の電気泳動検査を行うことができる。 eGFRの低下と糖尿病でアルブミン尿がない場合は、DKD以外のCKDの原因について調べる必要がある21。 Red Flags Suggesting Nondiabetic Glomerular Disease
- Onset of proteinuria < 5 years from the documented onset of type 1 diabetes or acute onset of renal disease
- Acute decline of eGFR.DKD.Nondiabetic Glomerular Disease
- [非病人性糸球体疾患(Nondiabetic Glomerular disease)]。 糖尿病性腎症
- 異形赤血球または細胞性鋳塊を含む尿沈渣
- 神経障害または網膜症などの他の微小血管合併症を有しないこと
- 他の全身性疾患の徴候および症状
治療法。 糖尿病性腎症の特徴は、血糖値、減塩、血圧、脂質異常症の管理である。 さらに、患者はアミノグリコシドや非ステロイド性抗炎症薬などの腎毒性のある薬やサプリメントを避ける必要がある。 腎臓病のステージIVや腎機能が急速に低下した場合は、腎臓専門医に紹介する。 その他の紹介の適応は、症例の複雑さによって異なる。 糖尿病の新しい経口薬は、腎不全の進行を防ぐのに役立つかもしれない
Glycemic Control. 糖尿病性腎症患者では、薬剤の選択、モニタリング、薬理学のすべてが影響を受ける。 患者のeGFRが低下すると、経口薬の中には用量調節が必要となるものがある。 31 表6は、腎臓病患者における抗血糖薬の推奨用量調節を示している。 2016年、エンパグリフロジンとカナグリフロジンの両剤は、CKDの進行および微量アルブミン尿を抑制することが示されました33,34。 エンパグリフロジンは、画期的なEmpagliflozin Cardiovascular Outcome Event Trial in Type 2 Diabetes Mellitus Patients (EMPA-REG) outcome studyにおいて、標準的な2型糖尿病ケアに追加すると、腎症の進行率を下げ、主要有害心血管イベントのリスクをプラセボに比べて減少させました33
表6. 腎障害患者における血糖降下薬の用量調整と推奨値
Glucose-Japan (グルコースジャパン)腎障害時の投与量調整
Class Medication
Biguanides
Metformin
eGFR 30から45mL/min/1.73 m2: 治療開始は推奨されない。
eGFR < 30 mL/min/1.73 m2:治療開始を推奨しない。
スルホニル尿素
グリンピリド
軽度・中等度障害者:使用を禁忌とする。 1日1回1mgから開始する
重度障害者。
グリピジド
エクステンドリリース
。 1日1回2.5mgから開始
グリブリド
eGFR < 60 mL/min/1.73 m2: 使用は推奨されません
メグリチノイド
ナテグリニド
ありません。 投与量の調節が必要
レパグリニド
CrCl 20~40mL/min: 0.0から開始。5mgを食事とともに投与
CrCl < 20 mL/min。 情報なし
Thiazolidinediones
Pioglitazone
用量調整なし 4676>
ロシグリタゾン
用量調節不要
α-(アルファ)-」。グルコシダーゼ阻害剤
アカルボース
SCr > 2.0mg/dL: 使用を推奨しない
ミグリトール
CrCl < 25 mL/min or SCr >2.0mg/dL: 使用は推奨されない
DPP-4 inhibitors
Alogliptin
CrCl30~60mL/min:12.5mg/mL。5mg1日1回
CrCl < 30 mL/分:6.25mg1日1回
ESRD requiring hemodialysis:6.25mg1日1回
CrCl < 30 mL/分:12.5mg1日1回。25mgを1日1回、血液透析のタイミングを考慮せずに投与する
リナグリプチン
用量調節不要
ザクリプチン
CrCl<50mL/min未満:2.5mgを1日1回投与
血液透析を必要とするESRD:2.5mgを1日1回投与し、血液透析後に投与する
Sitagliptin
CrCl 30~50mL/min:50mg 1回投与
CrCl < 30mL/min: 25mg1日1回
血液透析又は腹膜透析を必要とするESRD:25mg1日1回、血液透析のタイミングを考慮せず投与
ビルダグリプチン
CrCl< 50mL/minの場合:1mg1日1回。 50mg1日1回投与
胆汁酸隔離剤
コレスベラム
用量調節不要
ドーパミン(DOP)系抗炎症剤
ブロモクリプチン
情報なし
SGLT-2 inhibitors
カナグリフロジン
eGFR 45~60 mL/min/1.73 m2: 1日1回100mgを超えないこと
eGFR < 45 mL/min/1.73 m2:1日1回100mgを超えないこと。 治療開始は推奨されない。
eGFR < 30 mL/min/1.73 m2/ESRD/Hemodialysis: 治療を開始することは推奨されない。 使用禁忌
ダパグリフロジン
eGFR < 60 mL/min/1.73 m2: 治療開始は推奨されない。
eGFR < 30 mL/min/1.73 m2/ESRD/Hemodialysis: 治療開始を推奨しない。 使用禁忌
エンパグリフロジン
eGFR < 45 mL/min/1.73 m2: 治療開始は推奨されない。
eGFR < 30 mL/min/1.73 m2:治療開始後、eGFR < 45 mL/min/1.73 m2が持続する場合は、治療を中止する。
ESRD/ Hemodialysis。 使用禁忌
GLP-> 1.0mg/kg、1.0mg/kg。1受容体作動薬
アルビグルチド
用量調節不要
デュラグルチド
用量調節不要
エキセナチド
Cl30~50 mL/minの場合です。 情報なし。 注意して使用すること。
CrCl < 30 mL/min/ESRDの場合。 使用は推奨されない
リラグルチド
情報なし
リキシナチド
eGFR15~29mL/min/1.未満: 使用は推奨されない
リララグルチド
情報なし73 m2: 情報なし。 脱水や腎機能悪化につながる可能性のある消化器系の副作用の増加に注意する。73 m2/ ESRD:使用は推奨されない
アミリン類似物質
プラムリンチド
塩素濃度15mL/分以上:用量調節不要
ESRD: 情報なし
Insulins
Rapid->Insulins
Rapid->Insulins
Insulins - リスプロ
- アスパルト
- グルリシン
- 吸収型インスリン
短時間作用型
- ヒト常用
即効型
- Human NPH
基礎インスリンアナログ
- Glargine
- Detemir
- Degludec
インスリン要求量はインスクリアの変更または代謝の変化によって減少することがある。 血糖値を注意深く監視してください。
血圧。 37 United Kingdom Prospective Diabetes Study (UKPDS) では、血圧が120mmHgになるまで収縮期血圧が10mmHg下がるごとに、糖尿病合併症のリスクが12%減少することがわかった38。 ACE阻害剤は、アルブミン尿が軽度である患者に投与すると、DKDの発症を遅らせることができることが示されている。 クレアチニンは、ACE阻害薬またはARBの投与開始時に最大30%上昇することがあります。39 クレアチニンがこれ以上上昇する場合は、他の腎臓の基礎疾患の評価を検討してください。
KDOQIでは、正常血圧および正常アルブミン尿の2型糖尿病患者にACE/ARBの投与を行わないよう勧告しています。40,41,42 ACE阻害剤またはARBは、微量アルブミン尿を伴う正常血圧の糖尿病患者に推奨されています。31,37 これらの患者に対する特定の用量や滴定はありません。 ACEとARBの両方によるレニン・アンジオテンシン系の二重遮断は、高カリウム血症、腎機能障害、低血圧のリスクが高まるため、推奨されていない43
減塩。 2012年のReduction of Endpoints in Non-insulin-dependent diabetes mellitus with the Angiotensin II Antagonist Losartan (RENAAL) Trial and Irbesartan Diabetic Nephropathy Trial (IDNT) では、2型糖尿病と糖尿病性腎症患者で減塩食がARBの腎保護作用と心保護作用を高めることが証明された44,45
腎臓透析と腎臓移植
腎臓移植の場合。 ESRDの患者は、腎臓内科に紹介されるべきである。 治療の選択肢としては、腹膜透析または血液透析、腎移植、または治療を中止して緩和ケアまたはホスピスケアを開始するオプションがある。 ある観察研究では、透析開始年齢が若い(5526歳未満)患者ほど生存率が低いことが明らかになった46
紹介。 図1には、GFRとアルブミン尿の分類に基づく紹介の適応が記載されている。 特に網膜症の発症が腎症の発症に先行しない1型糖尿病患者では、糖尿病とは無関係な腎臓病の他の原因を考慮する21。腎臓内科医は、診断を明確にし、耐性高血圧や高カリウム血症をコントロールし、患者の透析の準備を助けることができる8
また、腎症の発症が糖尿病そのものと関係がない場合も考慮する必要がある。 1型糖尿病患者では、網膜症の発症は通常、腎症の発症に先行する。47 腎症を呈し、網膜症を認めない患者は、他の原因がないか評価する必要がある。 腎症の原因が不明な場合、または貧血、副甲状腺機能亢進症、eGFR < 30 mL/min/1.73 m2などの進行性腎臓病など管理が難しいDKD関連の問題がある場合は、腎臓内科医に紹介すべきである。8 CKDステージ4(eGFR < 30 mL/min/1.73 m2)になると腎臓内科医に相談することは、疾病率の減少、医療費減少、および透析遅延と関連している48。
クリニカルパール
- 年1回のDKDスクリーニングは、尿中アルブミン検査とeGFRの測定によって行うべきである
- 血圧とグルコースコントロールは、腎症の進行を予防できる。 糖尿病とCKDの患者では、血圧を<140/90mmHgに維持する。 ACE阻害薬やARBを治療薬として選択すべきである。
- 血圧やタンパク排泄が正常であれば、腎症の予防のためにACE阻害薬やARBを使用すべきではない。 ACE阻害剤とARBは併用しないこと。
- CKDステージ3~5の患者では低血糖のリスクが高い。 スルホニル尿素などの経口剤には注意が必要である。
- CKD患者の中には、特に低血糖のリスクが大きい場合、目標HbA1c> 7%とすることが適切である。
糖尿病性末梢神経障害
臨床の現場で広く受け入れられている糖尿病性末梢神経障害(DPN)の定義は、「他の原因を除外した上で、糖尿病患者に末梢神経機能障害の症状や徴候があること」です。「49 遠位対称性多発神経障害のADA分類は、1)主に小繊維神経障害、2)主に大繊維神経障害、3)小・大繊維混合神経障害(最も多い)です。
病態と病因 DPNの発症と進行は、神経とその周囲の細胞の複雑な関係から生じる。50 血管因子と代謝の相互作用の両方が、DPNのすべての段階に寄与している51。 DPNの発症につながるヒトの糖尿病における一般的な理解は、高血糖、糖尿病の期間、加齢に伴う神経細胞の損傷、血圧や血中脂質のコントロールの程度、および体重の間の複雑な相互作用です52,53,54,55 高血糖は神経細胞の代謝状態を決定する多くの生化学経路を活性化して、神経灌流の障害と結合して神経障害の進行に寄与しています。 画期的な試験であるDCCTは、神経障害の発症における高血糖の重要性を支持している。10,56,57 DPNにつながる別の高血糖関連メカニズムは、フリーラジカル産生の増加を伴う高血糖誘発性酸化ストレスおよびニトロソ化ストレスである58,59。
高血糖に加えて、最近、低レベルの炎症が糖尿病性神経障害の病態に重要な役割を果たし、末梢神経や自律神経線維に障害をもたらす可能性が示唆されています51,60。 代謝や血管の複雑な要因が引き金となり、神経線維の損傷と修復のバランスが崩れ、特に遠位の感覚線維に影響を与え、糖尿病性多発神経炎の臨床症状を現す感覚を徐々に失わせる一因となっている58,61
。 血糖値の上昇により、小神経線維と大神経線維の両方が冒され、冒された神経線維の種類により、症状が異なる。 小神経線維が主体である場合、誘発される症状は通常、疼痛(刺すような、しびれるような、チクチクする、焼けるような、痛い、つまらない、過度に敏感)、感覚異常(焼けるような、チクチクする、刺すようななどの不快感覚)およびしびれです4。
不快感の強さは、小さな異常感覚を感じることから、夜間に悪化し睡眠を妨害する痛みによって障害を受けることまであり、生活の質が低下しているという認識によるうつ病との関連が示されている4。
一方、太い線維が主に冒されると、患者は四肢にしびれやうずきを感じ、不安定な歩行を経験し、バランスを崩す(転倒の可能性)4。一部の患者は、糖尿病の治療管理の強化により血糖値が低下すると症状が悪化することがある。 糖尿病性ニューロパチーによる重篤な感覚障害は、無痛性障害となり、足潰瘍や重症の場合は切断の危険性が高くなります。62
糖尿病性末梢神経障害で最も多いのは、感覚神経線維が徐々に失われる遠位対称性ポリニューロパチーです4。 典型的な「ストッキング」パターンは、最も長い神経の最も遠位に起こる(最初に影響を受ける)損傷によって両側で作られる。63,64,65 時間が進むにつれて、感覚損失とDNPの典型的症状を促す「ストッキング-手袋」パターンが、神経欠損の近位進行から生じる4
臨床的診断。 DPNの臨床診断は、他の神経障害の原因を除外した後、糖尿病患者の神経障害性徴候および症状に基づいて行うことができる。66 無症状の糖尿病性末梢神経障害は、この合併症を持つ人の最大50%に起こる可能性があるため、特に不感症足による怪我のリスクが高い人に対しては、予防フットケアの実施が不可欠である。4
糖尿病性神経障害(DSN)は、糖尿病を患った人、または糖尿病を患っている人に起こる可能性がある。 DPNの年次スクリーニングは、すべての糖尿病患者において、ピン刺入、温度、振動知覚(128Hz音叉を使用)、10gモノフィラメント圧覚、足関節深部腱反射によって行う必要があり、10gモノフィラメント知覚の喪失(保護感覚の喪失)と知覚振動の減少によって潜在的な足潰瘍を予測することができる63。 ADAのStandards of Medical Care in Diabetes-2017では、潰瘍や切断を発症するリスクのある患者を特定する目的で、10gモノフィラメント検査を毎年行うことを引き続き推奨している8。さらに、2017年のADAガイドラインでは、2型糖尿病の診断時および1型糖尿病の診断から5年後にDPNに対するスクリーニングを行っている8
2009年に、糖尿病神経症に関するトロントコンセンサスパネルが診断基準を更新して診断カテゴリーを提示した。 さらに、Michigan Neuropathy Screening Instrument(MNSI)、Toronto Clinical Neuropathy Score、Utah Neuropathy Scaleなど、医療従事者が診断に利用できる有効性の高いスクリーニング検査がいくつかある。 表7は、除外すべき他の神経障害の原因について述べたものである
Table 7. 神経障害の他の原因67
- アルコールまたは他の毒素
- 神経毒性薬剤、特に化学療法
- ビタミンB12不足
- 甲状腺機能低下症
- 腎疾患
- 悪性腫瘍(多発性骨髄腫, 気管支がん)
- Human immunodeficiency virus (HIV)
- Chronic inflammatory demyelinating neuropathy, inherited neuropathies, and vasculitis
Diagnostic Studies(診断学)。 DPNの存在を確認するために、いくつかの診断検査が存在する。 4 定量感覚検査は、患者の軽い触覚、振動、温度識別能力を評価するもので、一定の主観性が伴う。4 その他の方法として、皮膚生検、表皮内神経線維密度検査、角膜共焦点顕微鏡検査は、臨床で日常的に用いられてはいないが、臨床試験で用いられることがある。 薬理学的治療。 DPNの薬理学的治療は症状の改善を目的とするものであり、使用される薬剤は進行の防止を目的としたものではない。 表8は、神経障害性症状を制御するために最もよく使用される3つのクラス(抗痙攣薬、抗うつ薬、オピオイド)の薬物をまとめたものである。 4 ガバペンチンは、DPN治療薬としてFDAに承認されていないが、初期治療薬としてしばしば使用され、FDA承認薬と比較し有効性が確認されている。 三環系抗うつ薬(例:アミトリプチリン)-FDA非承認DPN薬-はDPN管理に有効であるが、副作用のリスクが高いため、慎重に使用すべきである
表8. DPN4によく使われる薬理学的薬剤69
薬剤
(NNTレンジ 3050%改善*)
大日本印刷の1日の最大投与量(mg/日)
よくある副作用
用量調節が必要ですか。
禁忌
処方上の注意
抗けいれん薬
- Pregabalin: 電位依存性カルシウムチャネルに結合して変化させ、興奮性神経伝達物質の放出を調節する
- Gabapentin: 完全に理解されていないが、興奮性神経伝達物質の伝達を制限すると考えられる
Pregabalin
(3.1.3~8.3)
めまい 倦怠感 体重増加 末梢浮腫 かすみ目 便秘
腎:あり
肝:あり
腎:あり
肝:あり。 プレガバリンに対する過敏症
Strong evidence; FDA approved; controlled substance
Gabapentin
(3.3-7.1).2)
3,600
めまい
運動失調
傾眠
頭痛
吐き気
下痢
体重増加
腎.臓.臓器の障害
腎: はい
肝機能。 No
ガバペンチンに対する過敏症
中程度の証拠;FDA承認なし
抗鬱剤
-
Amitriptyline, duloxetine, & venlafaxine.A
Gaabapentin> に対する過敏症
ガバペンチンに対する過敏症。 が結合し、ノルエピネフリンやセロトニンの再取り込みを阻害し、侵害受容経路での抑制効果を高める
Amitriptyline
(2.1-4.2)
重度の鎮静; 錯乱;
抗コリン作用(便秘、霧視)
腎.泌尿器系;
肝臓: No
高齢者には低用量が推奨される
アミトリプチリンに対する過敏症;MAOとの同時投与または14日以内の同時投与;シサプリドとの同時投与。 心筋梗塞後の急性回復期
Moderate evidence; not FDA approved; use with caution with those with the history of cardiovascular disease
Duloxetine
(3.8-11)
(米国)
吐き気;
鎮静;
全身の眠気
腎:あり
Hepatic:
過敏症; MAOとの同時投与または14日以内; リネゾリドまたはメチレンブルーの静脈内投与を受けている人への開始
中程度の証拠です。 FDA承認;
プレガバリンまたはガバペンチンに追加してもよい
ベンラファキシン
(5.2.2項参照)。2-8.4)
吐き気;
鎮静;
全身の眠気
腎:あり
肝:あり
。
弱いエビデンス;
FDA承認されていない; gabapentinに加えられるかもしれない
オピオイド
- Tramadol and tapentadol: アゴニストとしてmu-オピオイド受容体を介し、ノルエピネフリンやセロトニンの再取り込みを阻害し、中枢性鎮痛薬として作用
Tramadol
(2.1-6.4)
Somnolence
Nausea
Vomiting
Constipation
Light-headedness
Dizziness
Headache
肝機能。 なし
トラマドール、オピオイド又は製剤の成分に対する過敏症
ER 製剤:著しい呼吸抑制及び急性又は重度の喘息
IR 製剤:。 アルコール、催眠剤、麻薬、中枢作用性鎮痛剤、オピオイド、または向精神薬による急性中毒
乱用の可能性が低い(スケジュールIV管理物質)。
第一選択薬または第二選択薬としての使用は推奨されない
Tapentadol
(N/A)
即時放出型。
1日目:700mg、1日目以降:
60mg/日。徐放:
50mg、1日2回傾眠
嘔吐
便秘
めまい
腎不全
50mg/日。
使用しないこと
CrCl < 30 mL/分肝臓:
CrCl < 30 mL/分の場合、使用は推奨されない。タペンタドールに対する過敏症、
著しい呼吸抑制、
急性または重度の喘息、
麻痺性イレウス、
MAO阻害剤の使用から14日以内
FDA承認、スケジュールII規制薬物。
第一選択薬または第二選択薬としての使用は推奨されない
情報はそれぞれの添付文書(商品名で参照)
The American Academy of Neurology (AAN) guidelineでは以下の局所薬を推奨としています。 カプサイシンと硝酸イソソルビドのスプレー(中等度の証拠)およびリドダームパッチ(弱い証拠)。69 Oxcarbazepine、lamotrigine、lacosamide、clonidine、pentoxifylline、mexiletineはDPNの治療においてAANガイドラインで推奨されていない。69
さらに、オピオイドは難治性DPNに使用するよう一部の人から推薦されてきた。 AANガイドラインで推奨されているオピオイドは、デキストロメトルファン(400mg/日)、硫酸モルヒネ(120mg/日まで漸増)、オキシコドン(平均37mg/日、最大120mg/日)だが、1剤を他のものより使うことを示唆する十分なデータはない。69 この論文の著者は、オピオイドから真の機能改善を得た患者のモニタリングを厳密に行い、重症難治例でのみオピオイドを使用するよう推奨している。 著者らは、オピオイドは非がん性疼痛における長期使用は限定的であるという疾病管理予防センターによる2016年の見解声明に従っている70
DPN薬物療法における課題の1つは、QOLの成果を組み込んだヘッドツーヘッド試験が不十分であることである4。 高用量pregabalin、高用量duloxetine、または併用による8週間の治療を比較した最近の研究では、単剤治療と併用治療の間で平均疼痛変化に有意差はなかった。71 糖尿病性末梢神経障害に苦しむ人々のケアを改善するための洞察を得るためには、2つの活性薬剤を比較するさらなる研究が必要である。 手順 ANNガイドラインでは、DPNの治療に経皮的電気神経刺激を3~4週間検討することを提案している69。DPNにおける鍼治療の有効性を評価したパイロット版の2スタイル鍼治療無作為化比較試験72および単盲検プラセボ対照無作為化試験73では、いずれも疼痛に関連する結果指標の改善を示している。 しかし、DPN管理における鍼治療の役割を確認するためには、さらなる研究が必要である。
アルファ・リポ酸 抗酸化物質であるα-リポ酸の使用は、フリーラジカルを介した酸化ストレスを軽減し、DPNの病因の標的化、発症の遅延、症状の改善といった効果をもたらすかもしれないことを示唆する証拠がある74,75
Prevent: Prevention. 健康的な食事と身体活動に焦点を当てたライフスタイルの修正は、継続的に糖尿病および糖尿病性末梢神経障害を含むその合併症の有病率を減少させることが示されています68。集中的な血糖コントロールは、神経機能の改善を通じて糖尿病患者の糖尿病性神経障害のリスクを下げるのに役立つことが示されています61、76、77 DCCTは1型糖尿病における糖尿病性神経障害の予防と進行停止に血糖コントロールが役立つことを立証しました10、56。
クリニカル・パールズ
- 患者の最大50%が無痛性または無症状の末梢神経障害を有する可能性がある。
- 神経障害を有する患者にはフットケア教育(毎日の足の自己点検)と一部の患者には定期的に足科治療を受けることが推奨される。
- 変形の有無にかかわらず保護感覚の喪失の兆候を示すDPN患者は、予防措置のために3~6カ月ごとに医師のフォローアップを受けるよう勧められるべきである64。
- DPNの症状を効果的に管理するためには、集学的アプローチが不可欠となる。この包括的アプローチには、薬物療法、心理療法、および/または物理療法が含まれるかもしれない。
- ADAが発表した糖尿病神経障害に関する新しい見解では、末梢神経障害の症状を示す糖尿病予備群の患者でDPNについてスクリーニングすることが推奨されている4。
- 末梢疾患、非感覚性ニューロパチー、シャルコー足のある人には専門的な治療が必要です。
Gastroparesis
糖尿病神経障害のもう一つの形態に胃不全麻痺があります。 この状態は、吐き気、嘔吐、早期の満腹感または食後の膨満感、腹痛、および膨満感を含む上部消化器症状を伴うが、出口閉塞は存在しない。 胃不全麻痺の原因はいくつかあるが、糖尿病が全体の約3分の1を占めると推定されている78
病態生理。 糖尿病性胃不全麻痺の病態生理学的メカニズムとして、血糖コントロール障害、迷走神経または椎骨前交感神経節神経障害、Cajal間質細胞の異常、一酸化窒素合成酵素の損失、およびおそらく筋障害などが提案されている79,80
Clinical Presentation. この疾患の初期には、患者は通常無症状である。 症状と神経障害の重症度との間に直線的な関係はない。 症状が多岐にわたるため、診断が困難である。 その他の臨床症状としては、食欲不振、栄養失調、体重減少、食事とインスリンの吸収のミスマッチによる低血糖などがあります。 痛みは、実はあまり報告されていないかもしれませんが、多くの人にとって重要なものです。 NIHが資金提供したコンソーシアムでは、胃不全麻痺患者の72%が腹痛を有していた81。 81 この症状は、これらの患者の18%で支配的であった。これらの患者では、痛みは食事によって誘発され(72%)、夜間であり(74%)、睡眠の妨げになった(66%)。 糖尿病性胃不全麻痺の10年間の累積発生率は、地域の糖尿病患者において、1型糖尿病で5.2%、2型糖尿病で1%と推定されている82。 他の研究では、5-12%であるとされている。83,84 しかし、胃排出試験よりも症状に基づいて診断した場合、その割合ははるかに高くなる。
胃不全麻痺は2型糖尿病よりも1型糖尿病に多く、10年以上糖尿病を患い、網膜症、腎症、末梢神経障害などの微小血管合併症を発症してから最もよく見られる症状である。 もし、患者が予想より早く胃不全麻痺を呈した場合は、他の病因を検討する必要がある。最も一般的には、周術期の迷走神経損傷やインクレチン系薬剤(グルカゴン様ペプチド1受容体作動薬(GLP-1RA)やジペプチダーゼ4阻害薬(DPP-4阻害薬)による薬理効果)が挙げられる。 86 胃不全麻痺が死亡率を高めるという明確な証拠はないが、生活の質のすべての側面を大幅に低下させる87
診断法。 多くの検査が診断に役立つ。 この診断のためのゴールドスタンダードは、胃食道シンチグラフィーである。 これは非侵襲的であり、生理学的な検査を行い、定量的な結果を得ることができる。 80
最も正確な検査結果を得るためには、検査前のプロトコルに、プロキネティクス、アヘン剤、抗コリン剤など、運動性を変化させる薬物を検査前の少なくとも2~3日間はすべて中止することが含まれる必要がある。 GLP-1アゴニストやDPP-4阻害剤などのインクレチン系薬剤も、胃排出を遅らせることが知られているため、中止する必要がある。 高血糖も胃排出を遅延させることが知られており、試験開始前にグルコースを275mg/dL以下にする必要がある。79,88
患者は、喫煙とアルコール摂取が胃食道排出を遅くすることがあるので、試験当日は控えるべきである。 さらに、人によっては、GLP-1RAを開始したときに発覚する潜在性胃不全麻痺がある場合がある
治療。 胃不全麻痺の治療は、症状の重症度によって大きく異なります。 治療の一般原則としては、支持療法(水分、電解質、グルコースコントロール、栄養)、内科的治療(プロキネティクス、制吐剤、疼痛緩和)、侵襲的治療(手術、ボトックス注射、胃部ペーシング、電気刺激)がある79
支持療法は通常病院で開始し、水分、電解質、栄養障害の正常化に焦点を当てる。 栄養支持を行う場合、非経口栄養よりも経腸栄養の方が、より生理的で腸内細菌叢の維持に役立つため、好まれる。 さらに、食事の変更は胃不全麻痺に非常に有用である。 低繊維、低脂肪、低残渣の食事が、胃不全麻痺の患者には推奨される。85 高繊維の食事は、消化をより必要とするため、症状を悪化させる可能性がある。 プロキネティクス。 米国では、メトクロプラミドとエリスロマイシンが、胃不全麻痺の治療に最もよく使用される薬物である。 しかし、メトクロプラミドは遅発性ジスキネジアの危険性があるため、黒枠警告が出されている。 この症状の発生は、メトクロプラミドの使用期間と服用回数に直接関係しています。 この薬を使用する場合、症状のある患者のみに使用し、食前15分前に最小有効量から開始するのが最善です。 90
ドンペリドンは、より選択的なドパミンアゴニストで、メトクロプラミドと同等の効果があるが、中枢神経系の副作用はより少ない91
制吐剤:メトクロプラミドと同様に、ドパミンアゴニストを選択することができる。 制吐剤は、症状の改善に使用できる。 しかし、薬物相互作用のリスクは大きく、注意深くモニターする必要がある。
疼痛管理は、胃不全麻痺の患者では課題となりうる。 三環系抗うつ薬は、胃不全麻痺の疼痛に対する第一選択薬としてしばしば使用される。 第二選択薬は、セロトニンを放出しノルエピネフリンの再取り込みを阻害する弱いミューオピオイド受容体作動薬であるトラマドール、およびガンマ-アミノ酪酸アナログであるガバペンチンである。 しかし、胃不全麻痺に麻薬を使用することは、便秘や症状の悪化を助長するため推奨されていない。
侵襲的治療。 ボトックス注射は、胃不全麻痺の治療によく用いられるが、その使用は臨床試験で支持されていない92,93
胃電気刺激装置は、2000年に人道的装置免除によりFDAに承認された94 胃電気刺激装置は、高周波、低エネルギーの電気刺激を胃に与える。 特発性胃不全麻痺よりも糖尿病性胃不全麻痺に有用である。 メタアナリシスでは、患者の症状にかなりの効果があることが示された。 95 胃電気刺激により、吐き気と嘔吐を制御する中枢メカニズムが変化し、迷走神経機能が高まり、膨満感に対する感受性が低下することが提案されている97。 このため、長期的に実施する前に、まず一時的に電極を設置する試験を推奨する者もいる。
クリニカルパール
- 糖尿病性胃不全麻痺は、長年の糖尿病患者や他の微小血管合併症を持つ患者でより一般的なものである。
- 糖尿病性胃不全麻痺では、低繊維、低脂肪、低残渣の食事が推奨される。
- 薬物療法や介入療法は、効果が限られ、長期的に大きなリスクを伴う。
Diabetic Cheiroarthropathy
あまり知られていない糖尿病の合併症に cheiroarthropathyがある。 この疾患は、長期にわたる糖尿病患者において、皮膚の肥厚による関節の可動制限を特徴とする。 1型糖尿病で最初に確認された合併症であると思われる。 有病率は8~50%と幅広い。98
キーロアースロパシーは、コラーゲンのグリコシル化と架橋によって起こると考えられている。 皮膚や腱にも影響を及ぼし、関節の可動域制限、最も一般的には指の伸展、こわばり、痛みなどが生じることがある。 糖尿病性キーロパチーの典型的な身体検査サインは、”祈りサイン “です。 この状態では、人は手を完全に平らにして「祈る」ことができず、左手と右手の指の間に隙間ができます。 糖尿病性キアロパチーになると、微小血管合併症のリスクが3倍高くなるという証拠があります99
糖尿病性キアロパチーは、一般的に長期間にわたる血糖コントロールが不十分な場合に悪化すると言われています。 100
結論
糖尿病合併症の管理には、集学的なチームが必要である。 網膜症、腎症、神経障害は無症状であることから、早期のスクリーニングが不可欠である。 すべての合併症に対する糖尿病管理の特徴は、引き続き血糖値と血圧のコントロールである
- American Diabetes Association. 糖尿病のコスト。 で入手可能。 http://www.diabetes.org/advocacy/news-events/cost-of-diabetes.html?referrer=https://www.google.com/. 2015年6月22日に更新されました。 Accessed Feb. 8, 2017.
- UK Prospective Diabetes Study Group. 2型糖尿病患者におけるスルホニル尿素またはインスリンによる集中的な血糖コントロールと従来治療との比較および合併症のリスク。 Lancet 1998;352:837-853.
- Gregg EW, Yanfed L, Wang J. Changes in diabetes-related complications in the United States, 1990-2010.All Rights Reserved. N Engl J Med 2014;370:1514-1523.
- Pop-Busui R, Boulton A, Feldman E, et al. Diabetes neuropathy.「糖尿病神経障害」。 米国糖尿病協会によるポジションステートメント。 Diabetes Care 2017;40:136-154.
- Leasher JL, Bourne RR, Flaxman SR, et al.Global estimates on the number of people blind or visually impaired by diabetic retinopathy.糖尿病網膜症による視覚障害者の数に関する世界的な推定値。 1990年から2010年までのメタアナリシス。 Diabetes Care 2016;39:1643-1649.
- National Eye Institute. 糖尿病性眼疾患に関する事実. にて公開中。 https://nei.nih.gov/health/diabetic/retinopathy. 2015年9月更新。 Accessed Feb. 8, 2017.
- Fong, DS, Aiello L, Gardner TW, et al. Retinopathy in diabetes.(糖尿病における網膜症)。 Diabetes Care 2004;27(Suppl 1):S84-S87.
- 米国糖尿病学会(American Diabetes Association). 糖尿病における医療の基準-2017. Diabetes Care 2017;40:(Suppl 1):S4-S5.
- Doggen K, Nobels F, Scheen AJ, et al. Insulin-treated diabetesにおけるアルブミン尿および腎機能障害に関連する心血管危険因子および合併症。 J Diabetes Complications 2013;27:370-375.
- The Diabetes Control and Complications Trial Research Group. インスリン依存性糖尿病における糖尿病の集中治療が長期合併症の発症と進行に及ぼす影響. N Engl J Med 1993;329:977-986.
- Action to Control Cardiovascular Risk in Diabetes Follow-On (ACCORDION) Eye Study Group and the Action to Control Cardiovascular Risk in Diabetes Follow-On (ACCORDION) Study Group.「糖尿病の心血管リスクをコントロールするためのアクション」研究グループ。 Action to Control Cardiovascular Risk in Diabetes(ACCORD)フォローオン試験における2型糖尿病の網膜症に対する集中血糖コントロールの持続的な効果。 Diabetes Care 2016;39:1089-1100.
- ACCORD Study Group, ACCORD Eye Study Group, Chew EY, et al. Effects of medical therapies on retinopathy progression in type 2 diabetes.(2型糖尿病における網膜症進行に対する内科的療法の効果). N Engl J Med 2010;363:233-244.
- Chew EY, Davis MD, Danis RP, et al. The effects of medical management on progression of diabetic retinopathy in persons with type 2 diabetes.2型糖尿病患者の糖尿病網膜症の進行に対する内科治療の効果。 The Action to Control Cardiovascular Risk in Diabetes (ACCORD) Eye Study(糖尿病における心血管リスクを制御するための行動(ACCORD)眼科研究)。 Ophthalmology 2014;121:2443-2451.
- Diabetes Control and Complications Trial Research Group.「糖尿病のコントロールと合併症の研究グループ」(英文). Diabetes Control and Complications Trialにおける妊娠の微小血管合併症への影響。 Diabetes Care 2000;23:1084-1091.
- Colberg SR, Sigal RJ, Yardley JE, et al. Physical activity/exercise and diabetes.は、身体活動/運動と糖尿病について述べています。 米国糖尿病学会のポジションステートメント。 Diabetes Care 2016;39:2065-2079.
- The Diabetic Retinopathy Study Research Group.日本糖尿病網膜症研究会. 光凝固療法の効果に関する予備報告. Am J Ophthalmol 1976;81:383-396.
- Early Treatment Diabetic Retinopathy Study Research Group.による糖尿病網膜症に対する光凝固療法の効果に関する予備報告. 糖尿病黄斑浮腫に対する光凝固療法。 早期治療糖尿病性網膜症研究報告書第1号。
- Nguyen QD, Brown DM, Marcus DM, et al. Ranibizumab for diabetic macular edema: 2つの第III相ランダム化試験の結果。 RISE試験とRIDE試験の結果。 Ophthalmology 2012;119:789-801.
- Wong TY, Cheung CMG, Larsen M, et al. Diabetic retinopathy. Nat Rev Disease Prim doi:10.1038/nrdp.2016.12; published online March 17, 2016.
- Batuman V, Soman AS, Schmidt RJ, Soman SS.糖尿病性網膜症(Nat Rev Disease Prim)。 糖尿病性ネフロパシー。 Medscapeで利用可能です。 http://emedicine.medscape.com/article/238946-overview. 2016年9月30日更新。 Accessed Feb.12, 2017.
- Tuttle KR, Bakris GL, Bilous RW, et al. Diabetic kidney disease.糖尿病性腎症。 ADAコンセンサス会議からの報告。 Diabetes Care 2014;37:2864-2883. https://doi.org/10.2337/dc14-1296
- Patel A, MacMahon S, Chalmers J, et al. Intensive blood glucose control and vascular outcomes in patients with type 2 diabetes.(2型糖尿病患者における集中的な血糖コントロールと血管予後)。 N Engl J Med 2008;358:2560-2572.
- Duckworth W, Abraira C, Moritz T, et al. Glucose control and vascular complications in veterans with type 2 diabetes.(2型糖尿病退役軍人におけるグルコースコントロールと血管合併症). N Engl J Med 2009;360:129-139.
- Ismail-Beigi F, Craven T, Banerji MA, et al. Effect of intensive treatment of hyperglycaemia on microvascular outcomes in type 2 diabetes.「2型糖尿病の微小血管アウトカムにおける高血糖の集中治療の効果」(邦訳は「2型糖尿病における高血糖の集中治療」)。 ACCORD無作為化試験の解析。 Lancet 2010;376:419-430.
- National Kidney Foundation. 糖尿病とCKDのためのKDOQI臨床実践ガイドライン:2012年版アップデート。
- Fox CS, Matsushita K, Woodward M, et al.慢性腎臓病予後コンソーシアム.2012;60:850-886.
慢性腎臓病予後コンソーシアム.2012;60:850-886.慢性腎臓病予後コンソーシアム. 糖尿病の有無にかかわらず、腎臓病の指標と死亡率および末期腎臓病との関連性。 メタアナリシス。 Lancet 2012;380:1662-1673.
- Hahr AJ, Molitch ME. 慢性腎臓病患者における糖尿病の管理。 Clin Diabetes Endocrinol 2015. doi: 10.1186/s40842-015-0001-9.
- Alsaad KO, Herzenberg AM.の項参照。 糖尿病性腎症と他の糸球体硬化症の症例との鑑別。 最新情報。 J Clin Pathol 2007;60:18-26.
- Narva AS, Bilous RW. 糖尿病性腎臓病の検査評価。 Diabetes Spectr 2015;28:162-166.
- Levey AS, Stevens LA, Schmid CH, et al. A new equation to estimate glomerular filtration rate.糖尿病性腎臓病の検査評価. Ann Intern Med 2009;150:604-612.
- National Kidney Foundation. 慢性腎臓病のためのKDOQI臨床実践ガイドライン。 評価、分類、および層別化。
- de Boer IH, Rue TC, Cleary PA, et al.1型糖尿病と微量アルブミン尿の患者の長期腎臓転帰について。 Diabetes Control and Complications Trial/Epidemiology of Diabetes Interventions and Complications cohortの解析。 Arch Intern Med 2011;171:412-420.
- Wanner C, Inzucchi SE, Lachin JM, et al. Empagliflozin and progression of kidney disease in type 2 diabetes.エンパグリフロジンと2型糖尿病における腎疾患の進行。 N Engl J Med 2016;375:323-334.
- Heerspink HJL, Desai M, Jardine M, et al. Canagliflozin slows progression of renal function decline independently to glycemic effects.(カナグリフロジンは血糖効果とは別に腎機能低下の進行を抑制する。 J Am Soc Nephrol 2016;28:1-8.
- Lexi-Drugs. レキシコンプ. ウォルターズ・クルワー・ヘルス,Inc. リバーウッズ、イリノイ州。 で入手可能。 http://online.lexi.com. Accessed Oct. 31, 2016.
- Micromedex Solutions. Truven Health Analytics, Inc. ミシガン州アナーバー。 で利用可能。 http://www.micromedexsolutions.com. Accessed Oct. 31, 2016.
- James PA, Oparil S, Carter BL, et al. 2014 evidence-based guideline for the management of high blood pressure in adults.(成人の高血圧管理に関する2014年版エビデンスベースガイドライン)。 JAMA 2014;311:507-520.
- King P, Peacock I, Donnelly R. The United Kingdom Prospective Diabetes Study (UKPDS): 2型糖尿病に対する臨床的・治療的意義。
- Jackevicius CA, Wong J, Aroustamian I, et al. ACE inhibitor discontinuation subsequent to elevated serum creatinine.Rates and predictors of ACE inhibitor since the higher serum creatinine: レトロスペクティブ・コホート研究。 BMJ Open 2014;4:e005181.
- Mauer M, Zinman B, Gardiner R, et al. Enalapril and losartan in Type 1 Diabetesの腎臓および網膜への影響。 N Engl J Med 2009;361:40-51.
- Bilous R, Chaturvedi N, Sjølie AK, et al. カンデサルタンの糖尿病の微量アルブミン尿とアルブミン排泄率への影響。 3つの無作為化試験 2型糖尿病における微量アルブミン尿の遅延または予防のためのオルメサルタン。 N Engl J Med 2011;364:907-917.
- Makani H, Bangalore S, Desouza KA, et al. Renin-angiotensin systemの二重遮断の有効性と安全性.Desouza KA, et al: 無作為化試験のメタアナリシス。 BMJ 2013;346:f360.
- Miao Y, Ottenbros SA, Laverman GD, et al. ロサルタン治療中の尿酸の減少が腎臓の転帰に与える影響について: アンジオテンシンII拮抗薬ロサルタン試験による非インスリン依存性糖尿病のエンドポイント減少のポストホック解析。 Hypertension 2011;58:2-7.
- Lewis EJ, Hunsicker LG, Clarke WR, et al. 2型糖尿病による腎症患者におけるアンジオテンシン受容体拮抗薬イルベサルタンの腎保護効果.Newis EJ, Hunsicker LG, Clarke WR, et al. N Eng J Med 2001;354:851-860.
- Adler A, Casula A, Steenkamp R, et al. Association between glycemia and mortality in diabetic individuals on renal replacement therapy in the U.K. Diabetes Care 2014;37:1304-1311.
- Sharma SG, Bomback AS, Radhakrishnan J, et al. The modern spectrum of renal biopsy findings in patients with diabetes.Dies.Diesney 2014;37:1304-1311.Diode 2014:135-135.他、糖尿病を有する患者の血糖値と死亡率との関連性、糖尿病患者の腎生検所見について。 Clin J Am Soc Nephrol 2013;8:1718-1724.
- Smart NA, Dieberg G, Ladhani M, Titus T. Early referral to specialist nephrology services for preventing the progression to end-stage kidney disease.腎臓病専門医への早期紹介は末期腎臓病への進行を予防する。 Cochrane Database Syst Rev 2014;6:CD007333.
- Boulton AJM, Gries FA, Jervell JA. 糖尿病性末梢神経障害の診断と外来管理のためのガイドライン。 また、このような場合にも、「医療費助成制度」を利用することができます。 糖尿病性末梢神経障害における小胞体ストレス。 新たな治療標的。 Antioxid Redox Signal 2014;21:621-633.
- Cameron NE, Cotter MA. 糖尿病性神経障害における炎症促進機序。 核因子κB経路に着目して。 また、「糖尿病性神経障害と血管の危険因子の関連性」をテーマに、糖尿病性神経障害と血管の危険因子の関連性についての研究を行っています。
- Wiggin TD, Sullivan KA, Pop-Busui R, et al. Elevated triglycerides correlated with progression of diabetic neuropathy.N Engl J Med 2005; 352:341-350.
- Wiggin TD, Sullivan KA, Pop-Busui R, et al. Diabetes 2009;58:1634-1640.
- Stella P, Ellis D, Maser RE, Orchard TJ. 1型糖尿病における心血管自律神経障害(呼気・吸気比)。 発生率と予測因子。 J Diabetes Complications 2000;14:1-6.
- Witten DR, Tesfaye S, Chaturvedi N, et al. Type 1 Diabetes mellitusにおける心臓自律神経障害のリスクファクター. Diabetologia 2005;48:164-171.
- Diabetes Control and Complication Trial (DCCT) Research Group.による糖尿病コントロールと合併症の研究。 糖尿病の集中治療が神経伝導に及ぼす影響について、Diabetes Control and Complications Trialで検討した。 Ann Neurol 1995;38:869-880.
- Diabetes Control and Complication Trial (DCCT) Research Group.による糖尿病コントロールと合併症試験(DCCT)。 Diabetes Control and Complications Trial(DCCT)研究グループ:糖尿病集中治療が自律神経系機能測定に及ぼす影響. Diabetologia 1998;41:416-423.
- Edwards JL, Vincent AM, Cheng HT, Feldman EL.(エドワーズ JL、ヴィンセント AM、チェン HT、フェルドマン EL)。 糖尿病性ニューロパチー。 管理へのメカニズム。
- Vincent AM, Callaghan BC, Smith AL, Feldman EL.薬物療法 2008;120:1-34.
- Vincent AM, Callaghan BC, Smith AL, Feldman EL.糖尿病性神経障害:メカニズムから管理まで。 糖尿病性ニューロパチー。 細胞メカニズム、治療ターゲット。 また、「震災の影響により、被災された方々に心よりお見舞い申し上げます。 Diabetes 2007;56:2997-3005.
- Callaghan BC, Cheng HT, Stables CL, et al.糖尿病性神経障害: 臨床症状および現在の治療法。 Lancet Neurol 2012;11:521-534.
- Boulton AJM, Kirsner RS, Vileikyte L. Clinical Practice.糖尿病性神経障害:臨床症状と現在の治療。 神経障害性糖尿病性足潰瘍。 また、このような場合にも、「医療費助成制度」を利用することができます。 米国糖尿病学会による声明。 糖尿病ケア2005;28:956-962.
- Boulton AJM、アームストロングDG、アルバートSF、ら、包括的な足の検査とリスクアセスメントです。 このような場合、「足病変」と呼ばれる。 Diabetes Care 2008;31:1679-1685.
- Tesfaye S, Boulton AJ, Dyck PJ, et al.糖尿病性神経障害(Diabetic neuropathies)。 定義、診断基準、重症度の推定、および治療に関する最新情報。 Diabetes Care 2010;33:2285-2293.
- Dyke PJ, Albers JW, Andersen H, et al. Diabetic polyneuropathies(糖尿病性神経障害): 研究定義、診断基準、重症度の推定に関する最新情報。 Diabetes Metab Res Rev 2011;27:620-628.
- Freeman R. Not all neuropathy is diabetes is of diabetic etiology.糖尿病による神経障害はすべて糖尿病性であるわけではない。 糖尿病性ニューロパチーの鑑別診断。 Curr Diabe Rep 2009;9:423-431.
- Balducci S, Iacobellis G, Parisi L, et al. Exercise training can modify the natural history of diabetic peripheral neuropathy.運動トレーニングは、糖尿病性末梢神経障害の自然史を変更することができます。 J Diabetes Complications 2006;20:216-223.
- Bril V, England J, Franklin GM, et al. Evidence-based guideline.エビデンスに基づくガイドライン。 エビデンスに基づくガイドライン:痛みを伴う糖尿病性ニューロパチーの治療。 米国神経学会、米国神経筋・電気診断医学会、米国物理医学・リハビリテーション学会による報告。 Neurology 2011;76:1758-1765.
- Dowell D, Haegerich TM, Chou R. CDC Guideline for prescribing opioids for chronic pain – United States 2016.日本では、慢性疼痛に対するオピオイドの処方に関するCDCガイドラインがあります。 MMWR Recomm Rep 2016;65:1-49.
- Tesfaye S, Wilhelm S, Lledo A, et al. Duloxetine and pregabalin: High-dose monotherapy or their combination? COMBO-DN試験」-糖尿病性末梢神経障害性疼痛患者を対象とした多国籍無作為化二重盲検並行群間比較試験です。 2013;154:2616-2625.
- Ahn AC, Bennani T, Freeman R, et al. 有痛性糖尿病性神経障害治療のための2種類の鍼治療-パイロット無作為化対照試験(Pilot randomized control trial). Acupunct Med 2007;25:11-17.
- Garrow A, Xing M, Vere J, et al. Role of acupuncture in the management of diabetic painful neuropathy (DPN)(鍼治療の役割は、糖尿病性疼痛性神経障害の管理)。 パイロットRCT。 Acupunct Med 2014;32:242-249.
- Ziegler D, Nowak H, Kempler P, et al. 抗酸化剤α-リポ酸による症候性糖尿病性多発ニューロパシーの治療: メタアナリシス。 Diabet Med 2004;21:114-121.
- Ziegler D, Low PA, Litchy WJ, et al. Efficacy and safety of antioxidant treatment with alpha-lipoic acid over 4 years in diabetic polyneuropathy: The NATHAN 1 trial.糖尿病性神経障害におけるアルファリポ酸による4年間の抗酸化治療の効果と安全性。 桑原 聡、大河原 浩二、原 亨理、他:血糖コントロールがヒト糖尿病神経における軸索興奮性に及ぼす急性効果. Intern Med 2002;41:360-365.
- Peltier A, Goutman SA, Callaghan BC. 痛みを伴う糖尿病性ニューロパチー。 BMJ 2014;348:g1799.
- Soykan I, Sivri B, Sarosiek I, et al. Demography, clinical characteristics, psychological and abuse profiles, treatment, and long-term follow-up of patients with gastroparesis.「胃不全麻痺患者の人口統計学、臨床特性、心理的および虐待のプロファイル、治療、および長期追跡調査」。
- Camilleri M, Bharucha AE, Farrugia G. Epidemiology, mechanisms, and management of diabetic gastroparesis.Dig Dis Sci 1998;43:2398-2404.
- Bharucha AE, Farrugia G. Epidemiology, mechanisms, and management of diabetic gastroparesis. Clin Gastroenterol Hepatol 2011;9:5-12.
- Shin AS, Camilleri M. Diagnostic assessment of diabetic gastroparesis.(「糖尿病性胃不全麻痺の診断評価」). Diabetes 2013;62:2667-2673.
- Hasler WL, Wilson L, Parkman HP, Lee L. Importance of abdominal pain as a symptom in gastroparesis.(「胃不全麻痺における症状としての腹痛の重要性」)。 臨床的要因、疾患の重症度、QOL、胃内停留、薬物使用との関係。 Gastroenterology 2010;138. doi: 10.1016/S0016-5085(10)62131-2.
- Choung RS, Locke GR 3rd, Schleck CD, et al. 一般集団における1型および2型糖尿病の被験者における胃不全麻痺の危険性.
- Maleki D, Locke GR III, Camilleri M, et al. Gastrointestinal tract symptoms among persons with diabetes mellitus in the community.Am J Gastroenterol 2012;107:82-88.
- Locke GR III, Camilleri M, et al. Arch Intern Med 2000;160:2808-2816.
- Bytzer P, Talley NJ, Leemon M, et al. 糖尿病と関連した胃腸症状の有病率。 15,000人の成人を対象とした人口ベースの調査。 また、「糖尿病患者の胃排出と上部消化管症状に関する縦断的研究」(Arch Intern Med 2001;161:1989-1996.
- Jones KL, Russo A, Berry MK, et al.)。
- Gaber AO, Hathaway DK, Abell T, et al. 膵腎移植と腎単独移植における自律神経および胃機能の改善はQOLに寄与する。 自律神経障害による胃排出の障害とは無関係。 糖尿病内科 2008;25:570-577.
- Schvarcz E, Palmer M, Aman J, et al. Physiological hyperglycemia slows gastric emptying in normal subjects and patients with insulin-dependent diabetes mellitus.Diabet Med 2008;25:570-577.
- Miller G, Palmer KR, Smith B, et al. Smoking delays gastric emptying of solids.(喫煙は固形物の胃排出を遅らせる。 Gut 1989;30:50-53.
- Rao AS, Camilleri M. レビュー記事。 メトクロプラミドと遅発性ジスキネジア。
- Patterson D, Abell T, Rothstein R, et al. Donperidone and metoclopramide in the treatment of diabetic patients with symptoms of gastroparesis. Am J Gastroenterol 1999;94:1230-1234.
- Arts J, Holvoet L, Caenepeel P, et al.クリニカルトライアル: 胃不全麻痺におけるボツリヌス毒素の幽門内注入の無作為化対照クロスオーバー試験。 Aliment Pharmacol Ther 2007;26:1251-1258.
- Friedenberg FK, Palit A, Parkman HP, et al. Botulinum toxin A for the treatment of delayed gastric emptying.胃排出遅延の治療のためのボツリヌス毒素A.
- Humanitarian Device Exemption for Enterra Device(エンテラデバイスの人道的機器適用除外)。
- O’Grady G, Egbuji JU, Du P, et al.胃不全麻痺の治療のための高周波胃電気刺激。 メタアナリシス。 World J Surg 2009;33:1693-1701.
- Reddymasu SC, Sarosiek I, McCallum RW. 重症胃不全麻痺。 内科的治療か胃電気刺激か。
- McCallum RW, Dusing RW, Sarosiek I, et al. 胃電気刺激による胃不全麻痺患者の症状改善メカニズム.
- Douloumpakas I, Pyrpasopoulou A, Triantafyllou A, et al. 2型糖尿病患者における筋骨格系障害の有病率: パイロットスタディ。 Hippokratia 2007;11:216-218.
- Rosenbloom AL, Silverstein JH, Lezotte DC. 小児糖尿病における関節可動域の制限は、微小血管疾患のリスク上昇を示す。 N Engl J Med 1981;305;191-194.
- リスターDM、グラハム-ブラウンRAC、バーデンAC. 糖尿病性キーロアースパチーの解決。 Br Med J 1986;293:1537.
Schvarcz E, Palmer M, Aman J, et al. Gastroenterology 1997;113:60-66.
.