酸性とは
酸性は地球上の生物にとって不可欠なものです。 酸は多くの場合、多くの物質の特性、品質、吸収性、溶解性などを決定します。 生物のほとんどすべての生物学的プロセスを担っている酵素も、こうして正しい酸性度でなければ働かないのです。 血液の酸性度のわずかな変動は命取りになります。
pHとは
pH(ポンドス水素)とは、溶液の酸性度またはアルカリ性を示すものです。 pH値は通常0~14の間で変化します。 pH値が0~7の溶液は酸性で、7~14の溶液はアルカリ性です。 酢とコーラのpH値は3以下です。 ソーダと石鹸はpH値が8より高く、pH値7は中性とみなされます。 水道水のpHは、カルシウムが含まれているため、一般に少し高くなります。
私たちの皮膚、植物の基質、栄養培地など、多くの自然環境は弱酸性で、pH値は5~6.5です。 人が好きなものを見てみると、一般的に水のような弱酸性や中性の物質であることがわかります。 植物も弱酸性のものを好みます。
なぜ酸性が重要なのか
酸性は、多くの食物元素の吸収性と溶解性に大きな影響を与えます(図1参照)
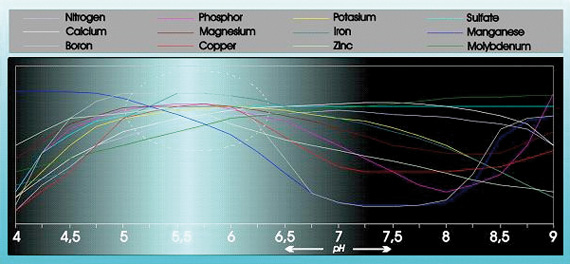
図1
さらに酸性は、構造、有機物質の分解、地中の微細生物に大きな影響を及ぼします。 pHはまた、生育培地中の食物要素、重金属、農薬、その他の微生物が地表から洗い流される方法にも影響します。
pH値が低すぎたり高すぎたりすると、植物に害を与えることがあるので、正しく設定することが重要です。 でも、pHがおかしいときって、どうしたらわかるのでしょうか? それは、経験です。 そこで、どのような症状が見られるかをご紹介します。
pHが低すぎる症状(基質が酸性)
- ほとんどの栄養素が溶けやすく、マンガン、アルミニウム、鉄が過剰になっている可能性があります。
- リン、カリウム、マグネシウム、モリブデンの欠乏は、過度の水洗いで起こることがあります;
- マグネシウムの欠乏、特に冷たい基質で;
- 土は一般的に貧しいです;
- 土の生活が阻害される。
pHが高すぎる(基質がアルカリ性)
- ほとんどの栄養素が溶けにくくなり、カルシウム、鉄、リン酸化合物が沈殿する;
- 特にマンガン、リン酸、鉄が減少するが銅、亜鉛、ホウ素の吸収も減少する。
- 砂質土壌では、pHが高いと有機物の分解がかなり進みます。
何がpHを決定するのか?
溶液中や基質のpH値を決める最も重要な要素の1つは緩衝能力です。 この場合の緩衝能とは、継続的に自己回復する一種のバランスが存在することを意味します。 例えば、pH7の水道水1リットルに酸を1滴入れても、酸性度にはほとんど影響を与えない。 しかし、1リットルの脱塩水(電池水)に1滴の酸を入れると、たちまちpHは大きく下がります。 これは水道水には重炭酸塩が含まれているが、脱ミネラル水には含まれていないからである。 重炭酸塩は、水のpH値が5.5~7.5の場合に最も重要な緩衝物質です。
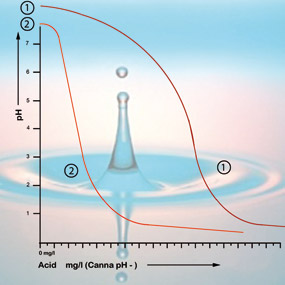 重炭酸塩は溶液中の酸と結合して、二酸化炭素を大気中に放出させます。 このようにして酸が中和され、炭酸水素塩が存在する限り、酸度の変化はわずかです。
重炭酸塩は溶液中の酸と結合して、二酸化炭素を大気中に放出させます。 このようにして酸が中和され、炭酸水素塩が存在する限り、酸度の変化はわずかです。
pH値が5.3の場合、すべての炭酸水素塩は使い果たされ、溶液にはもう緩衝材がありません。 pHは現在不安定で、酸を加えるとすぐに変化してしまいます(図2参照)。 したがって、給餌液を適切な酸性度にするために必要な酸の量は、重炭酸塩の含有量に基づいて計算することができます。 水道水の炭酸水素塩含有量は、一般に水道会社から1リットルあたりのミリグラムで示されている。
緩衝能と基質の酸性度は、その組成と鮮度によって異なる。 有機物、カルシウム、重炭酸塩の有無が一般にpHを決定する。 粘土質は常に炭酸カルシウムを含み、比較的高いpH値で変化しにくく、泥炭や砂質土壌は酸性である。
植物自体も酸性に大きな影響を与える。 根は作物の発育段階、得られる食物、根の温度差、光量などによって、酸性またはアルカリ性のサブスタンスを分泌する。 つまり、根の環境のpHが常に変動する理由がお分かりいただけると思います。
微生物、CO2レベル、藻類の成長も、根環境と養液タンクの酸性度に影響を与えます。
pH値の測定

pH測定は非常に簡単です。 これらは比較的安価ですが、必ずしも正確ではなく、時には1~2pH単位でずれることがあります。 すべてのpHメーターは一般的に高価で、精度はメーターの種類と校正液による定期的な校正に依存します。
サンプルを取る

植物の潅水に使う水のpHは重要ですが、根の周りの酸性度は必須となります。 そのため、pHを測定する際には、良い結果を得るために正しい方法でサンプルを採取することが非常に重要です。 サンプルには、根の環境の年齢酸性度があります。
再循環システムでサンプルを採取してpHを測定するのは簡単で、再循環した給餌液を測定するだけです。
再循環しない基板システムでは、基質(ロックウール、アグロフォームなど)から数カ所で給餌液を引き抜きます。 どこから採取するかについては、専門家が1年1日議論してきました。 私たちは、多くの信頼できる研究所が行っているように、ドリップパースの下とその周辺にある根のある場所からサンプルを採取することをお勧めします。 できるだけ多くの場所から少量のサンプルを採取してください。
 ソイル、ココ、ピートなどの基質では、数カ所から少量の基質を採取します。
ソイル、ココ、ピートなどの基質では、数カ所から少量の基質を採取します。
サンプルの酸性度を測定するには、「1:1.5容量抽出法」が最適です。 培地をかなり強くこねたり絞ったりすると、指の間から水が流れるくらいに湿らせれば、自分で簡単にできます(写真1)。 例えば、250mlのメスビーカーを使います。 メスビーカーに150mlの脱塩水を入れる。 250mlになるまで培地を入れる(写真2)。 よく振って、数時間放置する。 3009>

培地ごとの正しいpH値
基質で栽培する場合、根の環境はpH値5.0~6.4で問題ないでしょう。 多少数値が高くても低くても悪影響はありません。 4以下、8以上でないと悪影響は現れず、4以下ではすぐに根が傷んでしまうことが多い。 また、マンガンや鉄などの重金属は吸収が良いので、植物が中毒を起こす(壊死する)こともあります。 7から8までの値は、植物にとってすぐに有害とはならない。 鉄、リン酸、マンガンなどの栄養素の利用が少なくなり、長期的には欠乏症(クロロシスや発育障害)につながります。
pH値の補正
 もし根環境の酸性度が5~6.4なら栽培環境のpHはOKで補正措置は必要ないのです。 本当に必要なとき以外はpHの補正をしないようにしてください。 植物は穏やかで静かな環境を好みます。 それよりも、酸度が長期にわたってどのように変化するかを観察することが重要である。
もし根環境の酸性度が5~6.4なら栽培環境のpHはOKで補正措置は必要ないのです。 本当に必要なとき以外はpHの補正をしないようにしてください。 植物は穏やかで静かな環境を好みます。 それよりも、酸度が長期にわたってどのように変化するかを観察することが重要である。
酸度の補正は、成長期には硝酸、開花期にはリン酸で給液の酸度を下げ、場合によっては苛性カリ、重炭酸カリウム、カンナリゾットニックで上げることで最も簡単に行うことができます。 使用する溶液のpHが5.0より下がり過ぎないように注意する。 ロックウールでの栽培では、繊維が傷つき、非常に低いpH値で多くのアルカリ性物質が放出されることになります。 また、重炭酸塩がないため、pHのコントロールが難しくなります
根の環境が高いpHになるのは、重炭酸塩が蓄積していることが原因です。 これを改善するには、20%の排水を維持するか、より酸性の溶液ですすぎます。
添加した溶液と基質の供給溶液の両方からのpH測定値を記録しておくと便利です。 3009>
- タンパク質分解酵素は酸性環境(胃液)、炭水化物分解酵素はアルカリ性環境(唾液)を必要とします。
- 溶液の酸性度は、水素イオン(=酸性)と水酸化物イオン(=アルカリ性)の比率で決まります。
- 植物がこれらの分子を吸収できるようにプロトンを分泌しなければならないため、不足が発生することがあります。 pHの低い栽培用培地は、すでに非常に多くのプロトンを持っています。 また、プロトンが基質中の培地から分子をはじき出すので、これらの要素は洗い流されてしまいます。
- 重炭酸塩は、カルシウムと結合すると、スケールに関与する物質です。 炭酸水素塩は、ナトリウムと組み合わせて、過剰な胃酸に対抗するための医薬品(アルカセルザー)に使用されています。
- 一部の研究所では、炭酸水素塩硬度を用いて作業を行っています。 例えば、重炭酸硬度が11の場合、1リットルの水には(11×21.8)が含まれています。8=)240mg/リットルの重炭酸塩が含まれています。
-
砂地: 草地 pH 4.6 … 5.2 ビル地 pH 5.0 … 5.0。6 粘土: 海の粘土 pH 6.0 … 7.2 川の粘土 pH 6.2 … 6.4 泥炭: 未処理 pH 4.1 … 6.40 - もし藻類が著しく増殖した場合、二酸化炭素が溶液から除去されるため、pHは上昇します。 バクテリアは、ある種の窒素を酸性化するように変化させることができます。
- ソーダはナトリウムを含んでおり、植物はごく少量のナトリウムしか必要としないため、少量しか使用しないでください。 高濃度のナトリウムは植物にダメージを与えることを忘れないでください。
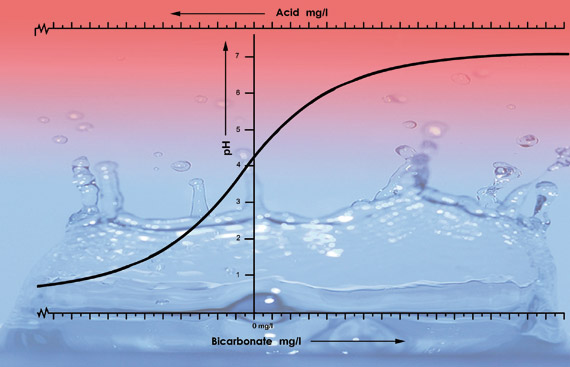
重炭酸濃度の異なる各地の水道水のpH値のイラストです。 各水種のサンプル100リットルに硝酸(38%)を33mlずつ加えました。 pH5.3を境にpH曲線が早く下がるのは、この種の水では酸がすべての重炭酸塩を中和してしまうからです。 pH5.3以下では、酸性度が急速に上昇します。
再循環システムでは、pH値は廃水処理システムよりも変動しやすくなっています。 EC、ppmの値も同様です。 EC、pH、ppmについてより詳しく知りたい方は、AQUAを使ったEC、pH、ppmのすべて
の記事をご覧ください。