Voltaic (Galvanic) Cells
Aby zilustrować podstawowe zasady działania ogniwa galwanicznego, rozważmy reakcję metalicznego cynku z jonem miedziowym (Cu2+), dając metal miedziowy i jon Zn2+. Zrównoważone równanie chemiczne jest następujące:
Możemy wywołać tę reakcję wkładając pręt cynkowy do wodnego roztworu siarczanu miedzi(II). W miarę przebiegu reakcji cynkowy pręt rozpuszcza się i powstaje masa metalicznej miedzi. Zmiany te zachodzą spontanicznie, ale cała uwolniona energia występuje raczej w postaci ciepła niż w postaci, która może być wykorzystana do wykonania pracy.
Tę samą reakcję można przeprowadzić za pomocą ogniwa galwanicznego zilustrowanego na rysunku \(\PageIndex{3a}). Aby zmontować ogniwo, do zlewki zawierającej 1 M roztwór jonów Cu2+ wkłada się pasek miedzi, a do innej zlewki zawierającej 1 M roztwór jonów Zn2+ wkłada się pasek cynku. Oba metalowe paski, które służą jako elektrody, są połączone przewodem, a komory są połączone mostkiem solnym, rurką w kształcie litery U włożoną do obu roztworów, która zawiera stężony ciekły lub zżelowany elektrolit. Jony w mostku solnym są tak dobrane, aby nie zakłócały reakcji elektrochemicznej poprzez utlenianie lub redukcję lub poprzez tworzenie osadu lub kompleksu; powszechnie stosowanymi kationami i anionami są odpowiednio Na+ lub K+ i NO3- lub SO42-. (Jony w mostku solnym nie muszą być takie same jak te w parze redoks w każdym z przedziałów). Gdy obwód jest zamknięty, zachodzi spontaniczna reakcja: metaliczny cynk utlenia się do jonów Zn2+ na elektrodzie cynkowej (anodzie), a jony Cu2+ redukują się do metalu Cu na elektrodzie miedzianej (katodzie). W miarę postępu reakcji pasek cynku rozpuszcza się, a stężenie jonów Zn2+ w roztworze Zn2+ wzrasta; jednocześnie pasek miedzi przybiera na masie, a stężenie jonów Cu2+ w roztworze Cu2+ maleje (rys. Przeprowadziliśmy więc tę samą reakcję, którą przeprowadziliśmy używając pojedynczej zlewki, ale tym razem półreakcje utleniająca i redukcyjna są od siebie fizycznie oddzielone. Elektrony, które są uwalniane na anodzie, przepływają przez drut, wytwarzając prąd elektryczny. Ogniwa galwaniczne przekształcają zatem energię chemiczną w energię elektryczną, która może być następnie wykorzystana do wykonania pracy.
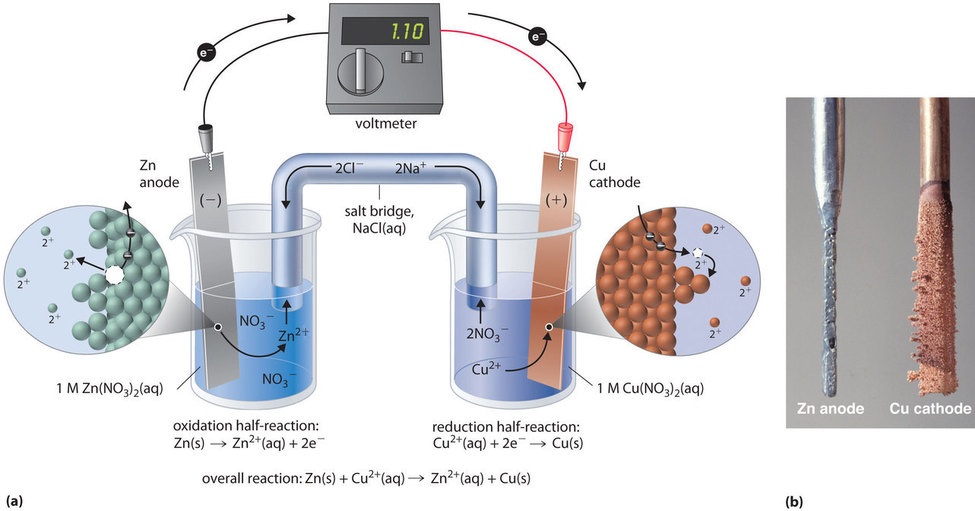
Elektrolit w mostku solnym służy dwóm celom: uzupełnia obwód, przenosząc ładunek elektryczny i utrzymuje neutralność elektryczną w obu roztworach, umożliwiając jonom migrację między nimi. Tożsamość soli w mostku solnym jest nieistotna, o ile jony składowe nie wchodzą w reakcję lub nie ulegają reakcji redoks w warunkach pracy ogniwa. Bez takiego połączenia całkowity ładunek dodatni w roztworze Zn2+ wzrastałby w miarę rozpuszczania się metalu cynku, a całkowity ładunek dodatni w roztworze Cu2+ malałby. Mostek solny umożliwia neutralizację ładunków poprzez przepływ anionów do roztworu Zn2+ i przepływ kationów do roztworu Cu2+. W przypadku braku mostka solnego lub innego podobnego połączenia reakcja szybko ustałaby, ponieważ nie można by utrzymać neutralności elektrycznej.
Woltomierz może być użyty do pomiaru różnicy potencjałów elektrycznych między dwoma przedziałami. Otwarcie przełącznika łączącego przewody do anody i katody uniemożliwia przepływ prądu, więc nie zachodzi reakcja chemiczna. Jednak przy zamkniętym przełączniku obwód zewnętrzny jest zamknięty i prąd elektryczny może płynąć od anody do katody. Potencjał (E_{cell}}) ogniwa, mierzony w woltach, jest różnicą potencjałów elektrycznych pomiędzy dwiema półreakcjami i jest związany z energią potrzebną do poruszenia naładowanej cząstki w polu elektrycznym. W ogniwie, które opisaliśmy, woltomierz wskazuje potencjał 1,10 V (rysunek rzedu). Ponieważ elektrony z półreakcji utleniania są uwalniane na anodzie, anoda w ogniwie galwanicznym jest naładowana ujemnie. Katoda, która przyciąga elektrony, jest naładowana dodatnio.
Nie wszystkie elektrody ulegają przemianie chemicznej podczas reakcji redoks. Elektroda może być wykonana z obojętnego, wysoce przewodzącego metalu, takiego jak platyna, aby zapobiec jej reakcji podczas procesu redoks, w którym nie pojawia się ona w ogólnej reakcji elektrochemicznej. Zjawisko to jest zilustrowane w przykładzie \(\PageIndex{1}}).
Ogniwo galwaniczne (woltaiczne) przekształca energię uwolnioną w wyniku spontanicznej reakcji chemicznej w energię elektryczną. Ogniwo elektrolityczne zużywa energię elektryczną z zewnętrznego źródła do napędzania nie spontanicznej reakcji chemicznej.
Przykład
Chemik skonstruował ogniwo galwaniczne składające się z dwóch zlewek. Jedna zlewka zawiera pasek cyny zanurzony w wodnym kwasie siarkowym, a druga zawiera elektrodę platynową zanurzoną w wodnym kwasie azotowym. Oba roztwory połączone są mostkiem solnym, a elektrody połączone są drutem. Zaczyna płynąć prąd, a na elektrodzie platynowej pojawiają się pęcherzyki gazu. Zachodząca spontaniczna reakcja redoks jest opisana następującym zrównoważonym równaniem chemicznym:
Dla tego ogniwa galwanicznego,
- napisz półreakcję, która zachodzi na każdej elektrodzie.
- wskaż, która elektroda jest katodą, a która anodą.
- wskazać, która elektroda jest elektrodą dodatnią, a która ujemną.
Dane: ogniwo galwaniczne i reakcja redoks
Pytanie o: półreakcje, tożsamość anody i katody oraz przyporządkowanie elektrody jako dodatniej lub ujemnej
Strategia:
- Zidentyfikuj półreakcję utleniania i półreakcję redukcji. Następnie zidentyfikuj anodę i katodę na podstawie półreakcji, która zachodzi na każdej z elektrod.
- Na podstawie kierunku przepływu elektronów przypisz każdej z elektrod status dodatniej lub ujemnej.
Rozwiązanie
A W półreakcji redukcji azotan jest redukowany do tlenku azotu. (Tlenek azotu będzie następnie reagował z tlenem w powietrzu tworząc NO2, z charakterystycznym czerwono-brązowym kolorem). W pół-reakcji utleniania, metaliczna cyna jest utleniana. Półreakcje odpowiadające rzeczywistym reakcjom, które zachodzą w układzie są następujące:
redukcja:
utlenianie: ≥5993>
W ten sposób azotan jest redukowany do NO, natomiast elektroda cynowa jest utleniana do Sn2+.
Ponieważ reakcja redukcji zachodzi na elektrodzie Pt, jest ona katodą. I odwrotnie, reakcja utleniania zachodzi na elektrodzie cynowej, więc jest ona anodą.
B Elektrony przepływają z elektrody cynowej przez drut do elektrody platynowej, gdzie przenoszą się na azotany. Obwód elektryczny jest zakończony mostkiem solnym, który pozwala na dyfuzję kationów w kierunku katody i anionów w kierunku anody. Ponieważ elektrony płyną z elektrody cynowej, musi ona być elektrycznie ujemna. Natomiast elektrony płyną w kierunku elektrody Pt, więc elektroda ta musi być elektrycznie dodatnia.
Ćwiczenie rzedziałowe
Rozważmy proste ogniwo galwaniczne składające się z dwóch zlewek połączonych mostkiem solnym. Jedna zlewka zawiera roztwór ∗MnO_4^{-}} w rozcieńczonym kwasie siarkowym i ma elektrodę Pt. W drugiej zlewce znajduje się roztwór ^Sn^{2+}} w rozcieńczonym kwasie siarkowym, również z elektrodą Pt. Gdy obie elektrody są połączone przewodem, płynie prąd i zachodzi spontaniczna reakcja, którą opisuje następujące zrównoważone równanie chemiczne:
Dla tego ogniwa galwanicznego,
- zapisz półreakcję, która zachodzi na każdej z elektrod.
- wskazać, która elektroda jest katodą, a która anodą.
- wskazać, która elektroda jest dodatnia, a która ujemna.
Odpowiedź a
^Sn^{2+}(aq)} &→ ∑ ∑ce{Sn^{4+}(aq) + 2e^{-}} \Odpowiedź b
Elektroda Pt w roztworze nadmanganianu jest katodą, a elektroda w roztworze cyny jest anodą.
Odpowiedź c
Katoda (elektroda w zlewce zawierającej roztwór nadmanganianu) jest dodatnia, a anoda (elektroda w zlewce zawierającej roztwór cyny) jest ujemna.
.