Historia
W początku 1900s, badacze odkryli, że włączenie dużych ilości surowych białek jaj w dietach u szczurów produkowane objawy toksyczności. W 1926 r. Boas określił te objawy toksyczności jako zespół urazu spowodowanego białkiem jaja. Do głównych objawów należało ciężkie zapalenie skóry, utrata włosów i brak koordynacji mięśniowej. Boas zauważył również, że drożdże, wątroba i kilka innych produktów spożywczych zawierały substancję, która chroniła szczury przed zespołem uszkodzenia białka jaja. Poszukiwanie tego czynnika ochronnego doprowadziło do odkrycia w 1936 roku biotyny.
Biochemiczne podstawy zespołu uszkodzenia białka jaja zostały szybko wyjaśnione, gdy surowe białka jaj znaleziono zawierać glikoproteinę awidyna, która ma niezwykłe powinowactwo do biotyny. Wiązanie biotyna-awidyna jest zasadniczo nieodwracalne; w rezultacie biotyna nie jest uwalniana z pożywienia, a kompleks biotyna-awidyna jest tracony z kałem. Ostatecznym krokiem w rozwiązaniu zagadki zespołu uszkodzenia białka jaja było wykazanie, że zespół ten można zapobiec przez ogrzewanie białek jaj, proces, który denaturuje awidynę i niszczy jej powinowactwo do biotyny.
Struktura
Biotyna jest bicykliczną cząsteczką składającą się z pierścienia ureido połączonego z pierścieniem tetrahydrotiofenowym.
Pierścień ureido jest zaangażowany w wysokie powinowactwo wiązania biotyny do awidyny, glikoproteiny znalezionej w białku jaja. Podstawnik kwasu walerianowego jest dołączony do jednego z 2 atomów węgla pierścienia tetrahydrotiofenowego. Poprzez tę grupę karboksylową biotyna jest połączona kowalencyjnie z grupą β-aminową lizyny w 5 karboksylazach, które odgrywają krytyczną rolę w metabolizmie pośrednim.
FUNKCJE BIOTYNY
Oprócz dobrze znanej roli biotyny jako kofaktora w reakcjach karboksylacji, ostatnie badania wykazały, że biotyna odgrywa ważną rolę w regulacji ekspresji genów i funkcji immunologicznych.
Reakcje karboksylacji zależne od biotyny
Biotyna funkcjonuje jako koenzym w reakcjach karboksylacji obejmujących metabolizm lipidów, glukozy i aminokwasów. Istnieje 5 karboksylaz zależnych od biotyny, z których każda występuje jako nieaktywna apoforma. Enzym syntetazy holokarboksylazy (HCLS ) katalizuje dodanie biotyny (biotynowanie) do nieaktywnej apoformy, co prowadzi do powstania aktywnej karboksylazy. We wszystkich 5 karboksylazach biotyna funkcjonuje jako koenzym lub grupa prostetyczna, która służy jako nośnik dla CO2 w wieloetapowej reakcji.
Pięć karboksylaz zależnych od biotyny i ich funkcje opisano krótko poniżej:
Karboksylaza pirogronianowa (PC) katalizuje powstawanie oksalooctanu z pirogronianu, etap ważny w cyklu TCA, glukoneogenezie i lipogenezie; brak tej funkcji może prowadzić do hipoglikemii, ketozy i kwasicy mleczanowej.
Karboksylaza propionyl-CoA (PCC) katalizuje konwersję propionyl CoA do metylomalonyl CoA, który z kolei izomeryzuje do sukcynylo CoA i wchodzi do cyklu TCA (Kreb’a). PCC jest ważny w metabolizmie nieparzystych łańcuchów kwasów tłuszczowych oraz aminokwasów: izoleucyny, waliny, metioniny i treoniny. Brak tej funkcji enzymu może prowadzić do kwasicy propionowej. Poziomy PCC w limfocytach jest czułym wskaźnikiem statusu biotyny.
3-Methylcrotonoyl-CoA carboxylase (MCC) jest zaangażowany w katabolizm aminokwasu rozgałęzionego, leucyny. Brak biotyny może prowadzić do przeniesienia produktów katabolizmu leucyny na alternatywną ścieżkę kataboliczną prowadzącą do produkcji kwasu 3-hydoksyizowalerianowego, który jest następnie wydalany z moczem.
Karboksylaza acetylo-CoA I (ACC I) katalizuje konwersję acetylo-CoA do malonylo-CoA, w cytozolu, krok ważny w syntezie lipidów.
Karboksylaza acetylo-CoA II (ACC II), katalizuje identyczną reakcję w mitochondriach; powstały malonylo-CoA odgrywa rolę regulacyjną w utlenianiu kwasów tłuszczowych.
ACC I jest enzymem cytozolowym; pozostałe karboksylazy znajdują się w mitochondriach.
Kliniczne objawy niedoboru biotyny mogą również wystąpić w wyniku zaburzeń genetycznych powodujących niedobór enzymu syntetazy holokarboksylazy lub niedobór poszczególnych enzymów karboksylazy.
Ekspresja genów
Badania wykazały, że biotynylacja histonów może odgrywać rolę w ekspresji genów. Wiele miejsc, które wiążą się z biotyną zostało zidentyfikowanych w ludzkich histonach. Biotyna może również wpływać na ekspresję genów poprzez inne mechanizmy. W komórkach ludzkich znanych jest kilka tysięcy genów zależnych od biotyny. Niektóre z genów, na które wpływa biotyna, obejmują te kodujące enzymy zaangażowane w metabolizm glukozy (np. glukokinaza), cytokiny takie jak interleukina-2 i receptor insuliny.
Funkcja immunologiczna
Badania sugerują rolę biotyny w produkcji przeciwciał, funkcji makrofagów, różnicowania limfocytów T i B, jak również normalnej funkcji naturalnych komórek zabójczych. Nawracające infekcje, zwłaszcza grzybicze są powszechne u pacjentów z niedoborem biotyny.
Rola biotyny w wysokiej dawce biotyny-odpowiedzialne warunki neurologiczne
Biotin-thiamin-responsive basal ganglia disease (BTBGD) jest rzadkim stanem neurologicznym, który może wystąpić z drgawkami i encefalopatii postępującej do śpiączki i śmierci. Biotyna w dużych dawkach (5-10 mg/kg/dobę) była stosowana z powodzeniem w leczeniu tego stanu, ale mechanizm działania nie jest znany.
Ostatnio, leczenie wysoką dawką biotyny (100-300 mg/dobę) zostało znalezione w celu poprawy objawów w podgrupie pacjentów ze stwardnieniem rozsianym. Uważa się, że poprawa objawów neurologicznych może wiązać się z poprawą produkcji mieliny wtórnej do efektu wysokiej dawki biotyny na syntezę długołańcuchowych kwasów tłuszczowych.
Rola biotyny u osób z zaburzeniami włosów, skóry i paznokci
Suplementy biotyny są szeroko stosowane przez osoby mające nadzieję na uzyskanie zdrowszych włosów, skóry i paznokci. Istnieją jednak ograniczone dowody na skuteczność biotyny w tym zakresie. Biotyna w dużych dawkach okazała się pomocna w dwóch rzadkich schorzeniach: rodzinnym zespole nieułożonych włosów i zespole łamliwych paznokci. W badaniu przeprowadzonym na 541 kobietach z problemem wypadania włosów stwierdzono niski poziom biotyny w surowicy u 38% pacjentek. Autor stwierdził, że etiologia wypadania włosów jest wieloczynnikowa, a suplementację biotyny można rozważyć, jeśli wykazano niedobór biotyny i wykluczono inne przyczyny.
Źródła biotyny
Biotyna jest obecna w szerokiej gamie pokarmów (mięso, nabiał, warzywa, nasiona i orzechy), a także jest produkowana przez bakterie jelitowe. Ponadto, znaczna część osób może spożywać suplementy diety zawierające biotynę.
Fizjologia biotyny
Ingested biotyna jest obecna w formach wolnych i związanych z białkami. Formy związane z białkami są trawione przez proteazy i peptydazy przewodu pokarmowego, tworząc biocytynę i biotyny-oligopeptydy. Wolna biotyna jest uwalniana z biocytyny i biotyny-oligopeptydów pod wpływem działania biotynidazy jelitowej. Wolna biotyna jest następnie wchłaniana w jelicie cienkim za pośrednictwem zależnego od Na+ mechanizmu transportowego, który przenosi również dwa inne składniki odżywcze, kwas pantotenowy i liponian i stąd znany jest jako sodozależny transporter multiwitaminowy (SMVT). Ludzki gen SMVT zlokalizowany jest na chromosomie 2p23. Aktywność SMVT jest regulowana przez poziom biotyny; jest ona podwyższona przy jej niedoborze i obniżona przy nadmiernej suplementacji biotyny. Biotyna syntetyzowana bakteryjnie występuje w postaci niezwiązanej i jest wchłaniana w jelicie grubym w podobnym mechanizmie z udziałem nośnika. Połączone dzienne wydalanie biotyny w moczu i stolcu przekracza spożycie biotyny w diecie, co sugeruje ważną rolę odgrywaną przez florę jelitową jako źródło biotyny.
Po wchłonięciu, biotyna staje się dostępna dla różnych procesów biotynylacji. Biotyna wiąże się z każdą z 5 apokarboksylaz w celu utworzenia odpowiedniej holokarboksylazy (patrz obrazek poniżej) poprzez działanie enzymu syntetazy holokarboksylazy.
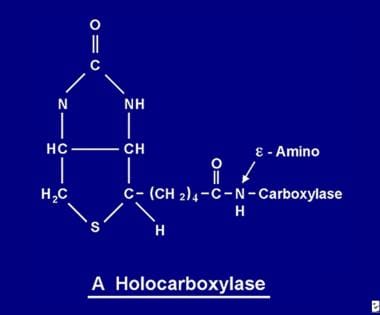 Cząsteczka biotyny jest związana z białkiem przez wiązanie peptydowe z grupą e-aminową apokarboksylazy w celu utworzenia holokarboksylazy.
Cząsteczka biotyny jest związana z białkiem przez wiązanie peptydowe z grupą e-aminową apokarboksylazy w celu utworzenia holokarboksylazy. Recykling biotyny
Po wykonaniu przez enzym holokarboksylazy kilku karboksylacji jest on wychwytywany przez lizosomy komórkowe. W lizosomach różne enzymy proteolityczne degradują holokarboksylazę, tworząc biocytynę, która z kolei jest hydrolizowana przez enzym biotynidazę, tworząc biotynę i lizynę. Wolna biotyna jest następnie dostępna do przyłączenia do apokarboksylazy w celu utworzenia nowej cząsteczki holokarboksylazy. Ten proces recyklingu nie jest w 100% wydajny. W rezultacie, niewielkie ilości wolnej biotyny (i trochę biocytyny) wydostają się z tego cyklu i są tracone z kałem i moczem. Z tego powodu biotyna musi być dostarczana do jelit, aby uzupełnić biotyny utracone z organizmu. Kroki zaangażowane w recykling biotyny – jej wejście do jelita, jej absorpcja, jej włączenie do holokarboksylaz, które z kolei są rozbijane w celu uwolnienia wolnej biotyny stanowią cykl biotyny i jest przedstawiony na poniższym obrazku.
Enzym biotynidaza jest niezbędna do recyklingu biotyny i osoby z niedoborem biotynidazy będzie zatem obecne z oznakami i objawami niedoboru biotyny.
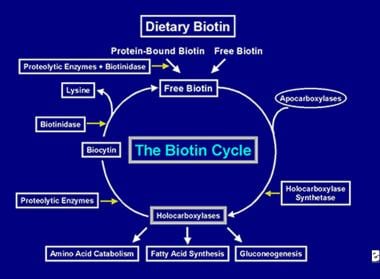 Przedstawienie przepływu biotyny w cyklu biotyny.
Przedstawienie przepływu biotyny w cyklu biotyny. POWODY NABYCIA BIOTYNY
Jak wspomniano wcześniej, biotyna jest szeroko dostępna w żywności, jest również produkowana przez florę jelitową i jest szeroko przetwarzana w organizmie z pomocą enzymu biotynidazy, stąd niedobór biotyny u zdrowych osób stosujących normalną dietę jest rzadki. Warunki, które mogą prowadzić do niedoboru biotyny są opisane poniżej:
Nadmierne spożycie surowych białek jaj: Awidyna w surowych białek jaj ma wysokie powinowactwo do biotyny, co czyni go niedostępnym dla absorpcji. Ciepło niszczy awidynę, więc ci, którzy jedzą gotowane jajka, nie są narażeni na niedobór biotyny. Surowe białka jaj prowadzą do niedoboru biotyny tylko wtedy, gdy są spożywane w nadmiernych ilościach (być może tuzin lub więcej dziennie).
Totalne żywienie pozajelitowe bez suplementacji biotyny: Zgłoszono kilka przypadków niedoboru biotyny u pacjentów otrzymujących długotrwałe leczenie całkowitym żywieniem pozajelitowym (TPN) bez dodatku biotyny. Dlatego wszyscy pacjenci otrzymujący TPN muszą również otrzymywać biotynę w zalecanej dawce dobowej, zwłaszcza jeśli przewiduje się, że terapia TPN będzie trwała dłużej niż 1 tydzień. Obecnie wszystkie apteki szpitalne zawierają biotynę w preparatach TPN.
Stosowanie preparatów dla niemowląt z nieodpowiednią ilością biotyny: Niedobór biotyny został zgłoszony u niemowląt otrzymujących hipoalergiczne preparaty.
Przewlekłe leczenie przeciwdrgawkowe: Długotrwałe stosowanie leków przeciwdrgawkowych, fenobarbital, fenytoina, prymidon i karbamazepina, zostały powiązane z niedoborem biotyny. Możliwe mechanizmy obejmują zahamowanie wchłaniania biotyny przez błonę śluzową jelita, przyspieszony katabolizm biotyny oraz upośledzone wchłanianie zwrotne biotyny przez nerki. W związku z tym sugeruje się uzupełnianie biotyny u pacjentów leczonych lekami przeciwdrgawkowymi, których stosowanie jest związane z niedoborem biotyny.
Przedłużona doustna antybiotykoterapia: Przedłużone stosowanie doustnych antybiotyków było związane z niedoborem biotyny. Inhibicja flory jelitowej, która produkuje biotynę jest przypuszczalnie podstawą do niedoboru biotyny. Innym możliwym mechanizmem może być wywołany antybiotykami przerost bakterii, które zużywają biotynę.
Palenie tytoniu i przewlekły alkoholizm: Badania wykazały, że palenie papierosów może przyspieszać katabolizm biotyny, szczególnie u kobiet. Przewlekły alkoholizm może powodować jelitowe złe wchłanianie biotyny.
Zespół krótkiego jelita i nieswoiste choroby zapalne jelit: Osoby z zespołem krótkiego jelita i chorobą zapalną jelit są również narażone na ryzyko niedoboru biotyny w wyniku jelitowego złego wchłaniania biotyny.
Marginalny niedobór biotyny w czasie ciąży i laktacji: Ostatnie badania wykazały obniżony poziom biotyny u znacznego odsetka kobiet ciężarnych i karmiących. Istnieją obawy, że marginalny niedobór biotyny podczas ciąży może być teratogenny, a niektórzy eksperci zalecają wyższe spożycie biotyny przez kobiety w ciąży.
Część wrodzonych błędów metabolizmu biotyny może również prowadzić do manifestacji niedoboru biotyny.
Niedobór syntetazy holokarboksylazy (HCLS) jest również zaburzeniem dziedziczonym autosomalnie recesywnie i może być zdiagnozowany prenatalnie. Jak omówiono wcześniej, enzym HCLS jest wymagany do biotynylacji enzymów apokarboksylazy do aktywnych form holokarboksylazy, dlatego niedobór prowadzi do niedoboru wielu karboksylaz. U niemowląt z tym zaburzeniem w pierwszych miesiącach życia występują: kwasica, hiperamonemia, hipotonia, drgawki i opóźnienie rozwoju. Mutacje w genie HCLS powodują niedobór HCLS.
Ponieważ zarówno niedobór biotynidazy jak i HCLS prowadzi do obniżenia poziomu karboksylaz zależnych od biotyny, te dwa stany zostały również sklasyfikowane jako niedobór wielu karboksylaz. Głęboki niedobór biotynidazy był wcześniej znany jako wczesny niedobór wielokrotnej karboksylazy, częściowy niedobór biotynidazy jako późny lub młodzieńczy niedobór wielokrotnej karboksylazy i niedobór HCLS jako noworodkowy lub wczesny niedobór wielokrotnej karboksylazy.
Rzadko, izolowane niedobory każdego z pięciu indywidualnych karboksylaz zależnych od biotyny mogą również wystąpić.
Niedobór biotyny spowodowany defektem w transporcie biotyny został również opisany.
Bez względu na etiologię niedoboru biotyny, objawy kliniczne są podobne. Jednak wiek zachorowania, tempo rozwoju objawów i kolejność ich pojawiania się mogą być bardzo różne. Wszystkie mechanizmy odpowiedzialne za rozwój objawów nie zostały ustalone.
.