Células Voltaicas (Galvânicas)
Para ilustrar os princípios básicos de uma célula galvânica, vamos considerar a reacção do zinco metálico com o ião cúprico (Cu2+) para dar cobre metálico e ião Zn2+. A equação química equilibrada é a seguinte:
\
Podemos provocar esta reacção inserindo um bastão de zinco numa solução aquosa de sulfato de cobre(II). À medida que a reação prossegue, o bastão de zinco dissolve-se, e uma massa de cobre metálico forma-se. Estas alterações ocorrem espontaneamente, mas toda a energia libertada é na forma de calor e não numa forma que pode ser usada para fazer trabalho.
Esta mesma reação pode ser realizada usando a célula galvânica ilustrada na Figura \PageIndex{3a}}. Para montar a célula, uma tira de cobre é inserida num copo que contém uma solução de 1 M de iões Cu2+, e uma tira de zinco é inserida num copo diferente que contém uma solução de 1 M de iões Zn2+. As duas tiras metálicas, que servem como eléctrodos, são ligadas por um fio, e os compartimentos são ligados por uma ponte salina, um tubo em U inserido em ambas as soluções que contém um líquido concentrado ou electrólito gelificado. Os íons na ponte de sal são selecionados de forma que não interfiram na reação eletroquímica por serem oxidados ou reduzidos ou por formarem um precipitado ou complexo; os cátions e ânions comumente usados são Na+ ou K+ e NO3- ou SO42-, respectivamente. (Os iões na ponte de sal não têm de ser iguais aos do casal redox em qualquer dos compartimentos). Quando o circuito é fechado, ocorre uma reação espontânea: o zinco metálico é oxidado a íons Zn2+ no eletrodo de zinco (o ânodo), e os íons Cu2+ são reduzidos a Cu metálico no eletrodo de cobre (o cátodo). À medida que a reação progride, a tira de zinco dissolve-se e a concentração de íons Zn2+ na solução de Zn2+ aumenta; simultaneamente, a tira de cobre ganha massa e a concentração de íons Cu2+ na solução de Cu2+ diminui (Figura \PageIndex{3b}}). Assim, realizamos a mesma reação que fizemos com um único béquer, mas desta vez as semi-reações oxidativas e redutoras estão fisicamente separadas uma da outra. Os elétrons que são liberados no ânodo fluem através do fio, produzindo uma corrente elétrica. As células galvânicas, portanto, transformam energia química em energia elétrica que pode então ser usada para fazer trabalho.
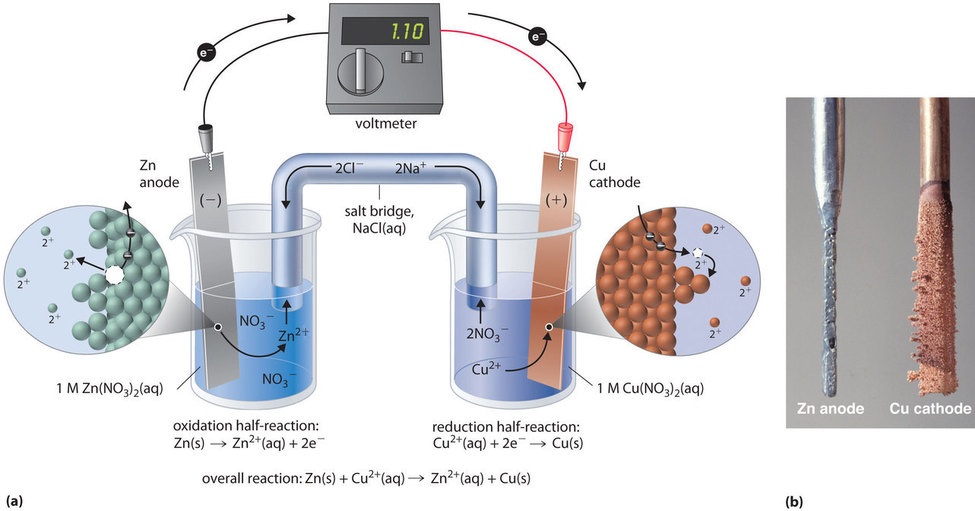
O eletrólito na ponte de sal serve para dois propósitos: ele completa o circuito carregando carga elétrica e mantém a neutralidade elétrica em ambas as soluções, permitindo que os íons migrem entre elas. A identidade do sal em uma ponte de sal não é importante, desde que os íons componentes não reajam ou sofram uma reação redox sob as condições de operação da célula. Sem essa ligação, a carga positiva total na solução Zn2+ aumentaria à medida que o metal de zinco se dissolvesse e a carga positiva total na solução Cu2+ diminuiria. A ponte de sal permite que as cargas sejam neutralizadas por um fluxo de ânions para a solução Zn2+ e um fluxo de cátions para a solução Cu2+. Na ausência de uma ponte de sal ou alguma outra conexão similar, a reação cessaria rapidamente porque a neutralidade elétrica não poderia ser mantida.
Um voltímetro pode ser usado para medir a diferença de potencial elétrico entre os dois compartimentos. A abertura do interruptor que liga os fios ao ânodo e ao cátodo impede que a corrente flua, de modo que não ocorra nenhuma reacção química. Com o interruptor fechado, porém, o circuito externo é fechado e uma corrente elétrica pode fluir do ânodo para o cátodo. O potencial (E_célula) da célula, medido em volts, é a diferença de potencial elétrico entre as duas meias reações e está relacionado com a energia necessária para mover uma partícula carregada em um campo elétrico. Na célula que descrevemos, o voltímetro indica um potencial de 1,10 V (Figura {3a)). Como os elétrons da semi-reação de oxidação são liberados no anodo, o anodo em uma célula galvânica é carregado negativamente. O cátodo, que atrai elétrons, é carregado positivamente.
Nem todos os elétrons passam por uma transformação química durante uma reação redox. O eletrodo pode ser feito a partir de um metal inerte e altamente condutor, como a platina, para evitar que ele reaja durante um processo redox, onde ele não aparece na reação eletroquímica geral. Este fenómeno é ilustrado em Exemplo \(\PageIndex{1}}).
Uma célula galvânica (voltaica) converte a energia libertada por uma reacção química espontânea em energia eléctrica. Uma célula eletrolítica consome energia elétrica de uma fonte externa para conduzir uma reação química não espontânea.
Exemplo \(\PageIndex{1}})
Um químico construiu uma célula galvânica composta por dois copos. Um copo contém uma tira de estanho imersa em ácido sulfúrico aquoso e o outro contém um eléctrodo de platina imerso em ácido nítrico aquoso. As duas soluções são ligadas por uma ponte de sal e os eléctrodos são ligados por um fio. A corrente começa a fluir, e bolhas de um gás aparecem no eletrodo de platina. A reação redox espontânea que ocorre é descrita pela seguinte equação química balanceada:
Para esta célula galvânica,
- escrever a meia reação que ocorre em cada eletrodo.
- indicar qual eletrodo é o cátodo e qual é o ânodo.
- indicar qual eletrodo é o eletrodo positivo e qual é o negativo.
Dado: célula galvânica e reação redox
Passado para: semi-reações, identidade do ânodo e do cátodo, e atribuição do eletrodo como positivo ou negativo
Estratégia:
- Identificar a semi-reação de oxidação e a semi-reação de redução. Depois identificar o ânodo e o cátodo a partir da semi-reacção que ocorre em cada eléctrodo.
- No sentido do fluxo de electrões, atribuir a cada eléctrodo como positivo ou negativo.
Solução
A Na semi-reacção de redução, o nitrato é reduzido a óxido nítrico. (O óxido nítrico reagiria então com oxigénio no ar para formar NO2, com a sua característica cor castanho-avermelhada). Na semi-reacção de oxidação, o estanho metálico é oxidado. As semi-reacções correspondentes às reacções reais que ocorrem no sistema são as seguintes:
redução: \
oxidação: \
Assim o nitrato é reduzido a NO, enquanto o eléctrodo de estanho é oxidado a Sn2+.
Porque a reacção de redução ocorre no eléctrodo Pt, é o cátodo. Ao contrário, a reação de oxidação ocorre no eletrodo de estanho, portanto é o ânodo.
B Os elétrons fluem do eletrodo de estanho através do fio para o eletrodo de platina, onde eles se transferem para o nitrato. O circuito elétrico é completado pela ponte de sal, que permite a difusão dos cátions em direção ao cátodo e dos ânions em direção ao ânodo. Como os elétrons fluem do eléctrodo de estanho, ele deve ser eletricamente negativo. Em contraste, os elétrons fluem em direção ao eletrodo Pt, de modo que o eletrodo deve ser eletricamente positivo.
Exercício \(\PageIndex{1}})
Considerar uma célula galvânica simples composta por dois copos conectados por uma ponte salina. Um béquer contém uma solução de {MnO_4^{-}} em ácido sulfúrico diluído e tem um eléctrodo de Pt. O outro béquer contém uma solução de ácido sulfúrico diluído, também com um eléctrodo de Pt. Quando os dois eletrodos são conectados por um fio, a corrente flui e ocorre uma reação espontânea que é descrita pela seguinte equação química balanceada:
Para esta célula galvânica,
- escrever a meia reação que ocorre em cada eletrodo.
- indicar qual eletrodo é o cátodo e qual é o ânodo.
- indicar qual eletrodo é positivo e qual é negativo.
responder a
\ce{Sn^{2+}(aq)} &→ {Sn^{4+}(aq) + 2e^{-}} \5993> Resposta b
O eletrodo Pt na solução de permanganato é o cátodo; o da solução de estanho é o anodo.
Resposta c
O cátodo (eletrodo no copo que contém a solução de permanganato) é positivo, e o anodo (eletrodo no copo que contém a solução de estanho) é negativo.