A capacidade de drenar completamente a cavidade torácica, quebrar localizações de fluido pleural, visualizar completamente todos os aspectos do espaço pleural e evitar a morbidade de uma toracotomia tornou a toracoscopia atractiva no tratamento de empiema e hemotórax.
Seleção de pacientes
A capacidade de drenar completamente a cavidade torácica, quebrar loculações do líquido pleural, visualizar completamente todos os aspectos do espaço pleural, e evitar a morbidade de uma toracotomia tornou a toracoscopia atrativa no manejo de empiema e hemotórax.
Tabela 1: Critérios laboratoriais para drenagem de empiema
Uma efusão ocupando mais de 50% do hemitórax ou que esteja localizada;
Uma coloração de Gram positiva ou cultura do fluido pleural;
Um fluido pleural purulento que tenha um pH inferior a 7.20 ou uma glicose abaixo de 60,
Um nível de ácido láctico desidrogenase mais de três vezes o limite superior normal para o soro.
Patientes com derrame pleural infectado por toracocentese e que satisfazem os critérios laboratoriais para intervenção são candidatos à decorticação toracoscópica.
Quando o empiema está na fase exsudativa ou fibrinopurulenta e está presente há aproximadamente 3 semanas ou menos, a intervenção toracoscópica é geralmente bem sucedida (Vídeo 1, Vídeo 2 abaixo). Quando o empiema está presente há mais de 3 semanas (fase de organização), a capacidade de realizar uma decorticação adequada pode ser mais difícil devido a aderências mais densas e à presença de uma casca de visceral pulmonar aderente. Pacientes com empiema exsudativo ou fibrinopurulento podem quase sempre ser abordados com toracoscopia; a tomografia não ajuda na previsão dos pacientes que necessitarão de toracotomia. A conversão para toracotomia aberta é realizada quando necessário e não deve ser considerada um fracasso da toracoscopia, mas sim um exercício de julgamento cirúrgico maduro. A toracoscopia também é indicada quando a natureza do processo pleural não é diagnosticada, pois isso permite uma biópsia pleural dirigida que provavelmente fará o diagnóstico, evitando a morbidade de uma toracotomia. Outras indicações para decorticação toracoscópica incluem hemotórax e desbridamento mediastinal em pacientes com mediastinite descendente .
Toracotomia principal, pleurodese anterior do talco e empiema prévio são contra-indicações relativas à toracoscopia. A incapacidade de tolerar a ventilação pulmonar única e a presença de um fibrotórax são contra-indicações para a realização de decorticação toracoscópica. Os pacientes que desenvolvem empiema após perfuração esofágica não devem ser tratados toracoscopicamente, mas por toracotomia.
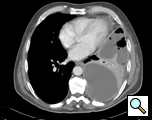
Figure 1: TC mostrando empiema
TC do tórax fornece informações sobre a localização, grau de localização, a extensão do empiema e o parênquima pulmonar subjacente (Figura 1). Não é raro que um organismo não seja identificado na cultura do líquido pleural e, portanto, uma cobertura antibiótica de amplo espectro deve ser instituída quando o diagnóstico de empiema é feito. Isto pode ser modificado se os dados da cultura identificarem um organismo. Os antibióticos são continuados para o período perioperatório.
Deve ser feita uma avaliação do estado nutricional do paciente e iniciada a alimentação suplementar, se necessário. A broncoscopia deve ser realizada antes da decorticação para descartar obstrução endobrônquica na porção do pulmão que está presa pelo empiema.
Passos operatórios
Institui-se a anestesia geral e realiza-se o isolamento pulmonar com tubo endotraqueal de duplo lúmen ou tubo de lúmen único com bloqueador brônquico. Isto permite a expansão e colapso do pulmão, conforme necessário, durante a decorticação. A monitorização intra-operatória inclui uma linha de pressão arterial, acesso intravenoso de grande diâmetro, um cateter de Foley e oximetria de pulso. O paciente é posicionado como para uma toracotomia póstero-lateral.

Figure 3. Radiografia de tórax pós-operatória após decorticação do VATS, com drenagem pleural esquerda no local.

Figure 2b: Uso de um retractor para manter aberta a porta de trabalho.
A porta da câmara é colocada no 7º ou 6º espaço intercostal na linha da coluna ilíaca superior anterior ou apenas anterior a esta. A decorticação do VATS e/ou evacuação do hemotórax pode ser realizada através de 2 ou 3 portas. A porta de trabalho deve ser colocada sobre o 5º espaço intercostal entre a linha axilar média e anterior. (Figura 2a) A incisão intercostal deve permitir 3 dedos. Um Weitlaner é utilizado para retrair os tecidos moles (Figura 2b). Uma terceira porta pode ser colocada posteriormente, posicionada para permitir acesso à parte anterior da cavidade pleural.
Após a entrada do tórax, uma sucção Yankauer é usada para drenar o tórax do derrame ou sangue (Vídeo 3, Vídeo 4 abaixo) e junto com um dedo usado para quebrar loculações simples (Vídeo 5 abaixo). O TAC pré-operatório ajuda a orientar esta drenagem inicial ‘cega’ e cria um espaço pleural funcional para os instrumentos toracoscópicos. Os depósitos fibrinosos gelatinosos e os coágulos de sangue são removidos com uma pinça de anel curvo (Vídeo 6, Vídeo 7 abaixo). O peeling pleural visceral pode ser desbridado usando uma pinça de anel, uma cureta (Vídeo 8 abaixo) e um dissecador de amendoim como em uma decorticação aberta.
Após um espaço pleural ter sido criado, a remoção do material fibrinoso é feita sobre a parte lateral da cavidade pleural começando do ápice do pulmão e indo até o diafragma ou vice-versa. A ventosa e a pinça de anel são usadas em conjunto para remover o material fibrinoso da cavidade pleural e a cureta, o amendoim e a pinça de anel são usados para dissecar a crosta no pulmão. No aspecto inferior da cavidade pleural é útil identificar e separar o lobo inferior do pulmão do diafragma (Vídeo 9 abaixo). Este plano é desenvolvido posterior e anteriormente permitindo que o pulmão preencha o sulco costodiafragmático uma vez que a decorticação esteja completa. Em seguida, o aspecto posterior do espaço pleural é desbridado e o pulmão subjacente é descascado. A exposição é facilitada pela rotação anterior do paciente. Finalmente, o aspecto anterior da cavidade pleural é debridado e o pulmão é liberado de onde está aderido ao mediastino. Esta exposição é melhorada ao rolar o paciente posteriormente. À esquerda devem ser tomados cuidados para proteger o nervo frênico.
A ventilação intermitente do pulmão é usada para avaliar a completude da decorticação à medida que a dissecção prossegue. Se o progresso adequado não estiver sendo feito ou se houver expansão inadequada do pulmão para preencher o tórax, então a conversão para decorticação aberta deve ser feita. Deve ser tomado especial cuidado com a hemostasia (Vídeo 10, Vídeo 11 abaixo) tanto na pleura parietal como na pleura visceral.
Após o desbridamento adequado ter sido realizado, a irrigação é feita e a expansão pulmonar é visualizada para garantir que a cavidade pleural seja preenchida pelo pulmão (Vídeo 12 abaixo). Os tubos peitorais podem ser colocados anterior e posteriormente para drenagem de ar e fluidos. Se houver um pequeno espaço sobre o diafragma é colocado um tubo de ângulo recto nesta posição para garantir a drenagem e permitir a expansão gradual do pulmão.
Os tubos torácicos são mantidos na sucção para garantir a expansão completa do pulmão e a drenagem adequada do espaço pleural (Figura 3). Quando a drenagem for inferior a 200cc/24hrs, os tubos podem ser removidos. Para pacientes com empiema, os antibióticos intravenosos são continuados durante o curso pós-operatório e por mais 14 dias de antibióticos orais, uma vez que o paciente tenha alta. Para os pacientes com hemotórax, os antibióticos são continuados no pós-operatório por 48 horas.
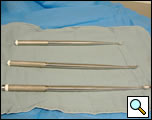
Figure 5. Curetas longas para uso na decorticação do VATS.

Figure 4b: Fórceps de anel curvo aberto.
>
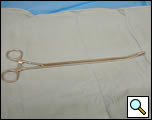
Figure 4a. Pinça com anel curvo fechada (painel esquerdo) e aberta (painel direito).
Cartão de preferência
- 30 graus Toracoscópio
- Grampo de anel toracoscópico curvo (Figuras 4a, 4b)
- Yankauer ventosa
- Dissecretor de amendoim
- Curettes longas (Figura 5)
>
Dicas & Pitfalls
- Utilizar uma ventosa / dedo / bastão de esponja de amendoim para “cegamente” criar um espaço de trabalho na cavidade pleural.
- Verifica se o pulmão se expande novamente para preencher adequadamente o peito antes de sair da sala de operação.
- Se não houver certeza sobre a progressão da operação, sangramento, tamanho da fuga de ar e reexpansão pulmonar, proceda à abertura da decorticação.
Resultados
A decorticação toracoscópica está agora comprovada no tratamento do empiema e o tempo decorrido desde a origem do empiema e a intervenção cirúrgica é provavelmente mais preditiva da capacidade de realizar a operação com sucesso . A tomografia computorizada não é útil a este respeito, mas ajuda na colocação da porta e na direcção da decorticação dentro do peito. Os princípios da decorticação aberta devem ser seguidos enquanto se utiliza a tecnologia toracoscópica. Todas as áreas de material fibrinoso devem ser drenadas e o pulmão subjacente libertado de um peeling pleural restritivo para permitir uma re-expansão completa. As taxas de sucesso são altas e a duração do tubo torácico, o tempo de internação, a dor pós-operatória e a recuperação são melhoradas com a toracotomia. As taxas de mortalidade são baixas, assim como as taxas de recorrência e complicações. As conversões para toracotomia aberta são mais frequentes do que após outros procedimentos toracoscópicos, mas isto deve ser considerado um exercício de julgamento cirúrgico sadio e não um fracasso da técnica.
A decorticação toracoscópica estende a versatilidade do cirurgião torácico no tratamento das infecções do espaço pleural e pode ser usada para o diagnóstico e tratamento das mesmas com excelentes resultados.
Video 1
Video 2
Video 3
Video 4
Video 5
Video 6
Video 7
Video 8
Video 9
Video 10
Video 11
Video 12
- Light RW. Efusões parapneumônicas e empiema. Proc Am Thorac Soc 2006;3:75-80.
- Cassina PC et al. Video-assisted thoracoscopy in the treatment of pleural empyema: stage-based management and outcome. J Thorac Cardiovasc Surg 1999;117:234-8.
- Lardinois D et al. Atraso no encaminhamento e organismos gram-negativos aumentam a taxa de conversão toracotomia em pacientes submetidos a cirurgia toracoscópica video-assistida para empiema. Ann Thorac Surg 2005;79:1851-6.
- Roberts JR. Cirurgia minimamente invasiva no tratamento do empiema: tomada de decisão intra-operatória. Ann Thorac Surg 2003;76:225-30.
- Navsaria PH, Vogel RJ, Nicol AJ. Evacuação toracoscópica do hemotórax retido pós-traumático. Ann Thorac Surg 2004;78:282-6.
- Shimizu K, et al. Drenagem vídeo-assistida bem sucedida da mediastinite necrosante descendente. Ann Thorac Surg 2006;81:2279-81.
- Hope WW, Bolton WD, Stephenson JE. A utilidade e o tempo da intervenção cirúrgica do empiema parapneumónico na era da videotoracoscopia. Am Surg 2005;71:512-4.
- Luh SP, et al. Cirurgia toracoscópica video-assistida no tratamento de derrames parapneumônicos complicados ou empiemas: resultado de 234 pacientes. Peito 2005;127:1427-32.
- Wurnig PN, et al. Cirurgia torácica video-assistida para empiema pleural. Ann Thorac Surg 2006;81:309-13.