Diabetes mellitus é caro, mas a maior parte dos custos são atribuídos a complicações e cuidados hospitalares.1 De acordo com a American Diabetes Association (ADA), em 2012 o custo total estimado para o diabetes foi de US$245 bilhões.1 Estima-se que 43% foi de custos hospitalares de internação e outros 18% para prescrições para gerenciar as complicações do diabetes.1
A maioria dessas complicações pode ser evitada com o controle da glicose direcionada. Dados epidemiológicos demonstram que para cada ponto percentual de diminuição na hemoglobina A1c (HbA1c), ocorre uma redução de 35% no risco de complicações microvasculares.2 A boa notícia é que as taxas de complicações no diabetes foram reduzidas,3 mas isso foi superado pelo simples aumento do número de pessoas com diabetes que progridem com complicações.
Muitas pessoas com diabetes tipo 2 podem ter uma complicação relacionada ao diabetes no momento do diagnóstico. Tanto no diabetes tipo 1 como no tipo 2, algumas das complicações, como a retinopatia e a nefropatia, são silenciosas. Isto requer uma abordagem agressiva, porque esperar pelos sintomas será demasiado tarde. Mesmo a neuropatia diabética será assintomática em até 50% das pessoas com anomalias mensuráveis.4
Este artigo revisará as recomendações dos Padrões de Cuidados com Complicações Microvasculares da ADA 2017 e declarações de posição relevantes, e destacará a triagem preventiva e as pérolas clínicas para o médico da atenção primária que trata pacientes com diabetes.
- Retinopatia diabética
- Tabela 1. Estágios de Retinopatia com Descrição
- Pérolas Clínicas
- Diabetes Kidney Disease
- Tabela 2. Selecione Estudos Landmark Demonstrando Controle Glicêmico com A1c abaixo de 7%
- Tabela 3. TFG estimada com Estágio e Descrição
- Tabela 4. Albuminúria Categorias em CKD
- Figure 1. Sugestão de Frequência de Avaliação (Número de vezes por ano) por eGFR e Categoria Albuminúria
- Tabela 5. Bandeiras vermelhas que sugerem doença glomerular não-diabética
- Tabela 6. Ajustes de Dosagem e Recomendações para Agentes Inflamatórios Glicosos em Pacientes com Deficiência Renal
- Classe
- Medicação
- Pérolas Clínicas
- Neuropatia Periférica Diabética
- Tabela 7. Outras causas de neuropatia67
- Tabela 8. Agentes Farmacológicos Comumente Utilizados para DPN4,69
- Pérolas Clínicas
- Gastroparese
- Pérolas Clínicas
- Quiroartropatia diabética
- Conclusão
Retinopatia diabética
Retinopatia diabética é uma complicação microvascular comum de diabetes tipo 1 e tipo 2. Estima-se que 3,7 milhões de pessoas em todo o mundo são moderadamente deficientes visuais por causa da retinopatia diabética, e mais de 800.000 pessoas em todo o mundo são cegas por causa da retinopatia diabética.5 É a causa mais freqüente de cegueira neonatal em adultos entre 20-74 anos de idade.6 Foram feitas fortes correlações com o controle glicêmico, o controle da pressão arterial e a duração da doença. Através do rastreio e controlo precoce e regular destes factores de risco, a retinopatia diabética pode ser detectada e tratada para prevenir a deficiência visual.
A duração da diabetes é o maior factor de risco para a progressão da retinopatia diabética. Na diabetes tipo 1, a retinopatia é rara nos primeiros 3-5 anos ou antes da puberdade.7 Nos 20 anos seguintes, quase todos os pacientes com diabetes tipo 1 desenvolverão retinopatia diabética.7 Em pacientes com diabetes tipo 2, até 21% terão algum grau de retinopatia no momento do diagnóstico.7 Hiperglicemia crônica, nefropatia, hipertensão e dislipidemia são outros fatores que aumentam o risco de retinopatia diabética ou estão associados a ela.8 Até 50% dos pacientes com albuminúria (independentemente do nível estimado de filtração glomerular) terão retinopatia.9 A Tabela 1 descreve os diferentes estágios da retinopatia.
Tabela 1. Estágios de Retinopatia com Descrição |
|
|
Etapa |
Descrição |
|
Não-MenosRetinopatia Diabética Proliferativa |
Microaneurismas presentes |
|
Retinopatia Diabética Não-Proliferativa Moderada |
Microaneurismas, hemorragias da retina ou manchas, exsudados duros, ou manchas de algodão em lã podem estar presentes |
|
Retinopatia Diabética Não-Proliferativa Severa |
Horragia intra-uterina, hemorragia venosa, ou anormalidades microvasculares intraretinais podem estar presentes |
|
Retinopatia Diabética Proliferativa |
Neovascularização, hemorragias vítreas ou preretinais presentes |
Patofisiologia. Anormalidades leves e não proliferativas caracterizadas por aumento da permeabilidade vascular podem progredir para retinopatia diabética não proliferativa moderada a grave (NPDR).7 A retinopatia diabética proliferativa é caracterizada pela proliferação de novos vasos sanguíneos da retina.7 O edema macular, que é o espessamento central da retina com exsudação e edema, pode se apresentar em qualquer estágio da retinopatia.7 A retinopatia diabética pode ser acelerada pela gravidez, puberdade, falta de controle glicêmico, hipertensão e cirurgia de catarata.7
Prevenir a Retinopatia Diabética. O controle glicêmico é fundamental para a prevenção da retinopatia diabética. No Diabetes Control and Complications Trial (DCCT), os pesquisadores avaliaram o efeito do controle glicêmico apertado e a progressão de uma retinopatia sem ou mínima na linha de base para uma NPDR moderada.10 Para pacientes do grupo de terapia intensiva sem retinopatia na linha de base, o risco médio de retinopatia foi reduzido em 76% ao longo de 36 meses.10 Entre os pacientes do grupo de terapia intensiva que já apresentavam NPDR mínimo a moderado, o risco de progressão foi reduzido em 54% em relação àqueles que utilizavam tratamento convencional.10 No estudo original Action to Control Cardiovascular Risk in Diabetes (ACCORD), os participantes com diabetes tipo 2 durante 10 anos e doença cardiovascular conhecida foram randomizados para terapia intensiva ou padrão para glicemia, pressão arterial sistólica e dislipidemia. Quatro anos depois, a progressão da retinopatia foi reduzida naqueles com controle glicêmico intensivo prévio, independentemente dos níveis atuais similares de HbA1c.11 Efeitos legados similares não foram observados naqueles grupos com controle intensivo da pressão arterial ou em fenofibrato para dislipidemia.11
Screening. Como o edema macular e a retinopatia diabética proliferativa podem ser assintomáticos, o rastreamento é vital para a detecção precoce e o tratamento. Para pacientes com diabetes tipo 1, a triagem deve ser iniciada cinco anos após o diagnóstico.8 Para pacientes com diabetes tipo 2, a triagem deve ser iniciada no momento do diagnóstico.8 A triagem deve ser completada por um oftalmologista ou optometrista com experiência em retinopatia diabética. A triagem deve ser completada com os olhos dilatados. Se a retinopatia já estiver presente, recomenda-se o encaminhamento a um oftalmologista.8 A avaliação repetida deve ser feita anualmente se a doença for mínima ou não for encontrada.8
A gravidez é um tempo de alto risco para a retinopatia proliferativa. Em mulheres grávidas com diabetes tipo 1 ou tipo 2 pré-existente, os exames oftalmológicos devem ser realizados antes da concepção ou no primeiro trimestre. Os exames devem ser repetidos a cada trimestre e durante um ano após o parto.8 Para as pacientes com diabetes gestacional, não são necessários exames oftalmológicos adicionais após o parto.
A gravidez em pacientes com diabetes tipo 1 ou tipo 2 pré-existente pode resultar em rápida progressão da retinopatia diabética. Isto é especialmente verdade se houver um controle glicêmico deficiente no momento da concepção.14 Mulheres com diabetes que estão grávidas ou planejam engravidar devem ser aconselhadas sobre o risco de desenvolvimento ou progressão da retinopatia diabética e a necessidade de controle glicêmico antes da concepção.8 No entanto, um agravamento precoce da retinopatia pode ocorrer com a rápida implementação do tratamento glicêmico intensivo se a retinopatia já estiver presente.8 A diabetes gestacional não parece conferir o mesmo risco de desenvolvimento de retinopatia diabética durante a gravidez.8
Tratamento. Além do controle glicêmico, o controle da pressão arterial (< 140 mmHg sistólica) também mostrou diminuir a progressão da retinopatia diabética, mas não há benefício adicional de controle rigoroso da pressão arterial sistólica < 120 mmHg.12 O fenofibrato também pode retardar a progressão da retinopatia diabética, especialmente com NPDR muito leve, em pacientes com dislipidemia.13 A aspirina mostrou-se sem efeito na progressão da retinopatia, desenvolvimento de hemorragia vítrea ou duração da hemorragia vítrea e pode ser usada com segurança para outras indicações médicas sem comprometimento ocular.7
O tratamento de pacientes com diabetes deve incluir recomendações de exercícios. Aqueles com retinopatia não proliferativa leve podem iniciar a atividade física com segurança. Entretanto, pacientes com retinopatia não proliferativa moderada devem evitar atividades que aumentem muito a pressão arterial, como o powerlifting.15 Pacientes com retinopatia não proliferativa grave ou instável devem evitar qualquer atividade física que seja vigorosa (saltos, jarros), qualquer atividade de cabeça para baixo e retenção da respiração.15 No caso de hemorragia vítrea, nenhum exercício deve ser feito.15
A detecção precoce da retinopatia diabética é importante porque o tratamento pode prevenir ou reverter a perda da visão. No Estudo da Retinopatia Diabética (DRS), os pesquisadores descobriram que a cirurgia de fotocoagulação foi um tratamento eficaz para a retinopatia diabética. O Estudo de Tratamento Precoce da Retinopatia Diabética e o DRS mostraram que a fotocoagulação diminuiu o risco de perda de visão, com o maior benefício em pacientes que tinham doença de base mais avançada.16,17 Dados atuais fornecem evidências de que agentes intravitrais antivirais endoteliais de fator de crescimento endotelial (anti-VEGF) são mais eficazes no tratamento do edema macular do que a monoterapia ou terapia combinada com a coagulação a laser.8 Além disso, o anti-VEGF pode melhorar a visão, enquanto que a fotocoagulação apenas previne a perda de visão adicional.18,19 Uma desvantagem do anti-VEGF é que ele requer terapia intravitreal mensal durante os primeiros 12 meses.
Pérolas Clínicas
- Não há sinais ou sintomas específicos de retinopatia diabética precoce.
- Reinopatia diabética deve ocorrer em pacientes:
– com diabetes tipo 1 cinco anos após o diagnóstico.
– em pacientes com diabetes tipo 2 no momento do diagnóstico.
>
- Aconselhamento e exames aumentados devem ser fornecidos a mulheres diabéticas que planejam ficar ou engravidar, porque a retinopatia diabética pode acelerar rapidamente durante a gravidez.
- Controle glicêmico e controle da pressão arterial (< 140 mmHg sistólica) podem prevenir o desenvolvimento de retinopatia diabética.
- Cupe a 50% dos pacientes com albuminúria (independentemente do nível de eGFR) terão retinopatia.9
- O tratamento com fotocoagulação pode prevenir a progressão da doença e o tratamento anti-VEGF pode reverter a perda da visão por edema macular.
Diabetes Kidney Disease
Diabetes kidney disease (DKD), a terminologia preferida pela ADA, é a principal causa de doença renal crônica (CKD) nos Estados Unidos.20,21 A DRD tem efeitos significativos a longo prazo na qualidade de vida dos pacientes com diabetes e é responsável por até 40% das doenças renais em fase terminal (DREs).20 Com base na Iniciativa de Qualidade de Resultados de Doenças Renais (KDOQI) da National Kidney Foundation e nos Padrões de Cuidados ADA 2017, esta seção fornecerá orientação sobre os níveis de HbA1c alvo, gerenciamento de medicamentos e tratamento terapêutico para pacientes com DKD.
O KDOQI estratifica o nível de HbA1c alvo pelo risco de hipoglicemia e comorbidades do paciente. Essa iniciativa baseia-se em três publicações que demonstram que o controle glicêmico com HbA1c abaixo de 7% irá prevenir ou diminuir a progressão da doença renal em pacientes com diabetes tipo 2.22,23,24 Esses estudos estão resumidos na Tabela 2. A ADA recomenda em pacientes com maior risco de hipoglicemia, a meta HbA1c deve ser elevada acima de 7%.8 O KDOQI recomenda pacientes com CKD Estágio 4 e 5 que têm expectativa de vida limitada manterem um HbA1c maior que 7%.25
Tabela 2. Selecione Estudos Landmark Demonstrando Controle Glicêmico com A1c abaixo de 7% |
|
|
Trial |
Resultados |
|
Ação em Diabetes e Doença Vascular: Ensaio de Avaliação de Libertação Controlada de Pré-Termo e Diamicron Modificado (ADVANCE)22 |
21% de redução de nova macroalbuminúria e terapia de substituição renal com A1c inferior a 7% |
|
Ensaio de Diabetes Veterans Affairs (VADT)23 |
37% de redução de macroalbuminúria e 32% de redução na microalbuminúria com A1c abaixo de 7% |
|
O estudo Ação para Controle do Risco Cardiovascular na Diabetes (ACCORD)24 |
2% de redução na macroalbuminúria e 21% de redução na microalbuminúria com A1c abaixo de 7% |
Epidemiologia. Homens e mulheres são igualmente afetados pela DKD.20 O pico de incidência para desenvolver DKD é de 15 anos após o diagnóstico.21 Afro-americanos são três a cinco vezes mais propensos a desenvolver nefropatia diabética do que caucasianos.20 Mexicano-americanos e índios Pima também têm maior risco de desenvolver DKD.20
Proteinúria é um preditor de morbidade cardiovascular e mortalidade por todas as causas em diabetes.21 A presença de DKD é um fator de aumento do risco de doença cardiovascular. Pacientes com DQD consistentemente enfrentam taxas mais altas de mortalidade por doença cardiovascular.26 Além disso, a mortalidade por todas as causas é maior em pacientes com DQD.21
Na diabetes tipo 1, complicações microvasculares como a DQD começam a se desenvolver aproximadamente 10-20 anos após o diagnóstico; na diabetes tipo 2, o início exato muitas vezes é desconhecido e, portanto, justifica uma triagem mais precoce.27
Patofisiologia e Patogênese. Acredita-se que a hiperglicemia induza três grandes alterações histológicas nos glomérulos levando à DKD: 1) expansão mesangial, 2) espessamento da membrana basal glomerular e 3) esclerose glomerular.28 Embora a patogênese exata da ocorrência da DKD seja desconhecida, acredita-se que a hiperglicemia inicialmente cause hiperfiltração e lesão renal como resultado de alterações histológicas e ativação de citocinas.20 Tipicamente, a albuminúria pode ser o primeiro sinal de DQD.29
Esta situação é ainda exacerbada como resultado de condições comórbidas de hiperlipidemia, arteriosclerose, hipertensão e obesidade, que contribuem para a lesão renal e subsequente declínio da função. A obesidade central leva à hipertensão por hiper-ativação do sistema renina-angiotensina-aldosterona e do sistema nervoso simpático.20 Além disso, à medida que a vasculatura renal se torna arterosclerótica, ocorre uma progressão aumentada da nefropatia diabética. Uma importante característica diferencial da nefropatia diabética em comparação a outras formas de CKD é que os glomérulos e rins geralmente são normais ou aumentam de tamanho inicialmente.20
Classificação. Tanto a taxa de filtração glomerular quanto a presença de albuminúria são utilizadas para a fase de CKD.30,31 A taxa de filtração glomerular é baseada na raça, idade, sexo, peso e níveis séricos de creatinina. (Veja Tabela 3.) Historicamente, o termo microalbuminúria foi usado para definir níveis moderadamente aumentados de albumina. A National Kidney Foundation recomenda agora o uso dos termos “suave”, “moderada” ou “severamente aumentada” para descrever os níveis de albuminúria com base nos níveis descritos na Tabela 4.31 A razão albumina/criinina é o teste inicial usado para detectar albuminúria.
Tabela 3. TFG estimada com Estágio e Descrição |
||
|
Etapa |
TFG (mL/min por 1.73 m2) > |
Descrição |
| > |
90+ > |
Hiperfiltração glomerular |
|
Função renal ligeiramente reduzida |
||
| 3A |
Função renal moderadamente reduzida |
|
| >
3B > |
||
|
Função renal gravemente reduzida |
||
|
<15 ou em diálise |
End-insuficiência renal em fase |
|
Tabela 4. Albuminúria Categorias em CKD |
||
|
Categoria |
Albumina aNíveis de creatinina |
Descrição |
|
A1 |
< 30 |
Normal a ligeiramente aumentado |
| A2 |
Moderadamente aumentada |
|
|
A3 |
> 300 |
Severamente aumentada |
Os dois esquemas de classificação representam o duplo caminho para desenvolver o CKD. Um deles é através da elevação da creatinina e do agravamento da TFG. O outro é através do desenvolvimento da albuminúria. O aumento da albuminúria é frequentemente seguido por um declínio da taxa de filtração glomerular;32 no entanto, isto pode ser evitado através do uso de inibidores da enzima conversora da angiotensina (ECA) ou bloqueadores dos receptores da angiotensina (ARBs) e controle glicêmico. (Ver Figura 1.)
Figure 1. Sugestão de Frequência de Avaliação (Número de vezes por ano) por eGFR e Categoria Albuminúria
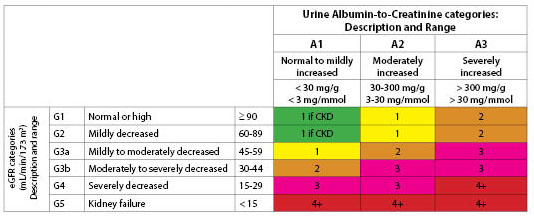
Reimpresso com permissão da Kidney Disease: Improving Global Outcomes (KDIGO).
Sintomas Comuns. A maioria das pessoas não tem sintomas de nefropatia diabética. Muitas vezes, os pacientes podem ter evidências ou diagnóstico de outras complicações microvasculares.20 A DQT precoce é tipicamente assintomática. Um achado tardio de DQD é urina espumosa. Além disso, se um paciente for gravemente hipoalbuminêmico, ele ou ela pode apresentar edema de pedal e fadiga.20 Pacientes com DQD tipicamente têm hipertensão arterial sistêmica. Pacientes com nefropatia diabética tipicamente também apresentam retinopatia e neuropatia.8
Opções de diagnóstico. Como não há sintomas, a triagem de rotina é crítica. A ADA recomenda a triagem anual de uma relação albumina urinária/cripanina.8 Além disso, pelo menos anualmente, a taxa de filtração glomerular deve ser testada em pacientes com diabetes tipo 1 com duração de cinco anos e entre todos os pacientes com diabetes tipo 2 ou pacientes com hipertensão comorbida e diabetes.8 Não há recomendação clara para a obtenção de imagens, como uma ultrassonografia, para o diagnóstico de DKD.
Diagnóstico diferencial. Algumas bandeiras vermelhas podem sugerir que a diabetes não é a única causa de DRC. Se uma pessoa tiver um CKD avançado sem evidências de outras complicações microvasculares, isto é um aviso. A proteinúria aberta com início súbito (menos de cinco anos após o início da diabetes) de sedimento urinário com células vermelhas e gesso dismórficos, ou um declínio abrupto da taxa de filtração glomerular, sugere uma doença renal de etiologia não diabética.20 A eletroforese sérica ou urinária pode ser feita se houver uma preocupação com mieloma múltiplo. A ausência de albuminúria com redução da taxa de filtração glomerular e diabetes necessita de investigação para outras causas de DCQ que não a DCQ.21 A Tabela 5 lista bandeiras vermelhas que sugerem uma doença glomerular não nondiabética.
Tabela 5. Bandeiras vermelhas que sugerem doença glomerular não-diabética
- Conjunto de proteinúria < 5 anos a partir do documentado início da diabetes tipo 1 ou início agudo de doença renal
- Diminuição aguda da taxa de filtração glomerular aguda; nefropatia diabética
- Sedimento urinário contendo eritrócitos dismórficos ou gesso celular
- Absistência de outras complicações microvasculares como neuropatia ou retinopatia
- Sinais e/ou sintomas de outra doença sistêmica
Tratamento. Uma marca registrada da nefropatia do diabetes é o manejo da glicose, redução do sal, pressão sanguínea e dislipidemia. Além disso, os pacientes devem evitar medicamentos nefrotóxicos e suplementos como aminoglicosídeos e anti-inflamatórios não esteróides. Os pacientes devem ser encaminhados a um nefrologista no estágio IV da doença renal ou se a função renal estiver em rápido declínio. Outras indicações para o encaminhamento dependem da complexidade do caso. Novos medicamentos orais para diabetes podem ajudar a prevenir a progressão da insuficiência renal.
Controle glicêmico. A seleção de medicamentos, monitoramento e farmacologia são todos afetados em pacientes com nefropatia diabética. À medida que o eGFR de um paciente diminui, alguns agentes orais necessitarão de ajuste da dose. A insulina continua sendo a terapia central para o controle da glicose em pacientes com diabetes e CKD avançado.31 A Tabela 6 mostra os ajustes de dose recomendados para medicamentos antiglicêmicos em pacientes com doença renal. Em 2016, tanto a empagliflozina quanto a canagliflozina mostraram reduzir a progressão do CKD e da microalbuminúria.33,34 Empagliflozina reduziu as taxas de progressão da nefropatia e o risco de grandes eventos cardiovasculares adversos em comparação com placebo quando adicionada aos cuidados padrão de diabetes tipo 2 no marcante estudo de resultados do Empagliflozin Cardiovascular Outcome Event Trial in Type 2 Diabetes Mellitus Patients (EMPA-REG).33
Tabela 6. Ajustes de Dosagem e Recomendações para Agentes Inflamatórios Glicosos em Pacientes com Deficiência Renal |
||
|
Glucose-Agentes baixadores |
Ajustes de dose em Imparidade Renal |
|
Classe |
Medicação |
|
|
Biguanides > |
Metformina > |
eGFR 30 a 45 mL/min/1.73 m2: Não é recomendado iniciar a terapia. Se após o início, avaliar os benefícios/riscos da terapia contínua. eGFR < 30 mL/min/1,73 m2: O uso é contra-indicado |
|
Sulfonilureias |
Glimepiride |
Impotência de leite-moderado: Iniciar a 1 mg uma vez por dia Imparidade severa: O uso é contra-indicado |
|
Glipizide |
Lançamento estendido: Iniciar a 2,5 mg uma vez por dia |
|
|
Glyburide |
eGFR < 60 mL/min/1,73 m2: O uso não é recomendado |
|
|
Meglitinidas |
Nateglinide |
Não ajuste de dosagem necessário |
|
Repaglinide |
CrCl 20 a 40 mL/min: Iniciar a 0.5 mg com refeições CrCl < 20 mL/min: Sem informação |
|
|
Thiazolidinediones |
Pioglitazone |
Sem ajuste de dosagem necessário |
|
Rosiglitazona |
>
Não é necessário ajuste da dosagem |
|
|
α-Inibidores da glucosidase |
Acarbose |
SCr > 2.0 mg/dL: O uso não é recomendado |
|
Miglitol |
CrCl < 25 mL/min ou SCr >2.0 mg/dL: Não é recomendado o uso |
|
|
InibidoresDPP-4 |
Alogliptin |
CrCl 30 a 60 mL/min: 12.5 mg uma vez ao dia CrCl < 30 mL/min: 6,25 mg uma vez ao dia ESRD requerendo hemodiálise: 6.25 mg uma vez ao dia e administrar sem considerar o tempo de hemodiálise |
|
Linagliptin |
Não é necessário ajuste da dosagem |
|
|
Saxagliptin |
CrCl ≤ 50 mL/min: 2.5 mg uma vez ao dia ESRD requerendo hemodiálise: 2.5 mg uma vez ao dia e administrar após hemodiálise |
|
|
Sitagliptin |
CrCl 30 a 50 mL/min: 50 mg uma vez ao dia CrCl < 30 mL/min: 25 mg uma vez por dia > SRD requerendo hemodiálise ou diálise peritoneal: 25 mg uma vez por dia e administrar sem considerar o momento da hemodiálise > |
|
| >
Vildagliptin |
CrCl < 50 mL/min: 50 mg uma vez por dia |
|
|
Sequestrantes de ácido biliar |
Colesevelam |
Não são necessários ajustes de dosagem |
|
Dopamina2 agonistas |
Bromocriptina |
Sem informação |
| SGLT-2 inibidores |
Canagliflozin > |
eGFR 45 a 60 mL/min/1.73 m2: Não exceder 100 mg uma vez por dia eGFR < 45 mL/min/1,73 m2: Não é recomendado iniciar a terapia. Se após o início, descontinuar a terapia para pacientes com taxa de filtração glomerular persistente < 45 mL/min/1,73 m2. eGFR < 30 mL/min/1,73 m2/ESRD/Hemodiálise: O uso é contra-indicado |
|
Dapagliflozin |
eGFR < 60 mL/min/1,73 m2: Não é recomendado iniciar a terapia. Se após o início, interromper a terapia para pacientes com eGFR persistentemente entre 30 e < 60 mL/min/1,73 m2. eGFR < 30 mL/min/1,73 m2/ESRD/Hemodiálise: O uso é contra-indicado |
|
|
Empagliflozin |
eGFR < 45 mL/min/1,73 m2: Não é recomendado iniciar a terapia. Se após o início, interromper a terapia para pacientes com eGFR persistentemente < 45 mL/min/1,73 m2. eGFR < 30 mL/min/1,73 m2. ESRD/ Hemodiálise: O uso é contra-indicado |
|
|
GLP-1 agonistas receptores |
Albiglutide |
Não é necessário ajuste da dosagem |
|
Dulaglutide |
Não é necessário ajuste da dosagem |
|
|
Exenatide |
CrCl 30 a 50 mL/min: Nenhuma informação. Use com cautela. CrCl < 30 mL/min/ ESRD: O uso não é recomendado |
|
|
Liraglutide |
Sem informação |
|
|
Lixisenatide |
eGFR 15 a 29 mL/min/1.73 m2: Nenhuma informação. Monitor para aumento dos efeitos adversos da IG que podem levar à desidratação e piora da função renal. eGFR <15 mL/min/1.73 m2/ ESRD: Não é recomendado o uso |
|
|
Amilin mimetics |
Pramlintide |
CrCl ≥15 mL/min: Não é necessário ajuste da dosagem ESRD: Nenhuma informação |
|
Insulinas |
Rapid-analógicos de actuação >
> > > > Chort-acting >
> Intermediário…acting >
Análogos de insulina de base >
> > |
>
As necessidades de insulina podem ser reduzidas devido a alterações na depuração da insulina ou no metabolismo. Monitorizar de perto a glicemia. |
Pressão de cheiro. O tratamento da pressão arterial deve começar em 140/90 mmHg para pacientes com diabetes e doença renal diabética.37 O Prospective Diabetes Study (UKPDS) do Reino Unido encontrou uma redução de 12% do risco de complicações diabéticas a cada 10 mmHg de queda na pressão sistólica até que a pressão fosse de 120 mmHg.38 Os medicamentos de escolha permanecem como inibidores da ECA ou BRA para indivíduos com hipertensão e diabetes, DKD e CKD. Foi demonstrado que a inibição da ECA retarda o desenvolvimento da DKD quando iniciada em pacientes com albuminúria levemente elevada. A creatinina pode subir até 30% no início de um inibidor da ECA ou BRA.39 Considere avaliar para outras doenças renais subjacentes se a creatinina eleva mais do que isso.
O KDOQI recomenda contra dar ECA/ARBs para pacientes com diabetes tipo 2 que são normotensos e normoalbuminúricos.40,41,42 Os inibidores da ECA ou BRA são sugeridos para pacientes diabéticos normotensos com microalbuminúria.31,37 Não há dose ou titulação específica para estes indivíduos. O bloqueio duplo do sistema renina-angiotensina tanto pela ECA quanto pelas BRA não é recomendado devido ao risco aumentado de hipercalemia, função renal prejudicada e hipotensão.43
Redução do sal. A Redução dos Desfechos em 2012 do Estudo de Redução de Endpoints em Diabetes Mellitus Não-Insulino-dependente com o Antagonista da Angiotensina II Losartan (RENAAL) e o Estudo de Nefropatia Diabética Irbesartana (IDNT) demonstraram que dietas hipossódicas aumentaram os efeitos nefroprotetores e cardioprotetores da BRA em pacientes com diabetes tipo 2 e nefropatia diabética.44,45
Diálise Renal e Transplante Renal. Pacientes com DRCT devem ser encaminhados para a nefrologia. As opções de tratamento incluem diálise peritoneal ou hemodiálise, transporte renal ou a opção de interromper o tratamento e iniciar cuidados paliativos ou hospitalares. Um estudo observacional descobriu que pacientes que começaram a diálise em uma idade mais jovem (< 60 anos de idade) tiveram uma sobrevida mais baixa.46
Referimento. A Figura 1 inclui indicações para encaminhamento com base na classificação de TFG e albuminúria. Considere outras causas de doença renal não relacionadas ao diabetes, especialmente em pacientes com diabetes tipo 1, onde o início da retinopatia não precede o desenvolvimento da nefropatia.21 Os nefrologistas podem ajudar a esclarecer o diagnóstico, controlar a hipertensão arterial resistente e a hipercalemia e preparar os pacientes para a diálise.8
A pessoa também deve considerar que o desenvolvimento da nefropatia pode não estar relacionado ao próprio diabetes. Em pacientes com diabetes tipo 1, o início da retinopatia geralmente precede o desenvolvimento da nefropatia.47 Um indivíduo que apresenta nefropatia mas não retinopatia deve ter uma avaliação para outras causas. O encaminhamento a um nefrologista deve ser feito para estabelecer a causa da nefropatia quando esta é incerta ou quando há questões difíceis de gerenciar, relacionadas à DKD, incluindo anemia, hiperparatireoidismo e doença renal avançada com eGFR < 30 mL/min/1,73 m2.8 Ter um nefrologista consultor quando a fase 4 CKD se desenvolve (eGFR < 30 mL/min/1,73 m2) está associada à diminuição da morbidade, diminuição dos custos de saúde e diálise tardia.48 Considere um encaminhamento no Estágio 3B para preparar os pacientes mais cedo e para que a nefrologia possa tratar ao máximo.
Pérolas Clínicas
- A triagem para DKD deve ocorrer através de teste de albumina urinária e uma medida de eGFR.
- Pressão de cheiro e controle da glicose podem proporcionar prevenção da progressão da nefropatia. Manter a pressão arterial < 140/90 mmHg em pacientes com diabetes e CKD. Os inibidores da ECA ou BRA devem ser o tratamento de escolha.
- Inibidores da ECA e BRA não devem ser usados para prevenir a nefropatia se a pressão arterial e a excreção de proteínas forem normais. Os inibidores da ECA e as BRA não devem ser usados em combinação.
- Patientes com estágios 3-5 de CKD têm um risco aumentado de hipoglicemia. Cuidado deve ser usado com agentes orais como sulfonilureias.
- Em alguns pacientes com CKD, é apropriado estabelecer o alvo HbA1c > 7%, especialmente quando o risco de hipoglicemia é grande.
Neuropatia Periférica Diabética
Uma definição amplamente aceita de neuropatia periférica diabética (DPN) na prática clínica é “a presença de sintomas e/ou sinais de disfunção do nervo periférico em pessoas com diabetes após a exclusão de outras causas”.”49 A classificação ADA da polineuropatia simétrica distal é: 1) principalmente neuropatia de pequenas fibras, 2) principalmente neuropatia de grandes fibras e 3) neuropatia mista de pequenas e grandes fibras (mais comum).
Patofisiologia e Patogênese. O desenvolvimento e a progressão do DPN surgem a partir das complexas relações entre os nervos e suas células circundantes.50 Tanto os fatores vasculares quanto as interações metabólicas contribuem para todos os estágios do DPN.51 A compreensão geralmente aceita no diabetes humano que leva ao desenvolvimento de DPN é a complexa interação entre hiperglicemia, duração do diabetes, danos neuronais relacionados à idade, graus de pressão arterial e controle de lipídios no sangue e peso.52,53,54,55 A hiperglicemia ativa inúmeras vias bioquímicas que determinam o estado metabólico de uma célula nervosa e se combinam com a perfusão nervosa prejudicada, contribuindo para a progressão das neuropatias. Um estudo pioneiro, o DCCT, apoia a importância da hiperglicemia na patogênese da neuropatia.10,56,57 Outro mecanismo relacionado à hiperglicemia que leva ao DPN é o estresse oxidativo e nitrosativo induzido pela hiperglicemia com aumento da produção de radicais livres.58,59
Além da hiperglicemia, recentemente foi sugerido que a inflamação de baixo grau pode desempenhar um papel importante na patogênese das neuropatias diabéticas, levando a déficits nas fibras nervosas periféricas e autonômicas.51,60 O complexo conjunto de fatores metabólicos e vasculares desencadeia o desequilíbrio entre danos e reparos nas fibras nervosas, afetando especificamente as fibras sensoriais distais e contribuindo para a perda gradual da sensação que manifesta os sintomas clínicos da polineuropatia diabética.58,61
Sintomas Comuns. Ao indagar sobre os sintomas de DPN experimentados, observe a localização (provavelmente sentida nas mãos e pés), fatores precipitantes, características dos desconfortos, bem como o início e a freqüência da exacerbação noturna, uma vez que os sintomas são específicos do paciente.4 Tanto as fibras pequenas quanto as grandes são afetadas por glicemia elevada e os sintomas experimentados variam de acordo com a classe de fibras sensoriais afetadas. Quando as fibras nervosas afetadas são predominantemente pequenas, os sintomas desencadeados geralmente são dor (aderência, lancinação, picada, queimadura, dor, tédio e sensibilidade excessiva), disestesia (sensações desagradáveis de queimadura, formigamento, picada e apunhalamento) e dormência.4
A intensidade do desconforto pode variar desde sentir pequenas sensações anormais até ser incapacitado pela dor que pode ser exacerbada à noite e pelo sono perturbador, que se tem demonstrado estar associado à depressão devido a uma percepção de baixa qualidade de vida.4
Por outro lado, quando as fibras grandes são predominantemente afetadas, os pacientes podem sentir dormência e formigamento nas extremidades, experimentar marcha instável e perder o equilíbrio (levando a quedas em potencial).4 Alguns pacientes podem experimentar o agravamento dos sintomas à medida que seus níveis de glicose no sangue diminuem devido à intensificação do controle terapêutico do diabetes. Os pacientes podem ser assintomáticos, mas com vários graus de perda sensorial; um resultado indesejável de perda sensorial grave devido à neuropatia diabética pode ser uma lesão indolor, levando a um risco aumentado de ulceração do pé ou, em casos graves, amputação.62
A forma mais comum de neuropatia periférica diabética é a polineuropatia simétrica distal com perda progressiva das fibras nervosas sensoriais.4 O padrão típico de “estocagem” bilateralmente é criado pelos danos que ocorrem nas porções mais distais dos nervos mais longos (sendo afetados primeiro).63,64,65 À medida que o tempo avança, um padrão de “estocagem-luva”, promovendo perda sensorial e sintomas típicos de DNP, resulta de um procedimento proximal de déficits nervosos.4
Diagnóstico Clínico. Um diagnóstico clínico do DPN pode ser feito com base nos sinais e sintomas neuropáticos de um paciente com diabetes após excluir outras causas de neuropatia.66 Uma neuropatia periférica diabética assintomática pode ocorrer em até 50% daqueles que têm essa complicação; portanto, a implementação de cuidados preventivos com o pé é essencial, especialmente para aqueles que estão em alto risco de lesões devido a pés insensatos.4 A triagem anual de DPN deve ser realizada em todos os pacientes com diabetes por pinprick, temperatura, percepção de vibração (usando um garfo afinador de 128-Hz), sensação de pressão monofilamentar de 10-g e reflexos do tendão profundo do tornozelo; as potenciais úlceras do pé podem ser previstas por uma perda de sensação monofilamentar de 10-g (perda da sensação protetora) e uma redução da percepção de vibração.63 Os Standards of Medical Care in Diabetes-2017 da ADA continuam a recomendar um teste anual de monofilamento de 10 g com a finalidade de identificar pacientes em risco de desenvolver ulceração e amputação.8 Além disso, as diretrizes da ADA de 2017 recomendam a triagem para DPN no diagnóstico de diabetes tipo 2 e cinco anos após o diagnóstico de diabetes tipo 1.8
Em 2009, o Painel de Consenso de Toronto sobre Neuropatias Diabéticas atualizou os critérios diagnósticos para fornecer categorias diagnósticas. Além disso, vários instrumentos de triagem bem validados podem ser incluídos por profissionais de saúde no processo de diagnóstico, incluindo o Michigan Neuropathy Screening Instrument (MNSI), o Toronto Clinical Neuropathy Score e a Escala de Neuropatia de Utah. A Tabela 7 descreve outras causas de neuropatia que devem ser excluídas.
Tabela 7. Outras causas de neuropatia67
- Álcool ou outras toxinas
- Medicamentos neurotóxicos, especialmente quimioterapia
- Deficiência de vitamina B12
- Hipotiroidismo
- Doença renal
- Malignidades (mieloma múltiplo, carcinoma broncogênico)
- Vírus da imunodeficiência humana (HIV)
- Neuropatia desmielinizante crônica, neuropatias herdadas e vasculite
Estudos de diagnóstico. Existem vários testes diagnósticos para confirmar a presença de DPN. Estudos de condução nervosa têm sido considerados durante anos como o teste diagnóstico padrão-ouro para DPN devido às suas medidas objetivas sem respostas dos pacientes, levando a uma alta confiabilidade.4 O Teste Sensorial Quantitativo avalia as habilidades dos pacientes em detectar o toque de luz, vibração e discriminação de temperatura, envolvendo um certo nível de subjetividade.4 Outros métodos, incluindo biópsia da pele e Microscopia Intraepidérmica de Fibra Nervosa e Córnea Confocal, não têm sido usados rotineiramente na prática clínica, mas podem ser usados em ensaios clínicos.4
Opções de tratamento: Tratamento farmacológico. O tratamento farmacológico do DPN é para a melhora sintomática, portanto os medicamentos utilizados não se destinam a prevenir a progressão. A Tabela 8 resume os medicamentos das três classes mais utilizadas (anticonvulsivos, antidepressivos e opióides) para controlar os sintomas neuropáticos. Embora vários agentes sejam comumente utilizados como abordagem inicial para o manejo da DPN, apenas a pré-gabalina e a duloxetina foram aprovados pelo FDA para o manejo dessa condição; assim, qualquer um desses agentes é recomendado como a escolha inicial para dor neuropática sintomática.4 A gabapentina, embora não aprovada pelo FDA para ser utilizada no manejo da DPN, muitas vezes é utilizada como abordagem inicial, o que tem uma eficácia comparativa com os agentes aprovados pelo FDA. Os antidepressivos tricíclicos (por exemplo, amitriptilina) – agentes DPN não aprovados pelo FDA – são eficazes no manejo da DPN, mas devem ser usados com cautela devido ao maior risco de efeitos colaterais.
Tabela 8. Agentes Farmacológicos Comumente Utilizados para DPN4,69 |
|||||
|
Agente farmacêutico (gama NNT 30-50% de melhoria*) > |
Dose máxima diária para DNP (mg/dia) |
Efeitos colaterais comuns |
Ajustes de dosagem necessários? |
Contraindicações |
Prescrições |
|
Anticonvulsivos
|
|||||
|
Pregabalina (3.3-8.3) |
Dizziness Somnolence Ganho de peso Edema Periférico Obscurecimento da visão |
Renal: Sim Hepático: Não |
Hipersensibilidade à pré-gabalina > |
>
Fortíssimas evidências; aprovado pela FDA; substância controlada |
|
|
Gabapentina (3.3-7.2) |
3,600 |
Tonturas Ataxia Somnolência Chuvas Nausea Diarreia Ganho de peso |
Renal: Sim > Hepático: Não |
Hipersensibilidade à gabapentina |
Provas moderadas; não aprovadas pelo FDA |
|
Antidepressivos
|
|||||
|
Amitriptilina (2.1-4.2) |
Sedação severa; confusão; efeitos anticolinérgicos (obstipação, visão turva) |
Renal: Não Hepática: Não > Doses mais baixas são recomendadas para pacientes idosos |
>
Hipersensibilidade à amitriptilina; co-administração com ou dentro de 14 dias após a MAO; co-administração com cisapride; fase de recuperação aguda após infarto do miocárdio |
Provas moderadas; não aprovadas pelo FDA; uso com cautela para aqueles com histórico de doença cardiovascular |
|
|
Duloxetina (3.8-11) |
(E.U.A.) |
Nausea; sedação; sonolência generalizada |
Renal: Sim Hepática: Evitar o uso em insuficiência hepática |
Hipersensibilidade; co-administração com ou dentro de 14 dias após a MAO; iniciação naqueles que estão recebendo linezolida ou azul de metileno IV |
Provas moderadas; Aprovado pelo FDA; Pode ser adicionado à pregabalina ou gabapentina |
|
Venlafaxina (5.2-8.4) |
Nausea; sedação; sonolência generalizada |
Renal: Sim Hepática: Sim > |
Pouca evidência; Não aprovado pela FDA; pode ser adicionado à gabapentina |
||
|
Tramadol (2.1-6.4) > |
Somnolência Nausea Vomitar Constipação Cabeça leve Tonteiras Cabeça de cabeça Chefe de ouvido |
Renal: Sim > Hepática: Não |
Hipersensibilidade ao tramadol, opiáceos, ou qualquer componente da formulação; Formulação do RER: depressão respiratória significativa e asma aguda ou grave; Formulação do RIR: intoxicação aguda com álcool, hipnóticos, narcóticos, analgésicos de ação central, opióides ou drogas psicotrópicas; |
Baixo potencial de abuso (substância controlada por Programa IV); Não recomendado para uso como agente de primeira ou segunda linha |
|
|
Tapentadol (N/A) |
Lançamento imediato: Lançamento estendido: |
Somnolência Nausea Vomitar Constipação Tonturas |
Renal: Não utilizar quando Hepatic: Não |
Hipersensibilidade ao tapentadol; Depressão respiratória significativa; Asma aguda ou grave; Íleo paralítico; Em 14 dias de uso de inibidores da MAO |
FDA aprovado; substância controlada Schedule II; não recomendado para uso como agente de primeira ou segunda linha |
A directriz da Academia Americana de Neurologia (AAN) recomenda os seguintes agentes tópicos: capsaicina e isosorbida dinitrato spray (evidência moderada) e adesivo de Lidoderm (evidência fraca).69 Oxcarbazepina, lamotrigina, lacosamida, clonidina, pentoxifilina e mexiletina não são recomendados na diretriz AAN no tratamento de DPN.69
Além disso, opioides têm sido recomendados por alguns para uso em DPN refratários. Os opióides recomendados pela diretriz AAN incluem dextrometorfano (400 mg/dia), sulfato de morfina (titulado a 120 mg/dia) e oxicodona (média 37 mg/dia, máximo 120 mg/dia); entretanto, não há dados suficientes para sugerir o uso de um agente sobre o outro.69 Os autores deste trabalho recomendam o uso de opióides apenas em casos refratários graves, com acompanhamento próximo dos pacientes que obtêm verdadeira melhora funcional dos opióides. Os autores seguem a afirmação de 2016 do Centers for Disease Control and Prevention de que os opióides têm uso limitado a longo prazo em dor não carcinogênica.70
Um dos desafios do tratamento farmacológico DPN é a inadequação de estudos frente a frente incorporando resultados de qualidade de vida.4 Um estudo recente comparando uma terapia de oito semanas entre pré-gabalina de alta dose, duloxetina de alta dose, ou em uma combinação não encontrou diferenças significativas na mudança média da dor entre monoterapia e terapia combinada.71 Mais estudos comparando dois agentes ativos são necessários para fornecer informações sobre como melhorar os cuidados para aqueles que sofrem de neuropatia periférica diabética.
Tratamento não-farmacológico. Procedimentos. A diretriz ANN sugere considerar a estimulação percutânea do nervo elétrico por três a quatro semanas para o tratamento do DPN.69 Um estudo piloto, acupuntura de dois tipos, randomizado e controlado72 e um estudo único cego, placebo-controlado e randomizado73 avaliando a eficácia da acupuntura em DPN, ambos mostraram melhorias nas medidas de resultados associados à dor. Entretanto, estudos adicionais são necessários para confirmar o papel da acupuntura no manejo do DPN.
Ácido alfa-lipóico. Algumas evidências sugerem que o uso de ácido alfa-lipóico antioxidante pode ajudar a reduzir o estresse oxidativo mediado por radicais livres e proporcionar os seguintes benefícios: direcionar a patogênese, retardar o desenvolvimento e melhorar os sintomas do DPN.74,75
Prevenção. Modificações no estilo de vida, com foco em dieta saudável e atividade física, têm demonstrado diminuir continuamente a prevalência de diabetes e suas complicações, incluindo neuropatia periférica diabética.68 O controle glicêmico intensivo tem demonstrado ajudar a diminuir o risco de neuropatia diabética em pacientes com diabetes através da melhoria da função nervosa.61,76,77 O DCCT estabeleceu o papel do controle glicêmico na prevenção e cessação da progressão da neuropatia diabética no diabetes tipo 1.10,56
Pérolas Clínicas
- Até 50% dos pacientes podem ter neuropatia periférica indolor ou assintomática.
- Patientes com neuropatia são recomendados para receber educação sobre cuidados com os pés (auto-inspecção diária dos pés) e cuidados podiátricos regulares para pacientes selecionados.
- Patientes com DPN que apresentam sinais de perda da sensação de proteção com ou sem deformidade devem ser aconselhados a acompanhar um médico a cada três a seis meses para medidas preventivas.64
- Para gerenciar eficazmente os sintomas do DPN, uma abordagem multidisciplinar torna-se essencial; esta abordagem abrangente pode incluir farmacologia, psicologia e/ou fisioterapia.
- Uma nova posição sobre neuropatia diabética publicada pela ADA recomenda o rastreamento de DPN em pacientes com prediabetes que exibem sintomas de neuropatia periférica.4
- Serviço especial é necessário para pessoas com doença periférica, neuropatia não-sensorial ou pé de Charcot.
Gastroparese
Uma outra forma de neuropatia diabética é a gastroparese. Esta condição está associada a sintomas gastrointestinais superiores, incluindo náuseas, vômitos, saciedade precoce ou plenitude pós-prandial, dor abdominal e inchaço, mas na ausência de obstrução de saída. Embora existam várias causas de gastroparese, estima-se que a diabetes seja responsável por cerca de um terço de todos os casos.78
Patofisiologia. Os mecanismos fisiopatológicos propostos para a gastroparese diabética incluem controle glicêmico comprometido, neuropatia dos gânglios simpáticos vagais ou pré-vertebrais, anormalidades das células intersticiais de Cajal, perda de óxido nítrico sintase e, possivelmente, miopatia.79,80
Apresentação clínica. No início desta condição, os pacientes são geralmente assintomáticos. Não existe uma relação linear entre os sintomas e a gravidade da neuropatia. A grande variedade de sintomas torna difícil o diagnóstico da condição. Outras apresentações clínicas incluem anorexia, desnutrição, perda de peso e hipoglicemia por desadequação da absorção de alimentos e insulina. Na verdade, a dor pode ser pouco relatada, mas significativa para muitas pessoas. Em um consórcio financiado pela NIH, 72% dos pacientes com gastroparesia tinham dor abdominal.81 Este foi o sintoma dominante em 18% desses pacientes. A dor foi induzida pela alimentação (72%), foi noturna (74%) e interferiu no sono (66%) desses pacientes.81
Onde é comum a gastroparese da diabetes? A incidência acumulada de 10 anos de gastroparesia foi estimada em 5,2% na diabetes tipo 1 e 1% na diabetes tipo 2 entre os pacientes comunitários com diabetes.82 Outros estudos encontraram taxas entre 5-12%.83,84 Entretanto, as taxas são muito maiores quando o diagnóstico é baseado em sintomas e não no estudo de esvaziamento gástrico.
Gastroparese é mais comum no diabetes tipo 1 do que no diabetes tipo 2, e é mais comumente observada após a pessoa ter tido diabetes por mais de 10 anos e ter desenvolvido as outras complicações microvasculares da retinopatia, nefropatia e neuropatia periférica. Se um paciente apresenta gastroparese mais cedo do que o esperado, outras etiologias devem ser exploradas, mais comumente lesão do nervo vagal perioperatório ou efeitos farmacológicos de agentes incrementais – agonistas receptores do peptídeo 1 tipo glucagon (GLP-1RA) e inibidores da dipeptidase 4 (inibidores DPP-4).
Quando um paciente desenvolve sintomas de gastroparese, os sintomas tipicamente persistem e são estáveis durante 12-25 anos. Isto é verdade mesmo que haja melhor controle da glicose,85 exceto no caso de um transplante de pâncreas e rins.86 Embora não haja evidências claras de que a gastroparese aumente a própria mortalidade, ela reduz substancialmente todos os aspectos da qualidade de vida.87
Diagnóstico. Uma série de testes pode ajudar no diagnóstico. O padrão ouro para este diagnóstico é a cintilografia gastroesofágica. Ela é não invasiva, testa fisiologia e fornece resultados quantitativos. A gastroparese pode ser diagnosticada se houver pelo menos 35% de retenção de uma refeição padrão com baixo teor de gordura quatro horas após a dobradura.80
Para fornecer os resultados mais precisos do teste, o protocolo de pré-teste deve incluir a descontinuação de todos os medicamentos que alteram a motilidade por pelo menos dois a três dias antes do teste, incluindo pró-cinética, opiáceos e anticolinérgicos. Agentes de aumento, tais como agonistas GLP-1 e inibidores de DPP-4, também devem ser interrompidos, pois são conhecidos por retardar o esvaziamento gástrico. A hiperglicemia também tem demonstrado retardar o esvaziamento gástrico e a glicose deve estar abaixo de 275 mg/dL antes de iniciar o estudo.79,88
As pacientes devem se abster de fumar e consumir álcool no dia do teste, pois ambos podem retardar o esvaziamento gastroesofágico.89 Além disso, os GLP-1RAs podem exacerbar a gastroparese, pois retardam o esvaziamento gástrico. Além disso, algumas pessoas podem ter gastroparese subclínica que é descoberta quando uma GLP-1RA é iniciada.
Tratamento. O tratamento da gastroparese depende em grande parte da gravidade dos sintomas. Os princípios gerais de tratamento incluem tratamentos de suporte (fluidos, eletrólitos, controle da glicose e nutrição), tratamentos médicos (pró-cinética, antieméticos e alívio da dor) e tratamentos invasivos (cirurgia, injeções de Botox, estimulação gástrica ou elétrica).79
Tratamento suportivo geralmente é iniciado no hospital e é focado na normalização de fluidos, eletrólitos e distúrbios nutricionais. Ao fornecer suporte nutricional, a alimentação enteral é preferível à alimentação parenteral, pois é mais fisiológica e pode ajudar a manter a flora intestinal. Além disso, alterações na dieta podem ser muito úteis na gastroparese. Dietas de baixa fibra, baixo teor de gordura e baixo resíduo são recomendadas para pacientes com gastroparese.85 Dietas de alta fibra podem aumentar os sintomas, já que requerem mais digestão.
Medicamentos. Prokinetics: Nos Estados Unidos, metoclopramida e eritromicina são os medicamentos mais utilizados para tratar a gastroparese. No entanto, a metoclopramida tem um aviso de caixa negra devido ao risco de discinesia tardive. O desenvolvimento desta condição está directamente relacionado com a duração do uso da metoclopramida e com o número de doses tomadas. Ao usar este medicamento, é melhor usá-lo apenas em pacientes sintomáticos e começar com a dose eficaz mais baixa 15 minutos antes das refeições. As férias do medicamento às vezes pode ajudar a prolongar a duração dos efeitos.90
Domperidona é um agonista mais selectivo da dopamina que é igualmente eficaz para a metoclopramida mas tem menos efeitos secundários no sistema nervoso central.91
Antiemética: Os antieméticos podem ser usados para ajudar com os sintomas. No entanto, o risco de interações medicamentosas é significativo e deve ser monitorado cuidadosamente.
O tratamento da dor pode ser um desafio em pacientes com gastroparese. Os antidepressivos tricíclicos são frequentemente utilizados como terapia de primeira linha para a dor na gastroparese. As abordagens de segunda linha são o agonista receptor de mu-opioides fraco, o tramadol, que também libera serotonina e inibe a recaptação de norepinefrina, e o ácido gama-aminobutírico análogo, gabapentina. No entanto, o uso de narcóticos na gastroparese não é recomendado, pois pode contribuir para a constipação e agravamento dos sintomas.
Tratamentos invasivos: Injeções de Botox são comumente usadas no tratamento da gastroparese, mas seu uso não é apoiado em ensaios clínicos.92,93
O dispositivo de estimulação elétrica gástrica foi aprovado pelo FDA sob uma isenção de dispositivo humanitário em 2000.94 O dispositivo de estimulação elétrica gástrica fornece estimulação elétrica de alta freqüência e baixa energia ao estômago. Ele é mais útil na gastroparese diabética do que na gastroparese idiopática. Uma meta-análise mostrou benefícios substanciais nos sintomas do paciente. O mecanismo exato de seu benefício ainda não é conhecido.95 Tem sido proposto que a estimulação elétrica gástrica resulta em mudanças nos mecanismos centrais que controlam náuseas e vômitos, aumenta a função vagal e resulta em diminuição da sensibilidade à distensão.97 Pacientes que respondem bem normalmente respondem rapidamente. Isso levou alguns a recomendar um estudo com colocação temporária do eletrodo antes da implementação a longo prazo.
Pérolas Clínicas
- Gastroparese diabética é mais comum em pessoas com diabetes de longa data e naquelas com outras complicações microvasculares.
- O diagnóstico padrão ouro para gastroparese é a cintilografia gastroesofágica.
- Dietas de baixa fibra, baixo teor de gordura e baixo resíduo são recomendadas na gastroparese diabética.
- Tratamentos farmacológicos e intervencionistas têm benefícios limitados e risco significativo a longo prazo.
Quiroartropatia diabética
Uma das complicações menos conhecidas da diabetes é a quiroartropatia. Esta condição é caracterizada pela limitada mobilidade articular devido ao espessamento da pele em pessoas com diabetes de longa data. Provavelmente foi a primeira complicação identificada a partir da diabetes tipo 1. As taxas de prevalência variam amplamente de 8-50%.98
Cheiroartropatia acredita-se que seja causada pela glicosilação e pela ligação cruzada do colágeno. Pode afetar a pele e os tendões, e pode resultar em mobilidade articular limitada, mais comumente extensão dos dedos, rigidez e dor. O clássico sinal de exame físico para a quiropatia diabética é o “sinal de oração”. Nesta condição, uma pessoa é incapaz de achatar completamente as mãos para “rezar”, deixando um espaço entre os dedos da mão esquerda e direita. Há evidências de que aqueles que desenvolvem quiropatia têm um risco três vezes maior de complicações microvasculares.99
Quiropatia diabética normalmente é pior naqueles com glicemia de longa duração ou mal controlada. Felizmente, muitas pessoas experimentam alívio dos sintomas e melhora da mobilidade quando o controle da glicose melhora.100
Conclusão
O gerenciamento de complicações da diabetes requer uma equipe multidisciplinar. O rastreio precoce da retinopatia, nefropatia e neuropatia é essencial, dada a natureza assintomática da doença. A marca registrada do manejo do diabetes para todas as complicações continua sendo a glicemia e o controle da pressão arterial.
- American Diabetes Association. Custo da Diabetes. Disponível em: http://www.diabetes.org/advocacy/news-events/cost-of-diabetes.html?referrer=https://www.google.com/. Atualizado em 22 de junho de 2015. Acessado em: 8 de fevereiro de 2017.
- UK Prospective Diabetes Study Group. Controlo intensivo da glicemia com sulfonilureia ou insulina em comparação com o tratamento convencional e risco de complicações em doentes com diabetes tipo 2. Lancet 1998;352:837-853.
- Gregg EW, Yanfed L, Wang J. Changes in diabetes-related complications in the United States, 1990-2010. N Engl J Med 2014;370:1514-1523.
- Pop-Busui R, Boulton A, Feldman E, et al. Diabetes neuropathy: Uma declaração de posição da Associação Americana de Diabetes. Diabetes Care 2017;40:136-154.
- Leasher JL, Bourne RR, Flaxman SR, et al. Estimativas globais sobre o número de pessoas cegas ou deficientes visuais por retinopatia diabética: Uma meta-análise de 1990 a 2010. Diabetes Care 2016;39:1643-1649.
- National Eye Institute. Fatos sobre a doença diabética dos olhos. Disponível em: https://nei.nih.gov/health/diabetic/retinopathy. Atualizado em: setembro de 2015. Acesso em: 8 de fevereiro de 2017.
- Fong, DS, Aiello L, Gardner TW, et al. Retinopatia em diabetes. Diabetes Care 2004;27(Suppl 1):S84-S87.
- American Diabetes Association. Standards of Medical Care in Diabetes-2017. Diabetes Care 2017;40:(Suppl 1):S4-S5.
- Doggen K, Nobels F, Scheen AJ, et al. Factores de risco cardiovascular e complicações associadas à albuminúria e função renal comprometida no diabetes tratado com insulina. J Diabetes Complications 2013;27:370-375.
- The Diabetes Control and Complications Trial Research Group. O efeito do tratamento intensivo da diabetes no desenvolvimento e progressão das complicações a longo prazo no diabetes mellitus insulino-dependente. N Engl J Med 1993;329:977-986.
- Action to Control Cardiovascular Risk in Diabetes Follow-On (ACCORDION) Eye Study Group and the Action to Control Cardiovascular Risk in Diabetes Follow-On (ACCORDION) Study Group. Efeitos persistentes do controle glicêmico intensivo sobre a retinopatia na diabetes tipo 2 no estudo de seguimento da Ação para Controle do Risco Cardiovascular na Diabetes (ACCORD). Diabetes Care 2016;39:1089-1100.
- ACCORD Study Group, ACCORD Eye Study Group, Chew EY, et al. Effects of medical therapies on retinopathy progression in type 2 diabetes. N Engl J Med 2010;363:233-244.
- Chew EY, Davis MD, Danis RP, et al. The effects of medical management on the progression of diabetic retinopathy in persons with type 2 diabetes: O Estudo da Ação para Controle do Risco Cardiovascular na Diabetes (ACCORD). Ophthalmology 2014;121:2443-2451.
- Diabetes Control and Complications Trial Research Group. Efeito da gravidez nas complicações microvasculares no Ensaio de Controlo e Complicações da Diabetes. Diabetes Care 2000;23:1084-1091.
- Colberg SR, Sigal RJ, Yardley JE, et al. Atividade física/exercício e diabetes: Uma declaração de posição da Associação Americana de Diabetes. Diabetes Care 2016;39:2065-2079.
- The Diabetic Retinopathy Study Research Group. Relatório preliminar sobre os efeitos da terapia de fotocoagulação. Am J Ophthalmol 1976;81:383-396.
- Early Treatment Diabetic Retinopathy Study Research Group. Fotocoagulação para edema macular diabético: Tratamento precoce Estudo de Retinopatia Diabética relatório número 1. Arch Ophthalmol 1985;103:1796-1806.
- Nguyen QD, Brown DM, Marcus DM, et al. Ranibizumab para edema macular diabético: Resultados de 2 ensaios aleatórios fase III: RISE e RIDE. Ophthalmology 2012;119:789-801.
- Wong TY, Cheung CMG, Larsen M, et al. Diabetic retinopathy. Nat Rev Disease Prim doi:10.1038/nrdp.2016.12; publicado online 17 de março de 2016.
- Batuman V, Soman AS, Schmidt RJ, Soman SS. Diabetes nefropatia. Medscape Disponível em: http://emedicine.medscape.com/article/238946-overview. Atualizado em 30 de setembro de 2016. Acessado em: 12 de fevereiro de 2017.
- Tuttle KR, Bakris GL, Bilous RW, et al. Diabetic kidney disease: Um relatório de uma Conferência de Consenso da ADA. Diabetes Care 2014;37:2864-2883. https://doi.org/10.2337/dc14-1296
- Patel A, MacMahon S, Chalmers J, et al. Controle intensivo da glicemia e resultados vasculares em pacientes com diabetes tipo 2. N Engl J Med 2008;358:2560-2572.
- Duckworth W, Abraira C, Moritz T, et al. Controle da glicose e complicações vasculares em veteranos com diabetes tipo 2. N Engl J Med 2009;360:129-139.
- Ismail-Beigi F, Craven T, Banerji MA, et al. Efeito do tratamento intensivo da hiperglicemia nos resultados microvasculares no diabetes tipo 2: Uma análise do ensaio aleatório ACCORD. Lancet 2010;376:419-430.
- National Kidney Foundation. KDOQI clinical practice guideline for diabetes and CKD: 2012 update. Am J Kidney Dis 2012;60:850-886.
- Fox CS, Matsushita K, Woodward M, et al. Chronic Kidney Disease Prognosis Consortium. Associações de doenças renais com medidas de mortalidade e doença renal em fase terminal em indivíduos com e sem diabetes: Uma meta-análise. Lancet 2012;380:1662-1673.
- Hahr AJ, Molitch ME. Tratamento da diabetes mellitus em pacientes com doença renal crônica. Clin Diabetes Endocrinol 2015. doi: 10.1186/s40842-015-0001-9.
- Alsaad KO, Herzenberg AM. Distinguindo a nefropatia diabética de outros casos de glomerulosclerose: Uma actualização. J Clin Pathol 2007;60:18-26.
- Narva AS, Bilous RW. Avaliação laboratorial da doença renal diabética. Diabetes Spectr 2015;28:162-166.
- Levey AS, Stevens LA, Schmid CH, et al. Uma nova equação para estimar a taxa de filtração glomerular. Ann Intern Med 2009;150:604-612.
- National Kidney Foundation. KDOQI clinical practice guidelines for chronic kidney disease: Avaliação, classificação e estratificação. Am J Kidney Dis 2002;39(2 Suppl 1):S1-S266.
- de Boer IH, Rue TC, Cleary PA, et al. Desfechos renais a longo prazo de pacientes com diabetes mellitus tipo 1 e microalbuminúria: Uma análise do Ensaio de Controlo de Diabetes e Complicações/Epidemiologia de Intervenções Diabéticas e Coorte de Complicações. Arch Intern Med 2011;171:412-420.
- Wanner C, Inzucchi SE, Lachin JM, et al. Empagliflozin e progressão da doença renal na diabetes tipo 2. N Engl J Med 2016;375:323-334.
- Heerspink HJL, Desai M, Jardine M, et al. Canagliflozin retarda a progressão do declínio da função renal independentemente dos efeitos glicêmicos. J Am Soc Nephrol 2016;28:1-8.
- Lexi-Drogas. Lexicomp. Wolters Kluwer Health, Inc. Riverwoods, IL. Disponível em: http://online.lexi.com. Acesso em: 31 de outubro de 2016.
- Micromedex Solutions. Truven Health Analytics, Inc. Ann Arbor, MI. Disponível em: http://www.micromedexsolutions.com. Acesso em: 31 de outubro de 2016.
- James PA, Oparil S, Carter BL, et al. 2014 diretriz baseada em evidências para o gerenciamento da pressão arterial alta em adultos. JAMA 2014;311:507-520.
- King P, Peacock I, Donnelly R. The United Kingdom Prospective Diabetes Study (UKPDS): Implicações clínicas e terapêuticas para a diabetes tipo 2. Br J Clin Pharmacol 1999;48:643-648.
- Jackevicius CA, Wong J, Aroustamian I, et al. Taxas e preditores de descontinuação do inibidor da ECA após a elevação da creatinina sérica: Um estudo de coorte retrospectivo. BMJ Open 2014;4:e005181.
- Mauer M, Zinman B, Gardiner R, et al. Efeitos renais e retinais do enalapril e do losartan na diabetes tipo 1. N Engl J Med 2009;361:40-51.
- Bilous R, Chaturvedi N, Sjølie AK, et al. Efeito do candesartan na microalbuminúria e na taxa de excreção de albumina na diabetes: Três ensaios aleatórios. Ann Intern Med 2009;151:11-20.
- Haller H, Ito S, Izzo JL Jr, et al. Olmesartan para o atraso ou prevenção da microalbuminúria na diabetes tipo 2. N Engl J Med 2011;364:907-917.
- Makani H, Bangalore S, Desouza KA, et al. Eficácia e segurança do bloqueio duplo do sistema renina-angiotensina: Meta-análise de ensaios aleatórios. BMJ 2013;346:f360.
- Miao Y, Ottenbros SA, Laverman GD, et al. Efeito de uma redução do ácido úrico nos resultados renais durante o tratamento com losartan: Uma análise post-hoc da redução dos desfechos em diabetes mellitus não dependente de insulina com o Ensaio do Antagonista de Angiotensina II Losartan. Hypertension 2011;58:2-7.
- Lewis EJ, Hunsicker LG, Clarke WR, et al. Renoprotective effect of the angiotensin-receptor antagonist irbesartan in patients with nephropathy due to type 2 diabetes. N Eng J Med 2001;354:851-860.
- Adler A, Casula A, Steenkamp R, et al. Association between glycemia and mortality in diabetic individuals on renal replacement therapy in the U.K. Diabetes Care 2014;37:1304-1311.
- Sharma SG, Bomback AS, Radhakrishnan J, et al. The modern spectrum of renal biopsy findings in patients with diabetes. Clin J Am Soc Nephrol 2013;8:1718-1724.
- Smart NA, Dieberg G, Ladhani M, Titus T. Encaminhamento precoce para serviços especializados em nefrologia para prevenir a progressão para doença renal em estágio final. Cochrane Database Syst Rev 2014;6:CD007333.
- Boulton AJM, Gries FA, Jervell JA. Guidelines for the diagnosis and outpatient management diabetic peripheral neuropathy. Diabet Med 1998;15:508-514.
- O’Brien PD, Hinder LM, Sakowski SA, Feldman EL. ER stress in diabetic peripheral neuropathy: Um novo alvo terapêutico. Antioxid Redox Signal 2014;21:621-633.
- Cameron NE, Cotter MA. Mecanismos pró-inflamatórios na neuropatia diabética: Foco no caminho do factor nuclear kappa B. Curr Drug Targets 2008;9:60-67.
- Tesfaye S, Chaturvedi N, Eaton SE, et al. Vascular risk factors and diabetic neuropathy. N Engl J Med 2005;352:341-350.
- Wiggin TD, Sullivan KA, Pop-Busui R, et al. Triglicérides elevados correlacionados com a progressão da neuropatia diabética. Diabetes 2009;58:1634-1640.
- Stella P, Ellis D, Maser RE, Orchard TJ. Neuropatia cardiovascular autonômica (expiração e relação de inspiração) em diabetes tipo 1. Incidência e preditores. J Diabetes Complicications 2000;14:1-6.
- Witten DR, Tesfaye S, Chaturvedi N, et al. Fatores de risco para neuropatia autonômica cardíaca no diabetes mellitus tipo 1. Diabetologia 2005;48:164-171.
- Diabetes Control and Complication Trial (DCCT) Research Group. Efeito do tratamento intensivo da diabetes na condução nervosa no Ensaio de Controlo e Complicações da Diabetes. Ann Neurol 1995;38:869-880.
- Grupo de Pesquisa de Controle e Complicação do Diabetes (DCCT). O efeito da terapia intensiva da diabetes nas medidas de função do sistema nervoso autônomo no Diabetes Control and Complications Trial (DCCT). Diabetologia 1998;41:416-423.
- Edwards JL, Vincent AM, Cheng HT, Feldman EL. Neuropatia diabética: Mecanismos de gestão. Pharmacol Ther 2008;120:1-34.
- Vincent AM, Callaghan BC, Smith AL, Feldman EL. Neuropatia diabética: Mecanismos celulares um alvo terapêutico. Nat Rev Neurol 2011;7:573-583.
- Kellogg AP, Wiggin T, Larkin D, et al. Efeitos protetores da inativação do gene ciclooxigenase-2 contra disfunção nervosa periférica e perda intraepidérmica de fibras nervosas no diabetes experimental. Diabetes 2007;56:2997-3005.
- Callaghan BC, Cheng HT, Stables CL, et al. Diabetic neuropathy: Manifestações clínicas e tratamentos atuais. Lancet Neurol 2012;11:521-534.
- Boulton AJM, Kirsner RS, Vileikyte L. Prática clínica: Úlceras neuropáticas do pé diabético. N Eng J Med 2004;351:48-55.
- Boulton AJM, Vinik AI, Arezzo JC, et al. Neuropatias diabéticas: Uma declaração da Associação Americana de Diabetes. Diabetes Care 2005;28:956-962.
- Boulton AJM, Armstrong DG, Albert SF, et al. Exame completo do pé e avaliação de risco: Um relatório da força-tarefa do grupo de interesse do cuidado do pé da Associação Americana de Diabetes, com endosso da Associação Americana de Endocrinologistas Clínicos. Diabetes Care 2008;31:1679-1685.
- Tesfaye S, Boulton AJ, Dyck PJ, et al. Diabetic neuropathies: Atualização sobre definições, critérios diagnósticos, estimativa de gravidade e tratamentos. Diabetes Care 2010;33:2285-2293.
- Dyke PJ, Albers JW, Andersen H, et al. Diabetic polyneuropathies: Atualização na definição da pesquisa, critérios diagnósticos e estimativa da gravidade. Diabetes Metab Res Rev 2011;27:620-628.
- Freeman R. Nem toda neuropatia é diabetes é de etiologia diabética: Diagnóstico diferencial da neuropatia diabética. Curr Diabe Rep 2009;9:423-431.
- Balducci S, Iacobellis G, Parisi L, et al. O treinamento do exercício pode modificar a história natural da neuropatia periférica diabética. J Diabetes Complications 2006;20:216-223.
- Bril V, England J, Franklin GM, et al. Evidence-based guideline: Tratamento da neuropatia diabética dolorosa. Relatório da Academia Americana de Neurologia, da Associação Americana de Medicina Neuromuscular e Eletrodiagnóstico e da Academia Americana de Medicina Física e Reabilitação. Neurologia 2011;76:1758-1765.
- Dowell D, Haegerich TM, Chou R. CDC Guideline for presribing opioids for chronic pain – Estados Unidos 2016. MMWR Recomendação Rep 2016;65:1-49.
- Tesfaye S, Wilhelm S, Lledo A, et al. Duloxetina e pregabalina: Monoterapia de alta dose ou sua combinação? O “estudo COMBO-DN” – um estudo multinacional, randomizado, duplo-cego, em grupo paralelo em pacientes com dor neuropática periférica diabética. Dor 2013;154:2616-2625.
- Ahn AC, Bennani T, Freeman R, et al. Dois estilos de acupunctura para o tratamento da neuropatia diabética dolorosa – um estudo piloto de controle aleatório. Acupunct Med 2007;25:11-17.
- Garrow A, Xing M, Vere J, et al. Role of acupuncture in the management of diabetic painful neuropathy (DPN): Um RCT piloto. Acupunct Med 2014;32:242-249.
- Ziegler D, Nowak H, Kempler P, et al. Tratamento da polineuropatia diabética sintomática com o ácido alfa-lipóico antioxidante: Uma meta-análise. Diabet Med 2004;21:114-121.
- Ziegler D, Low PA, Litchy WJ, et al. Eficácia e segurança do tratamento antioxidante com ácido alfa-lipóico durante 4 anos em polineuropatia diabética: O ensaio NATHAN 1. Diabetes Care 2011;34:2054-2060.
- Kuwabara S, Ogawara K, Harrori T, et al. Os efeitos agudos do controle glicêmico sobre a excitabilidade axonal em nervos diabéticos humanos. Intern Med 2002;41:360-365.
- Peltier A, Goutman SA, Callaghan BC. Neuropatia diabética dolorosa. BMJ 2014;348:g1799.
- Soykan I, Sivri B, Sarosiek I, et al. Demografia, características clínicas, perfis psicológicos e de abuso, tratamento e acompanhamento a longo prazo de pacientes com gastroparese. Dig Dis Sci 1998;43:2398-2404.
- Camilleri M, Bharucha AE, Farrugia G. Epidemiologia, mecanismos e manejo da gastroparese diabética. Clin Gastroenterol Hepatol 2011;9:5-12.
- Shin AS, Camilleri M. Avaliação diagnóstica da gastroparese diabética. Diabetes 2013;62:2667-2673.
- Hasler WL, Wilson L, Parkman HP, Lee L. Importância da dor abdominal como sintoma na gastroparese: Relação com fatores clínicos, gravidade da doença, qualidade de vida, retenção gástrica e uso de medicamentos. Gastroenterologia 2010;138. doi: 10.1016/S0016-5085(10)62131-2.
- Choung RS, Locke GR 3rd, Schleck CD, et al. Risco de gastroparese em indivíduos com diabetes tipo 1 e 2 na população geral. Am J Gastroenterol 2012;107:82-88.
- Maleki D, Locke GR III, Camilleri M, et al. Sintomas do trato gastrointestinal entre pessoas com diabetes mellitus na comunidade. Arch Intern Med 2000;160:2808-2816.
- Bytzer P, Talley NJ, Leemon M, et al. Prevalência de sintomas gastrointestinais associados ao diabetes mellitus: Um levantamento populacional de 15.000 adultos. Arch Intern Med 2001;161:1989-1996.
- Jones KL, Russo A, Berry MK, et al. Um estudo longitudinal do esvaziamento gástrico e sintomas gastrointestinais superiores em pacientes com diabetes mellitus. Am J Med 2002;113:449-455.
- Gaber AO, Hathaway DK, Abell T, et al. A melhora da função autonômica e gástrica no transplante pâncreas-rim vs. transplante renal isolado contribui para a qualidade de vida. Transplant Proc 1994;26:515-516.
- Punkkinen J, Färkkilä M, Mätzke S, et al. Sintomas do abdômen superior em pacientes com diabetes tipo 1: Não relacionado ao comprometimento no esvaziamento gástrico causado por neuropatia autonômica. Diabet Med 2008;25:570-577.
- Schvarcz E, Palmer M, Aman J, et al. A hiperglicemia fisiológica retarda o esvaziamento gástrico em indivíduos normais e pacientes com diabetes mellitus insulino-dependente. Gastroenterologia 1997;113:60-66.
- Miller G, Palmer KR, Smith B, et al. O fumo atrasa o esvaziamento gástrico de sólidos. Trip 1989;30:50-53.
- Rao AS, Camilleri M. Artigo de revisão: Metoclopramida e discinesia tardive. Aliment Pharmacol Ther 2010;31:11-19.
- Patterson D, Abell T, Rothstein R, et al. A double-blind multicenter comparison of domperidone and metoclopramide in the treatment of diabetic patients with symptoms of gastroparesis. Am J Gastroenterol 1999;94:1230-1234.
- Arts J, Holvoet L, Caenepeel P, et al. Ensaio clínico: Um estudo cruzado randomizado e controlado de injeção intrapilórica de toxina botulínica na gastroparese. Aliment Pharmacol Ther 2007;26:1251-1258.
- Friedenberg FK, Palit A, Parkman HP, et al. Botulinum toxin A para o tratamento do esvaziamento gástrico retardado. Am J Gastroenterol 2008;103:416-423.
- Dispensa de Dispositivo Humanitário para Dispositivo Enterra. Fed Reg 2000;65:78495-78496.
- O’Grady G, Egbuji JU, Du P, et al. Estimulação elétrica gástrica de alta freqüência para o tratamento da gastroparese: Uma meta-análise. World J Surg 2009;33:1693-1701.
- Reddymasu SC, Sarosiek I, McCallum RW. Gastroparese severa: Terapia médica ou estimulação eléctrica gástrica. Clin Gastroenterol Hepatol 2010;8:117-124.
- McCallum RW, Dusing RW, Sarosiek I, et al. Mecanismos de melhora sintomática após estimulação elétrica gástrica em pacientes gastroparéticos. Neurogastroenterol Motil 2010;22:161-167.
- Douloumpakas I, Pyrpasopoulou A, Triantafyllou A, et al. Prevalência de distúrbios músculo-esqueléticos em pacientes com diabetes mellitus tipo 2: Um estudo piloto. Hippokratia 2007;11:216-218.
- Rosenbloom AL, Silverstein JH, Lezotte DC. A mobilidade articular limitada no diabetes mellitus infantil indica aumento do risco de doença microvascular. N Engl J Med 1981;305;191-194.
- Lister DM, Graham-Brown RAC, Burden AC. Resolução da quiroartropatia diabética. Br Med J 1986;293:1537.