Introduction
Síndrome do cordão amarrado (TCS) é um distúrbio neurológico de desenvolvimento causado por um cono medular anormalmente baixo. Normalmente se apresenta na infância, mas pode persistir sem ser detectada até a idade adulta e pode estar associada a um lipoma intradural. Pacientes com anormalidades coexistentes (por exemplo, mielomeningocele) e sintomas clínicos claros (por exemplo, fraqueza progressiva das pernas, incontinência urinária) podem necessitar de tratamento cirúrgico. O objectivo da cirurgia é retirar a medula espinal para aliviar o estiramento da medula espinal. No entanto, as indicações para cirurgia permanecem controversas (1).
Em contraste, a fístula arteriovenosa espinhal dura (SDAVF) é uma condição adquirida. É a malformação vascular mais comum na coluna vertebral em adultos. Ela é formada no forame neural por uma conexão anormal e direta entre a artéria dural (que fornece a manga da raiz dural e a dura-máter dural adjacente) e a veia medular (que drena o plexo venoso coronário) (2, 3).
Pode apresentar dor nas costas e déficit neurológico progressivo. A SDAVF normalmente requer tratamento cirúrgico ou endovascular.
A coincidência de TCS, lipoma (ou lipomielomeningocele) e uma SDAVF ao nível sacral é muito rara. Nesta comunicação relatamos dois desses pacientes. (4-6).
Case Material
Case 1
Uma mulher de 30 anos de idade apresentou uma história de 10 anos de dor na coluna lombossacral; ela tinha tido uma radiação casual em ambos os membros inferiores. Após seu primeiro parto, ela desenvolveu dor nas costas. A RM demonstrou um cordão amarrado ao nível de L4 e um lipoma filum terminale. A RM também mostrou veias tortuosas na superfície da medula espinhal (Figura 1C). Nove anos depois, durante a segunda gravidez, ela notou fraqueza e perda sensorial, desequilíbrio com a incontinência urinária e fecal. Na admissão, ela apresentou fraqueza na flexão plantar bilateral (grau 4 de acordo com o sistema modificado do Conselho de Pesquisa Médica) e redução da sensação nas regiões glúteas e nas pernas, e na resposta plantar. Os sinais de Babinski e Rossolimo estavam presentes bilateralmente. A RM de repetição revelou alterações intra-espinais hiperintensas da coluna torácica em T2 e cono (Figuras 1A,B,D). Essas alterações foram consistentes com déficit neurológico e, após a exclusão de doenças desmielinizantes inflamatórias, baseadas em uma RM do cérebro e um teste de anticorpos aquaporina-4, diagnosticadas como mielopatia. Devido às veias tortuosas descritas na superfície da medula espinhal (Figura 1B), o paciente foi submetido a uma angiografia de subtração digital da coluna vertebral (ASD). A gama de ASD foi desde o nível Th6 até à artéria coccígea. Os resultados não revelaram qualquer malformação vascular. Portanto, o diagnóstico preliminar foi de TCS sintomática e lipoma filum terminale. Em vista da fraqueza e do déficit neurológico, foi planejada a retirada da medula espinhal sem ressecção do lipoma.
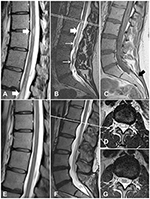
Figura 1. Imagens de RM da medula espinhal do caso 1, antes e depois do tratamento. (A) Alterações mielopáticas na medula espinhal torácica (setas brancas) (B) Alterações mielopáticas no cono medular (seta espessa) e vasos tortuosos espessados (setas finas). (C)A sequência T1WI mostra um lipoma terminal do filo (seta preta). (D) Uma seção transversal no nível L1/L2 mostra as alterações mielopáticas. (E-G) Imagens de acompanhamento demonstram a resolução das alterações mielopáticas e o desaparecimento das veias espessadas.
O canal sacral foi aberto com uma incisão mediana. A dura-máter era fina e transparente. Após uma dura-máter e incisão aracnoide, foi visualizado um tumor que parecia ser um lipoma. Engoliu o filum terminale e as raízes do nervo espinhal caudalmente, até o nível de S2. As raízes nervosas S1 e S2 foram posicionadas lateralmente ao tumor. Um vaso espesso, tortuoso e vermelho brilhante também foi observado no filum terminale, correndo no sentido cranial. A superfície externa da dura-máter foi explorada bilateralmente ao nível sacral, em busca de um SDAVF. Um nidus claramente visível foi identificado no nível S3, do lado esquerdo. Um teste empírico foi realizado para apoiar este achado. Um clipe foi colocado na veia arterializada, intraduralmente, durante alguns minutos. Em seguida, o vaso no terminal do filum mudou claramente de cor, de vermelho brilhante para cinza azulado, e sua tensão diminuiu. O SDAVF foi então desconectado intraduralmente, e o nidus foi coagulado extraduralmente. Além disso, o filum terminale foi cortado, e amostras de lipoma foram coletadas para histologia. A dura-máter foi suturada de forma estanque, e a ferida foi fechada em camadas.
O curso pós-operatório foi sem intercorrências. Alguns dias depois, a paciente recebeu alta. Uma ressonância magnética de seguimento mostrou resolução das alterações mielopáticas (Figuras 1E-G). No seguimento de 1 ano, a paciente apresentou melhora considerável, sem incontinência ou déficit motor.
Case 2
Um homem de 33 anos de idade apresentou uma história de 2 anos de dor na coluna lombossacral com fraqueza progressiva dos membros inferiores, frequência urinária e incontinência. Os sintomas intensificaram-se após o exercício e a permanência prolongada em pé. A RM da coluna lombar demonstrou uma medula amarrada ao nível da L3, um lipoma filum terminale e edema na medula espinhal. Também mostrou veias tortuosas na superfície posterior da medula espinhal (Figuras 2A,D).
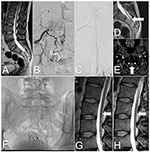
Figura 2. Imagens da medula espinhal do caso 2, antes e depois do tratamento. (A) Ressonância magnética com ponderação T2: Medula amarrada e lipoma sacral. (B) ASD: SDAVF no nível S2-S3 fornecido pelas artérias sacrais laterais. (C) ASD: Veias tortuosas na superfície posterior da medula espinhal cervical. (D) Ressonância magnética com peso T2: Veias tortuosas na superfície posterior da medula espinhal amarrada (seta). (E) IRM DE TOF: Veia de drenagem (seta) ao nível da junção atlanto-occipital. (F) A radiografia da área sacral mostra agentes embólicos após três embolizações. (G) RM lombar com ponderação T2: Após a última embolização, vasos tortuosos são visíveis na superfície posterior da medula espinhal (seta). (H) RM de seguimento: aos 6 meses após a cirurgia, as veias tortuosas não são mais observadas na superfície posterior da medula espinhal (seta).
O exame neurológico revelou fraqueza da flexão bilateral da articulação do quadril (grau 4 de acordo com o sistema modificado do Medical Research Council), fraqueza da flexão plantar (grau 3 de acordo com o sistema modificado do Medical Research Council), e redução da sensação nos dermatomas S2-S3. Os sinais Babinski e Rossolimo estavam presentes bilateralmente. Com base nos sinais clínicos e radiológicos, suspeitou-se da presença de um SDAVF. Uma ASD confirmou a SDAVF ao nível da S2-S3, na dura duração fornecida pelas artérias sacrais laterais e ramos das artérias ilíacas internas. Veias drenantes tortuosas estavam presentes na superfície posterior de toda a medula espinhal e terminadas intracronicamente (Figuras 2B,C,E).
O paciente foi submetido a três embolizações endovasculares, cada uma com um agente diferente. Primeiro, a embolização foi realizada com Onyx™ 18, administrada em dois microcateteres. Este tratamento resultou em uma oclusão da fístula. O paciente melhorou significativamente, mas devido à fraca penetração da veia drenante, após algumas semanas, a fístula recanalizou e os sintomas retornaram.
Uma segunda embolização foi realizada 4 meses depois. O acesso vascular à fístula foi mais complicado. Uma injeção de 25% Phil™ foi viável apenas através dos pequenos ramos sacros da artéria ilíaca interna esquerda. Este procedimento conseguiu uma redução significativa do fluxo através da fístula. Dezoito meses depois foi tentada a embolização da fístula com cola diluída. Apesar da boa oclusão da fístula observada em uma ASD, os vasos tortuosos permaneceram visíveis na RM de seguimento (Figuras 2F,G). Os sintomas persistiram e a paciente foi qualificada para tratamento cirúrgico.
O objetivo da cirurgia foi ocluir a veia drenante e o alimentador arterial e reduzir o lipoma. Com uma incisão mediana, o canal sacral foi aberto do lado direito. A dura-máter era espessa, e havia múltiplos vasos preenchidos com agentes embólicos. Havia um vaso grande, vermelho brilhante extraduralmente e um intraduralmente no nível S2-S3. Um clipe foi colocado sobre a veia arterializada intraduralmente por alguns minutos. Depois disso, o vaso mudou de cor e a tensão diminuiu. Ambos os vasos intra e extradurais foram coagulados. Em seguida, o lipoma foi visualizado e parcialmente removido. A dura-máter foi suturada de forma estanque, e a ferida foi fechada em camadas.
O curso pós-operatório foi sem intercorrências, e alguns dias depois, o paciente recebeu alta. Após 6 meses, uma RM de seguimento mostrou a ausência de vasos tortuosos na superfície posterior da medula espinhal e uma redução significativa das alterações mielopáticas (Figura 2H). No seguimento, a paciente melhorou consideravelmente, sem incontinência, alguma freqüência urinária e leve fraqueza (grau 4 de acordo com o sistema modificado do Medical Research Council).
Discussão
Co-ocorrência de TCS, um lipoma intradural e um SDAVF a nível sacral, apesar de excepcional, deve ser tido em mente, tendo em vista o número crescente de casos relatados. Este estudo descreveu o quinto e sexto desses casos, com uma SCT e uma SDAVF a nível sacral (Tabela 1). Recentemente, um desses casos foi listado por Horiuchi et al. e mais dois foram adicionados por Talenti et al. (6, 8).

Tabela 1. Revisão da literatura sobre a coincidência da fístula arteriovenosa dural sacral (DAVF), síndrome do cordão amarrado (TCS) e lipoma/lipomielomeningocele filum terminale.
A causa desta tripla coincidência é enigmática. Por um lado, acredita-se que a SDAVF seja uma entidade adquirida, em contraste com as anomalias da coluna vertebral primária. Esta característica sugere que a coexistência destas patologias pode ser acidental. Por outro lado, lipomas e angiomas surgem ambos de uma origem mesenquimatosa. Relatos anteriores de MVA e lipoma intramedular combinados sugerem que pode haver uma correlação entre estas etiologias (9, 10). Entretanto, tanto quanto sabemos, nenhum estudo prévio descreveu a coexistência de anomalias disgráficas e um SDAVF a nível sacral, que se apresentou na infância. Além disso, uma pesquisa na base de dados Medline não revelou qualquer relato sobre uma SDAVF congênita. Entretanto, vários relatos descreveram uma SDAVF secundária a uma cirurgia ou trauma (11-15). Portanto, teoricamente, uma cirurgia anterior para uma mielomeningocele poderia subsequentemente desencadear a formação de uma SDAVF.
Estudos anteriores relataram que uma trombose do seio venoso com hipertensão intravenosa associada e uma obstrução da saída venosa poderia iniciar a formação de shunts (16-18). Portanto, uma explicação alternativa para a coexistência de distúrbios encontrados em nossos casos pode ter sido que um lipoma causou pressão, o que obstruiu a saída venosa, e assim, promoveu a formação de uma SDAVF. Este mecanismo alternativo não estaria relacionado a uma história prévia de trauma ou cirurgia.
As SDAVFs adquiridas estão tipicamente localizadas na região toracolombar, sendo a idade média de apresentação em torno de 60 anos (19). As SDAVFs sacrais são raras, e a idade média de apresentação das SDAVFs que coexistem com uma SCT é de 41 anos (Tabela 1). Portanto, também é possível que uma anomalia congênita, como um lipoma intradural, possa promover a formação de uma SDAVF em uma idade mais jovem. Recentemente, Horiuchi et al. descreveram dois casos e revisaram nove casos previamente publicados de SDAVF e MVA que coexistiram com lipomas espinhais de diferentes tipos e em diferentes níveis espinhais (8). Tanto Djindjian et al. quanto Horiuchi et al. postularam que o mecanismo mais provável subjacente a uma formação retardada de SDAVF pode ser a liberação adipocitária de fatores angiogênicos; esses fatores podem influenciar a angiogênese (20) e levar à hipervascularização local (5, 8). Além disso, Jellema et al. excluíram fatores protrombóticos na patogênese das SDAVFs (21).
A coincidência sintomática de SCT, lipoma sacral e SDAVF dá origem à pergunta: o que exatamente impulsiona os sintomas? Talenti et al. descreveram recentemente dificuldades diagnósticas e terapêuticas para dois casos semelhantes (6). Em ambos os pacientes, uma desparasitação inicial da medula espinal e a remoção do lipoma/lipomielomeningocele não resultou em melhoria ou deterioração. Após a angiografia espinhal, abordaram em seguida a patologia vascular da coluna vertebral. A história natural do lipoma filum terminale é benigna; apenas 5% dos pacientes apresentam sintomas de STC (22). Assim, o lipoma foi a causa menos provável de comprometimento neurológico. No entanto, até certo ponto, tanto o TCS quanto o SDAVF poderiam causar sintomas semelhantes. A SCT torna-se sintomática com maior freqüência em crianças do que em adultos (23). Em contraste, as deficiências relacionadas às SDAVFs desenvolvem-se em indivíduos mais velhos e de meia-idade. Além disso, as SDAVFs sacrais induzem hiperintensidades da medula espinhal, visíveis nas RMs ponderadas em T2, que normalmente desaparecem após o tratamento bem sucedido (24). Portanto, a causa mais provável de deterioração neurológica é a SDAVF, baseada na idade média dos pacientes com TCS, lipoma sacral e SDAVF coincidentes (ver Tabela 1) e baseada no bom resultado pós-operatório, ou seja, na resolução das alterações intramedulares, demonstrada nas RMNs. Além disso, ao contrário da SCT, os sintomas da SDAVF podem se exacerbar com o esforço físico e com o aumento da pressão intra-abdominal, como nos dois casos descritos neste estudo.
Em pacientes com essa tripla coincidência, a SDAVF sempre foi a causa direta do aumento dos sintomas. Portanto, o objetivo principal do tratamento deve ser a oclusão. Na literatura, a embolização endovascular pareceu ser tão eficaz quanto a cirurgia, sendo a embolização o único tratamento em casos semelhantes (24). Infelizmente, a embolização ou não foi viável ou ineficaz em nossos casos. Com a cirurgia, tanto o SDAVF quanto o TCS puderam ser explorados e tratados em um procedimento.
Em nosso primeiro caso, o objetivo inicial da cirurgia foi desbridar a medula espinhal, pois o SDAVF não foi confirmado em uma ASD pré-operatória. Entretanto, a questão permanece, por que a SDAVF foi obscurecida na ASD? Oldfield et al. descreveram três casos de SDAVFs que não foram detectados em uma ASD, mas eram altamente suspeitos, com base em outras modalidades de neuroimagem. Essas SDAVFs foram desconectadas com sucesso durante a cirurgia (25). Os fatores que impediram a detecção da ASD vertebral incluíram obesidade, aneurisma da aorta, aterosclerose aórtica com tortuosidade e obstrução dos orifícios ou tortuosidade das artérias lombares. Em nosso caso, uma possível explicação para os resultados falsos negativos da ASD poderia ser que a ASD não foi suficientemente minuciosa; assim, não examinamos o influxo do nível sacral.
Os dois casos descritos aqui mostraram que as SDAVFs sacrais podem ser difíceis de detectar nas ASDs e difíceis de ocluir com embolização endovascular. Estudos anteriores apresentados na Tabela 1 também descreveram embolizações sem sucesso no tratamento das SDAVFs (4, 6, 8). No total, houve 5 tentativas fracassadas de oclusão endovascular em 3 dos 6 casos relatados (Tabela 1). Assim, concluímos que uma abordagem cirúrgica pode ser superior à embolização endovascular, pois a cirurgia oferece um tratamento de uma etapa.
Observações Finais
A co-ocorrência de TCS, lipoma e SDAVF a nível sacral é excepcionalmente rara. Relatos anteriores e nossos achados revelam que a cirurgia pode ser superior à embolização endovascular para tratar SDAVFs sacrais com entidades coexistentes, pois a cirurgia oferece um tratamento de uma etapa. Um número crescente de casos relatados tem indicado que os sintomas desta tríplice desordem podem ser causados apenas pela SDAVF, e não pela TCS ou lipoma, que são claramente visíveis na neuroimagem.
Consentimento
Foi obtido um consentimento informado por escrito dos participantes para a publicação deste relato de caso.
Contribuições dos autores
PK desenhou o projeto e o revisou criticamente. ŁP preparou o manuscrito, coletou e revisou os dados. PJ, MZ, e MG coletaram dados de casos. BC revisou a anatomia. AM fez a aprovação final da versão a ser publicada.
Conflict of Interest Statement
Os autores declaram que a pesquisa foi realizada na ausência de quaisquer relações comerciais ou financeiras que pudessem ser interpretadas como um potencial conflito de interesses.
1. Drake JM. Manejo cirúrgico da medula espinhal amarrada – caminhando na linha fina. Foco em Neurocirurgia. (2007) 23:E4. doi: 10.3171/FOC-07/08/E4
PubMed Abstract | CrossRef Full Text
2. McCutcheon IE, Doppman JL, Oldfield EH. Anatomia microvascular das anormalidades arteriovenosas durais da coluna vertebral: um estudo microangiográfico. J Neurocirurgia. (1996) 84:215-20. doi: 10.3171/jns.1996.84.2.0215
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Gailloud P. Spinal dural arteriovenous fistula (SDAVF) variant with dual perimedullary and epidural drainage. Eur Spine J. (2017). 27(Suppl 3):375-9. doi: 10.1007/s00586-017-5298-x
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Krisht KM, Karsy M, Ray WZ, Dailey AT. Fístula arteriovenosa extraespinhal tipo I com lipomielomeningocele lombossacral: relato de caso e revisão da literatura. Relato de caso Neurol Med. (2015) 2015:526321. doi: 10.1155/2015/526321
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Djindjian M, Ayache P, Brugieres P, Poirier J. Lipoma sacral do filum terminale com fístula arteriovenosa dural. Relato de caso. J. Neurocirurgia. (1989) 71(5 Pt 1):768-71. doi: 10.3171/jns.1989.71.5.0768
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Talenti G, Vitale G, Cester G, Della Puppa A, Faggin R, Causin F. Rara associação entre fístulas arteriovenosas espinhais e disrafismos: relato de dois casos e revisão da literatura com foco em armadilhas no diagnóstico e tratamento. Neuroradiol Intervent. (2017) 23:458-64. doi: 10.1177/1591019917714636
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Przepiórka Ł, Kunert P, Juszynńska P, Zawadzki M, Ciszek B, Głowacki M, et al. Coincidência de cordão amarrado, lipoma filum terminale e fístula arteriovenosa sacral dural: relato de dois casos e uma revisão de literatura. Neurol frontal. (2018) 9:807. doi: 10.3389/fneur.2018.00807
CrossRef Full Text | Google Scholar
8. Horiuchi Y, Iwanami A, Akiyama T, Hikata T, Watanabe K, Yagi M, et al. Fístula arteriovenosa espinhal coexistente dentro de um lipoma espinhal: relato de dois casos. Casos da série medula espinhal (2017) 3:17079. doi: 10.1038/s41394-017-0011-1
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Weon YC, Chung JI, Roh HG, Eoh W, Byun HS. Malformação arteriovenosa intramedular espifnal combinada e lipomielomeningocele. Neuroradiology (2005) 47:774-9. doi: 10.1007/s00234-005-1336-1
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Arroz JF, Jelsma RK. Malformação arteriovenosa combinada e lipoma intramedular: cirurgia e emboloterapia. Am J Neuroradiol. (1986) 7:171–3.
PubMed Abstract | Google Scholar
11. Asakuno K, Kim P, Kawamoto T, Ogino M. Fístula arteriovenosa dural e síndrome cono medular progressiva como complicações da discectomia lombar. Relato de caso. J Neurocirurgia. (2002) 97(3 Suppl):375-9. doi: 10.3171/spi.2002.97.3.0375
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Kang JW, Koo JH, Kim DK, Joo YJ, Kim TH, Song SH. Mielopatia causada pela fístula arterio-venosa espinhal após a primeira fratura do corpo vertebral lombar – um relato de caso. Ann Rehabil Med. (2011) 35:729-32. doi: 10.5535/arm.2011.35.5.729
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Vankan Y, Demaerel P, Heye S, Van Calenbergh F, van Loon J, Maleux G, et al. Dural arteriovenous fistula as a late complication of upper cervical spine fracture. Relato de caso. J Neurocirurgia. (2004) 100(4 Suppl Spine):382-4. doi: 10.3171/spi.2004.100.4.0382
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Nishimura Y, Natsume A, Ginsberg HJ. Fístula arteriovenosa espinhal dural associada à espondilolistese isquêmica L-4. J Neurosurg Spine (2014) 20:670-4. doi: 10.3171/2014.3.SPINE13492
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Khaldi A, Hacein-Bey L, Origitano TC. Fístula arteriovenosa espinhal com hipertensão venosa perimedular de início tardio após cirurgia lombar: relato de caso e discussão da fisiopatologia. Coluna vertebral (2009) 34:E775-9. doi: 10.1097/BRS.0b013e3181ae4a52
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Jablawi F, Nikoubashman O, Mull M. A hipertensão arterial está associada a fístulas arteriovenosas espinhais sintomáticas. Neurocirurgia mundial. (2017) 103:360-3. doi: 10.1016/j.wneu.2017.04.050
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Borden JA, Wu JK, Shucart WA. Uma proposta de classificação para malformações arteriovenosas fistulosas da coluna vertebral e do crânio e implicações para o tratamento. J Neurocirurgia. (1995) 82:166-79. doi: 10.3171/jns.1995.82.2.0166
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Lawton MT, Jacobowitz R, Spetzler RF. Papel redefinido da angiogênese na patogênese das malformações arteriovenosas duras. J Neurocirurgia. (1997) 87:267-74. doi: 10.3171/jns.1997.87.2.0267
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Wojciechowski J, Kunert P, Nowak A, Dziedzic T, Czernicki T, Wojtowicz K, et al. Tratamento cirúrgico das fístulas arteriovenosas dural espinhal: Resultado, complicações e fatores prognósticos. Neurol Neurochir Pol. (2017). 51:446-53. doi: 10.1016/j.pjnns.2017.07.001
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Lucarelli E, Sangiorgi L, Benassi S, Donati D, Gobbi GA, Picci P, et al. Angiogênese em lipoma: Um estudo experimental na membrana corioalantóica do embrião de pintinho. Int J Mol Med. (1999) 4:593-6. doi: 10.3892/ijmm.4.6.593
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Jellema K, Tijssen CC, Fijnheer R, de Groot PG, Koudstaal PJ, van Gijn J. Spinal dural arteriovenous fistulas não estão associadas a factores protrombóticos. Stroke (2004) 35:2069-71. doi: 10.1161/01.STR.0000135766.22285.dc
CrossRef Full Text | Google Scholar
22. Cools MJ, Al-Holou WN, Stetler WR Jr, Wilson TJ, Muraszko KM, Ibrahim M, et al. Filum terminale lipomas: prevalência da imagem, história natural e posição conus. J Neurocirurgia Pediatra. (2014) 13:559-67. doi: 10.3171/2014.2.PEDS13528
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Al-Holou WN, Muraszko KM, Garton HJ, Buchman SR, Maher CO. O resultado da liberação do cordão amarrado na síndrome do cordão secundário e múltipla repetição do cordão amarrado. J Neurosurg Pediatr. (2009) 4:28-36. doi: 10.3171/2009.2.PEDS08339
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Gioppo A, Farago G, Giannitto C, Caputi L, Saladino A, Acerbi F, et al. Sacral dural arteriovenous fistulas: um desafio diagnóstico e terapêutico – experiência monocêntrica de 13 casos e revisão da literatura. J Neurointerv Surg. (2017). 10:415-21. doi: 10.1136/neurintsurg-2017-013307
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Oldfield EH, Bennett A 3rd Chen MY, Doppman JL. Gerenciamento bem sucedido de fístulas arteriovenosas espinhais dural não detectadas pela arteriografia. Relato de três casos. J Neurocirurgia. (2002) 96(2 Suppl):220-9. doi: 10.3171/spi.2002.96.2.0220
PubMed Abstract | CrossRef Full Text | Google Scholar