Na reunião da American Academy of Ophthalmology de 2013 participei de um debate sobre os prós e os contras do uso de medicamentos genéricos vs. medicamentos de marca. Foi-me pedido que argumentasse a favor dos medicamentos de marca, mas como na maioria dos debates, é uma simplificação excessiva tomar cegamente um ou outro lado. A realidade é mais complicada. Os genéricos têm custos a seu favor, mas às vezes não fornecem as mesmas especificações de tratamento ou resultados que os medicamentos de marca, apesar dos esforços da Food and Drug Administration para garantir que eles o farão.
Aqui, gostaria de falar sobre algumas das formas em que os genéricos podem diferir dos medicamentos de marca que substituem, e quais os clínicos que precisam de estar atentos.
A Questão da Bioequivalência
Os obstáculos necessários para colocar um novo medicamento “inovador” no mercado são substancialmente diferentes dos de um medicamento genérico de acompanhamento. Claro, isso é parte da razão pela qual um medicamento de marca custa mais. Quando o medicamento inovador inicial tem que provar segurança e eficácia através de ensaios clínicos, um genérico só é necessário para mostrar bioequivalência.
Embora a bioequivalência pareça envolver a realização de estudos biológicos, a FDA define-o como significando que você deve demonstrar que os ingredientes da sua versão genérica são uma cópia exacta dos ingredientes do medicamento original, incluindo tanto os ingredientes activos como os excipientes. (Se os ingredientes activos e excipientes não forem idênticos, o medicamento não é considerado genérico; tem de passar por uma aprovação regular da FDA, tal como qualquer medicamento novo). A premissa é que isto fará com que o genérico tenha a mesma segurança e eficácia que o medicamento de marca.
Felizmente, a ideia de que os genéricos são iguais aos medicamentos de marca porque os ingredientes são os mesmos não é necessariamente verdadeira. Muitos fatores que afetam a eficácia de um medicamento tópico são independentes dos ingredientes que estão dentro do frasco. Por exemplo:
– O material do frasco é importante. Os ingredientes de muitos medicamentos de marca são combinados com o material do frasco que está sendo usado. Este foi certamente o caso do Latanoprost, onde a compatibilidade com o material do frasco foi uma grande parte do processo de pesquisa e desenvolvimento ao trazer Xalatan para o mercado. Isto não é algo que seja investigado diretamente pela FDA.
– A forma e tamanho da garrafa afeta o uso. Os ensaios com medicamentos inovadores não só testam o medicamento mas também o frasco no qual será entregue aos pacientes, por isso o impacto da forma e tamanho do frasco foi levado em consideração. No entanto, os fabricantes de medicamentos genéricos não são obrigados a copiar a forma e o tamanho do frasco, e isso pode fazer diferença na facilidade com que os pacientes podem usar o medicamento.
>
>
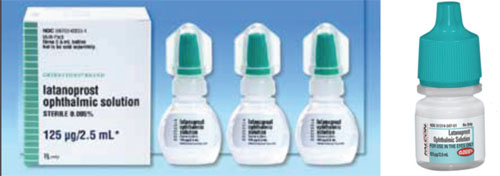
Uma questão que pode causar confusão ao mudar de um medicamento de marca para um genérico, ou de um genérico para outro, é a diferença na forma e cor da tampa.
Por exemplo, Xalatan vem em uma garrafa pequena e plana que leva um certo esforço e fineza para apertar a fim de incutir uma gota. Em contraste, algumas das garrafas genéricas de Latanoprost são redondas e mais rígidas, tornando a garrafa mais difícil de apertar para o paciente. (Veja exemplos, página de frente.) Muitos dos nossos pacientes são idosos e têm limitações físicas. Se eles estão acostumados a apertar um frasco específico que é plano e ligeiramente menos rígido, e então eles mudam para um frasco que é redondo e mais rígido, o processo de aplicação – e sua aderência ao medicamento – pode ser diferente do que quando eles estavam usando o frasco anterior. Além disso, como a forma e o tamanho do frasco são escolhidos por cada fabricante de genéricos, às vezes os pacientes podem receber o medicamento em um frasco plano e outras vezes o recebem em um frasco redondo. Isso tem criado muita confusão com os nossos pacientes.
– A cor da tampa nem sempre coincide. As cores das tampas dos frascos de medicamentos oftálmicos destinam-se a ser coordenadas com base na categoria do medicamento. A FDA tenta garantir que a cor esteja correta, mas já houve casos em que uma tampa de cor diferente escapou. Como resultado, às vezes a cor da tampa do frasco do medicamento genérico (assim como a forma e o tamanho) é diferente da do medicamento de marca (Veja exemplo, acima). Isto cria muita confusão quando os pacientes estão tentando lembrar qual das várias gotas eles devem tomar em que momento.
Aven se um paciente nunca usou a droga de marca com a cor correta da tampa, uma cor alterada ainda é um problema; a nova cor da tampa pode na verdade ser a mesma cor que outro medicamento que o paciente está tomando. Por exemplo, as garrafas analógicas de prostaglandina devem ter tampas de cor de teal. Se a sua paciente está usando uma versão genérica cuja garrafa tem uma tampa branca, ela pode confundi-la com outras classes de medicamentos que supostamente têm uma tampa branca.
Se você notar um exemplo de cor de tampa incorreta, a FDA disse que gostaria de ouvir falar sobre isso para que possam ser tomadas medidas para corrigir a discrepância.
– O tamanho da gota pode ser diferente. Os frascos de gotas tópicas no mercado neste momento fornecem uma dose de 30 a 50 µl por gota. Infelizmente, pode haver uma grande variabilidade entre formulações de marca e genéricas simplesmente porque a ponta pode ter um buraco maior ou menor. Obviamente, isso pode afetar o quanto do medicamento está realmente fazendo-o no olho; pode ser menos, pode ser mais.
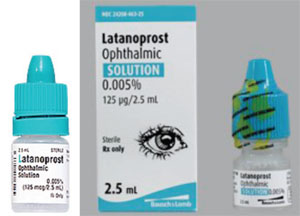
Outra questão é a diferença na forma e rigidez do frasco, o que pode tornar a aplicação de gotas mais difícil para um paciente mais velho. Por exemplo, o xalatan vem em frasco plano; muitos genéricos do medicamento vêm em frascos redondos que são mais difíceis de espremer.
Aven mais interessante, havia um timolol genérico que chegava ao mercado que não tinha nenhum buraco na ponta; o paciente era obrigado a furar a ponta para retirar o medicamento, semelhante a um tubo de super cola. Isso criou confusão com muitos pacientes; alguns não perceberam que deveriam fazer isso, e tentaram usar as gotas de qualquer maneira. Eles pensaram que estavam colocando uma gota, mas nunca tinham aberto o frasco, então nada estava saindo. Outros achavam que a garrafa estava defeituosa ou vazia. Além disso, um buraco feito por eles mesmos poderia acabar sendo de qualquer tamanho, afetando a dose, e o processo de fazer o buraco poderia facilmente comprometer a esterilidade do conteúdo.
Todas essas considerações – material da garrafa, forma e tamanho, cor da tampa e diâmetro da abertura da gota – são muito importantes tanto para o médico quanto para o paciente. Infelizmente, estas considerações podem ser ignoradas, porque o foco está em tentar provar a bioequivalência.
– O medicamento genérico de um paciente pode parecer diferente de mês para mês. Este é outro efeito colateral infeliz dos medicamentos genéricos. Acontece porque pode haver múltiplos fabricantes de um determinado genérico, cada um com um frasco diferente. Por exemplo, existem seis a oito fabricantes diferentes de latanoprost genéricos no mercado dos EUA neste momento. A que uma determinada farmácia vende pode mudar, porque uma cadeia como a CVS, Walgreens ou Walmart normalmente vai com qualquer fabricante que esteja dando ao grupo de farmácias o melhor negócio em um determinado momento. Como resultado, uma farmácia pode mudar o genérico que oferece quando uma oferta mais baixa vier de outro fabricante de genéricos. Assim, mesmo que o paciente vá à mesma farmácia, ele pode acabar com diferentes versões genéricas de um medicamento em momentos diferentes. Isso pode ser confuso se os frascos tiverem um aspecto e/ou comportamento diferente. (Pode até haver uma diferença na tolerância e controle de PIO entre os dois.)
O folheto da embalagem
Ironicamente, mesmo que um medicamento genérico venha a ter um problema, as regras atuais impedem que os fabricantes alertem médicos ou pacientes. Há uma regra que exige que os fabricantes de medicamentos genéricos incluam uma cópia exata da bula da embalagem que está incluída com o medicamento inovador. Embora esta regra tenha sido concebida para reflectir a ideia de que os medicamentos são bioequivalentes, o efeito secundário não intencional tem sido o de evitar colocar os mesmos requisitos de diligência e o mesmo ónus de garantir a segurança dos fabricantes de genéricos que exigimos dos fabricantes de marcas.
Como resultado, se o fabricante de genéricos introduzir um medicamento no mercado e notar alguns efeitos colaterais ou eventos adversos que ocorrem com o produto genérico, não é permitido alterar a bula para alertar os médicos e pacientes de que pode haver um problema. Além disso, esta regra pode, na verdade, reduzir a motivação dos fabricantes de genéricos para realizar um monitoramento adequado de seus produtos; afinal, não há ameaça de uma ação judicial se surgir um problema.
Felizmente, esta questão chegou ao conhecimento da FDA. Em novembro de 2013, a FDA propôs uma regra que permitiria aos fabricantes de medicamentos genéricos atualizar seus rótulos caso recebessem informações sobre possíveis preocupações com a segurança. Se for aprovada, isto irá contribuir muito para garantir a segurança de nossos pacientes.
Imported Generics
Um outro problema com os genéricos é que muitos deles são fabricados fora dos Estados Unidos, onde o controle de qualidade às vezes tem sido uma preocupação real. Os problemas têm variado de impurezas misteriosas que são encontradas nos medicamentos, a correspondência imperfeita de ingredientes, a formulações completamente fraudulentas que não servem a nenhum propósito benéfico (o que pode, em alguns casos, resultar em danos graves para os pacientes).
A realidade é que os genéricos não são necessariamente os mesmos que os medicamentos de marca – mesmo que tenham satisfeito a exigência de bioequivalência da FDA. Isso significa que, ao usar medicamentos genéricos, o fardo de garantir a segurança e eficácia recai sobre nós e sobre os nossos pacientes.
De acordo com o New York Times, a indústria farmacêutica da Índia fornece atualmente 40% dos medicamentos de venda livre e genéricos consumidos nos Estados Unidos. Muitas de suas fábricas são de classe mundial e “praticamente indistinguíveis” das fábricas dos EUA (segundo o Times), produzindo medicamentos de alta qualidade e confiáveis. Mas, ao mesmo tempo, a Organização Mundial de Saúde estimou que um em cada cinco medicamentos fabricados na Índia é falso. (Problemas semelhantes foram relatados com medicamentos fabricados em outros países, incluindo a China)
Nosso grupo fez um estudo há alguns anos comparando a latanoprosta fabricada na Índia com Xalatan. Descobrimos que a estabilidade dos princípios ativos não era a mesma ao longo do tempo ou quando submetidos ao calor. Além disso, encontramos contaminantes em todos os frascos importados, incluindo filamentos microscópicos que se assemelham a cordel, e o que chamamos de “OVNIs”
O ponto é que a supervisão das práticas de fabricação que acontecem no exterior em empresas não baseadas nos Estados Unidos, especialmente empresas que não têm medicamentos de marca no mercado, não é a mesma.
alguns médicos podem assumir que tais medicamentos importados são apenas um problema quando os pacientes compram medicamentos fora dos Estados Unidos através da Internet para poupar dinheiro, mas a realidade é que essas importações estão cada vez mais disponíveis aqui. Formulações indianas de timolol e travoprost estão atualmente disponíveis através de distribuidores sediados nos EUA, e outros medicamentos, como os AINEs, estarão disponíveis em breve. Obviamente, muitas empresas fora dos Estados Unidos estão produzindo genéricos de alta qualidade; a preocupação é que algumas delas não estão. Isso coloca o fardo sobre médicos e pacientes para garantir que um determinado genérico seja seguro e eficaz. (Pelo menos os medicamentos que estão disponíveis dentro dos Estados Unidos passaram pelo processo de bioequivalência do FDA; os medicamentos que alguns pacientes compram fora do país via Internet podem não ter, tornando-os ainda mais suspeitos)
Estratégias clínicas
Por causa de todas as variáveis que temos discutido, os médicos devem ficar em sintonia com o que está acontecendo com os pacientes quando mudam de uma marca para um genérico, ou mudam de um genérico para outro. Temos de estar atentos para ter a certeza que o controlo da pressão intra-ocular não está a vacilar e que os pacientes não estão a apresentar novos sinais e sintomas de intolerância ao medicamento.
Aqui estão algumas coisas que pode fazer para proteger os seus pacientes (e a sua prática):
– Peça aos pacientes para trazerem as suas gotas. Peço aos meus pacientes que façam isto independentemente dos medicamentos que estão a usar, e muitos deles fazem-no. Isso me dá a oportunidade de registrar qual fabricante de genéricos eles estão usando e fazer o meu melhor para manter o controle sobre isso, para que se um problema ocorrer ou algo mudar, eu possa procurar uma possível conexão.
– Faça com que os pacientes mudem para um novo genérico retornem à clínica mais cedo do que você faria se não retornassem. Isto permitir-lhe-á certificar-se de que não estão a ocorrer consequências negativas. Fique alerta para mudanças na eficácia ou novos sinais ou sintomas.
– Se você vir qualquer problema que surja quando um paciente mudar para um genérico, alerte a FDA. Lembre-se que esta situação coloca o fardo sobre o médico para garantir que o medicamento genérico é verdadeiramente seguro e eficaz.
– Se um paciente não se sair tão bem com um genérico, faça o esforço para que a seguradora cubra o medicamento de marca. Tenho sido confrontado com pacientes que eram tolerantes ao medicamento de marca, mas tiveram dificuldade em tolerar um genérico devido a efeitos colaterais como vermelhidão ou irritação. Nesses casos, nós escrevemos para a seguradora e fazemos tudo o que podemos para que o paciente volte à formulação de marca.
Por exemplo, um medicamento de marca pode ter um conservante específico, enquanto a formulação genérica tem um conservante alternativo ao qual o paciente é sensível. Travatan Z é um medicamento de marca feito pela Alcon que contém o conservante SofZia em vez do cloreto de benzalkonium; as versões genéricas contêm BAK porque a sua bioequivalência foi baseada na versão mais antiga do travoprost. Se uma farmácia muda um paciente que é alérgico ao BAK para o medicamento genérico, isso torna-se um problema.
Felizmente, ao ver milhares de pacientes por ano na nossa clínica, é realmente difícil garantir que ganhamos a batalha para cada paciente que acaba nesta situação. No entanto, nós fazemos o esforço.
O fardo está sobre nós
Genéricos estão aqui para ficar, e eles estão se tornando uma parte importante do tratamento para todas as doenças, não apenas em oftalmologia. Eles são tipicamente seguros e eficazes, e podem produzir economia de custos tanto para os pacientes como para o sistema de saúde em geral. Não se enganem, sou um grande fã da redução de custos. Se conseguirmos encontrar uma forma segura de cortar custos, mantendo os cuidados excelentes, eu sou a favor disso. É a segunda parte dessa equação que temos de vigiar.
Eu próprio uso medicamentos genéricos todos os dias, e a esmagadora maioria dos meus pacientes está agora a tomar genéricos. Eles estão quase todos indo muito bem, com bom controle de PIO e boa tolerância aos medicamentos. Então eu certamente não estou dizendo que devemos evitar o uso de genéricos. No entanto, a realidade é que os genéricos não são necessariamente os mesmos que os medicamentos de marca – mesmo que tenham satisfeito o requisito de bioequivalência da FDA. Isso significa que, ao usar medicamentos genéricos, o fardo de garantir segurança e eficácia recai sobre nós e nossos pacientes. REVISÃO
Dr. Kahook é The Slater Family Endowed Chair in Ophthalmology e vice-presidente de pesquisa clínica e translacional da Faculdade de Medicina da Universidade do Colorado, em Denver. Ele é consultor e recebe apoio de pesquisa da Allergan e Alcon.