O meu palpite aqui seria que você já tem a fórmula empírica do ácido tartárico, e que você deve encontrar a sua fórmula molecular usando a sua massa molar.
Assumindo que o ponto de partida aqui é a fórmula empírica do ácido tartárico tem este aspecto
#”C”_2 “H”_3 “O”_3 -># fórmula empírica
Agora, a fórmula empírica de um composto diz-lhe a menor relação de número inteiro que existe entre os átomos dos seus elementos constituintes.
Neste caso, você sabe que a fórmula molecular, que lhe diz o número exato de átomos que compõem uma molécula desse composto, conterá
#color(black)(“2 átomos de C” color(red)(” para cada “) {(“3 átomos de H”),(“3 átomos de O”) :}#
Em essência, você está procurando por um múltiplo da fórmula empírica.
É dito que o ácido tartárico tem uma massa molar de #”150 g mol”^(-1)#. Seu objetivo aqui será determinar a massa molar de sua fórmula empírica, então use este valor para determinar a fórmula molecular do composto.
Neste caso, você terá
#2 xx “12.011 g mol”^(-1) “”color(blue)(+)#
#3 xx “1.00794 g mol”^(-1)#
#3 xx “15.9994 g mol”^(-1)#
#color(white)(aaaaaaaaaaaaaaa)/color(white)(aaaaaaaaaaaaaaaaaaaaaaaaaa)#
#”75.044 g mol”^(-1) -> # a massa molar da fórmula empírica
Então, se a fórmula empírica tem uma massa molar de #”75.044 g mol”^(-1)#, e a massa molar do ácido tartárico for #”150 g mol”^(-1)#, segue-se que você precisará multiplicar a fórmula empírica por
#(150 color(red)(cancel(color(black)(“g mol”^(-1)))))/(75.044color(red)(cancel(color(black)(“g mol”^(-1))))) = 1.999 ~~ color(red)(2)#
> para obter a fórmula molecular. Isto significa que a fórmula molecular do ácido tartárico será
#(“C”_2 “H”_3 “O”_3)_color(vermelho)(2) implica color(green)(|bar(ul(color(white)(a/a) “C”_4 “H”_6 “O”_6color(white)(a/a)|))#
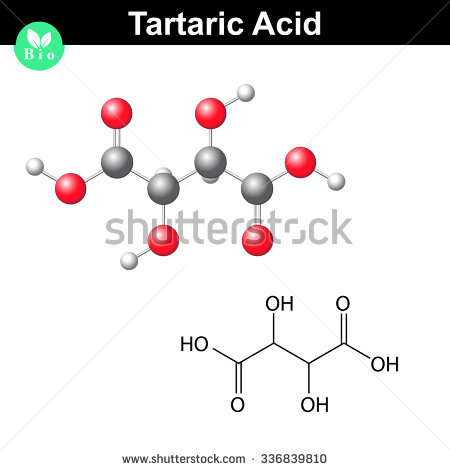
Aqui está como se parece uma molécula de ácido tartárico