- O que é a acidez?
- O que é o pH?
- Por que a acidez é importante?
- Sintomas de um pH demasiado baixo (o substrato é demasiado ácido)
- Sintomas de um pH demasiado elevado (o substrato é demasiado alcalino)
- O que determina o pH?
- Medir o valor do pH
- Amostras de colheita
- Os valores corretos de pH para cada meio de cultivo
- Corrigindo o valor do pH
O que é a acidez?
A acidez é essencial para a vida na terra. A acidez muitas vezes determina as características, qualidade, absorvibilidade e solubilidade de muitas substâncias. É assim que as enzimas, responsáveis por quase todos os processos biológicos nos organismos, funcionam, mas apenas com a acidez correcta. Uma pequena flutuação na acidez do sangue é mortal.
O que é o pH?
O pH (Hydrogenii pondus) indica a acidez ou alcalinidade de uma solução. O valor do pH geralmente varia entre 0 e 14. Uma solução com um valor de pH entre 0 e 7 é ácida e uma solução entre 7 e 14 é alcalina. Vinagre e cola têm um valor de pH inferior a 3. Soda e sabão têm um valor de pH superior a 8. Um valor de pH de 7 é considerado neutro. Água pura à temperatura ambiente tem um pH de 7. O pH da água da torneira é geralmente um pouco mais elevado devido à presença de cálcio.
Muitos ambientes naturais como a nossa pele, substratos vegetais e meios nutritivos são ligeiramente ácidos e têm um valor pH entre 5 e 6,5. Se olharmos para aquilo que as pessoas gostam, vemos que geralmente são substâncias levemente ácidas ou neutras, como a água. As plantas também preferem substâncias levemente ácidas. Um valor de pH de cerca de 5,5 ocorre tão frequentemente na natureza que alguns especialistas em plantas consideram este valor como “neutro”.
Por que a acidez é importante?
A acidez tem uma influência substancial na capacidade de absorção e solubilidade de um número de elementos alimentares (ver figura 1).
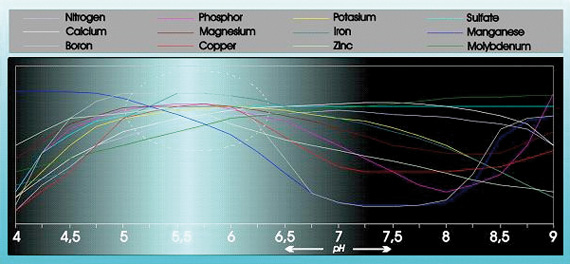
Fig. 1
A acidez tem uma influência considerável na estrutura, na decomposição das substâncias orgânicas e na micro-vida no solo. O pH também influencia a forma como os elementos alimentares, metais pesados, pesticidas e outros microrganismos no meio de cultivo são expelidos do solo.
Um valor de pH demasiado baixo ou demasiado alto pode ser prejudicial para as suas plantas, por isso é importante que seja correcto. Mas como você sabe quando o pH está errado? Por experiência! Então, para ajudá-lo, expusemos alguns dos sintomas que você pode observar:
Sintomas de um pH demasiado baixo (o substrato é demasiado ácido)
- A maioria dos nutrientes pode ser dissolvida facilmente, o que pode causar um excesso de manganês, alumínio e ferro;
- As deficiências de fósforo, potássio, magnésio e molibdénio podem ser causadas por enxaguamento excessivo;
- A deficiência de magnésio, especialmente em substratos frios;
- O solo é geralmente pobre;
- A vida do solo é inibida.
Sintomas de um pH demasiado elevado (o substrato é demasiado alcalino)
- A maioria dos nutrientes dissolve-se com menos facilidade, causando a precipitação de cálcio, ferro e compostos de fosfato;
- Resorção reduzida de manganês, fosfato e ferro em particular, mas também de cobre, zinco e boro. Isto irá causar deficiências, particularmente em meios de cultivo húmidos e frios.
- Em solos arenosos a decomposição de substâncias orgânicas aumenta consideravelmente se o pH for elevado.
O que determina o pH?
Um dos factores mais importantes que determinam o valor do pH numa solução ou no substrato é a capacidade de tamponamento. A capacidade tampão neste caso significa que há uma espécie de equilíbrio presente que se restaura continuamente. Por exemplo, se se colocar uma gota de ácido em 1 litro de água da torneira que tenha um pH de 7, terá pouca influência na acidez. No entanto, se se colocar uma gota de ácido em 1 litro de água desmineralizada (água da bateria), o pH cairá imediatamente de forma dramática. Isto porque a água da torneira contém bicarbonato enquanto a água desmineralizada não o contém. O bicarbonato é a substância tampão mais importante para valores de pH entre 5,5 e 7,5 na água.
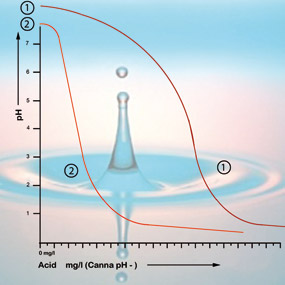 Bicarbonato liga-se ao ácido na solução que liberta dióxido de carbono para a atmosfera. É assim que o ácido é neutralizado e as alterações na acidez só serão menores enquanto ainda houver bicarbonato presente.
Bicarbonato liga-se ao ácido na solução que liberta dióxido de carbono para a atmosfera. É assim que o ácido é neutralizado e as alterações na acidez só serão menores enquanto ainda houver bicarbonato presente.
Com um valor de pH de 5,3 todo o bicarbonato foi utilizado e a solução não tem mais tampões. O pH está agora instável e mudará imediatamente se for adicionado ácido (ver figura 2). A quantidade de ácido necessária para obter uma solução alimentar com a acidez correta pode, portanto, ser calculada com base no teor de bicarbonato. O teor de bicarbonato da água da torneira é geralmente dado pela companhia da água em miligramas por litro.
A capacidade de tamponamento e a acidez do substrato dependem da sua composição e frescura. A presença de matéria orgânica, cálcio e bicarbonato determinam geralmente o pH. A argila contém sempre carbonato de cálcio e tem um valor de pH relativamente alto que é difícil de alterar, enquanto a turfa e os solos arenosos são ácidos.
A própria planta também tem grande influência sobre a acidez. As raízes irão secretar sub-posições ácidas ou alcalinas dependendo do estágio de desenvolvimento da cultura, do alimento disponível, das diferenças na temperatura da raiz e da intensidade da luz. Assim você vê porque o pH do ambiente radicular pode flutuar constantemente. Um equilíbrio alimentar sofisticado durante as diferentes fases de desenvolvimento irá manter o pH no ambiente radicular dentro de limites aceitáveis.
Microvida, níveis de CO2, e crescimento de algas também pode ter um efeito na acidez do ambiente radicular e do tanque de nutrientes.
Medir o valor do pH

É bastante fácil medir o pH – você precisa de alguns indicadores de pH tais como papel de tornassol ou um conjunto de testes de pH. Estes são relativamente baratos mas nem sempre são precisos e por vezes podem desviar-se em 1 a 2 unidades de pH. Todos os medidores de pH são geralmente mais caros e a precisão depende do tipo de medidor e da calibração regular com o fluido de calibração.
Amostras de colheita

O pH da água utilizada para irrigar as plantas é importante, mas a acidez em torno das raízes é essencial. Portanto, quando se mede o pH é muito importante colher a amostra da maneira correta para obter bons resultados. A amostra tem acidez de idade no ambiente radicular.
É fácil colher amostras e medir o pH num sistema de recirculação, basta medir a solução de alimentação recirculada.
Em sistemas de substrato sem recirculação, a solução de alimentação é retirada do substrato (lã de rocha, agroespuma, etc.) em vários locais. Os especialistas têm discutido a questão de onde retirar as amostras durante um ano e um dia. Recomendamos, tal como fazem vários laboratórios de renome, colher amostras dos locais onde se encontram as raízes que se encontram debaixo e à volta do gotejador. Tirar pequenas amostras do maior número possível de lugares. Tire sempre todas as amostras ao mesmo tempo e, de preferência, após a segunda alimentação por gotejamento durante o ciclo luz – dia.
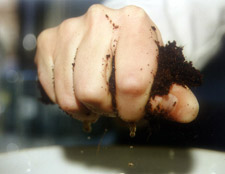 No solo, coco e substratos de turfa basta tirar uma pequena quantidade de substrato de vários locais.
No solo, coco e substratos de turfa basta tirar uma pequena quantidade de substrato de vários locais.
Você pode medir melhor a acidez da sua amostra usando o método “1:1.5 volume extraído”. Você mesmo pode fazer isso facilmente tornando o meio de cultivo tão molhado que a água passa pelos seus dedos quando é amassado e espremido com bastante força (foto 1). Use um copo medidor de 250 ml, por exemplo. Encha o copo medidor até 150 ml com água desmineralizada. Adicione o meio de cultura até o volume ser de 250 ml (foto 2). Agitar bem e deixar repousar durante algumas horas. Depois filtre-o e meça o pH.

Os valores corretos de pH para cada meio de cultivo
Quando se cultiva em substrato os valores de pH entre 5,0 e 6,4 são bons para o ambiente radicular. Não haverá nenhum efeito adverso se os valores forem um pouco mais altos ou mais baixos. Efeitos adversos imediatos só serão observados com valores inferiores a 4 e superiores a 8, um valor de pH inferior a 4 frequentemente causa danos imediatos nas raízes. Além disso, metais pesados, incluindo manganês e ferro são absorvidos tão bem que podem envenenar a planta (necrose). Valores entre 7 e 8 não são imediatamente prejudiciais para a planta. Nutrientes como ferro, fosfato e manganês estão menos disponíveis do que os que levarão a deficiências (clorose e problemas de desenvolvimento) a longo prazo.
Corrigindo o valor do pH
 Se a acidez no ambiente radicular estiver entre 5 e 6,4 então o pH do seu ambiente de cultivo é OK e não é necessário tomar nenhuma medida corretiva. Tente evitar corrigir o pH, a menos que seja realmente necessário. É mais provável que faça mal do que bem; a planta gosta da sua paz e tranquilidade. É mais importante monitorar como a acidez muda durante um período mais longo. Se o valor cair abaixo do pH 5 ou subir acima do pH 6,4 então é aconselhável começar a fazer ajustes gradualmente.
Se a acidez no ambiente radicular estiver entre 5 e 6,4 então o pH do seu ambiente de cultivo é OK e não é necessário tomar nenhuma medida corretiva. Tente evitar corrigir o pH, a menos que seja realmente necessário. É mais provável que faça mal do que bem; a planta gosta da sua paz e tranquilidade. É mais importante monitorar como a acidez muda durante um período mais longo. Se o valor cair abaixo do pH 5 ou subir acima do pH 6,4 então é aconselhável começar a fazer ajustes gradualmente.
Corrigir a acidez é mais facilmente feito baixando a acidez da solução de alimentação com ácido nítrico durante a fase de crescimento e ácido fosfórico durante a fase de floração ou, conforme o caso, elevá-la com potássio cáustico, bicarbonato de potássio de soda e CANNA RHIZOTONIC. Assegurar que o pH da solução utilizada não desça muito abaixo de 5,0. Ao crescer em lã de rocha as fibras serão danificadas causando a liberação de muito material alcalino a valores de pH muito baixos. Além disso, o pH é mais difícil de controlar devido à ausência de bicarbonato
Um pH alto no ambiente radicular também pode ser causado pelo bicarbonato que se acumulou. Para remediar isto, manter 20% de drenagem ou enxaguar com uma solução mais ácida.
É útil notar as medições de pH tanto da solução adicionada como da solução de alimentação no substrato. Você terá uma boa idéia da progressão do pH e do efeito das medidas tomadas.
- As enzimas de divisão de proteínas precisam de um ambiente ácido (sucos gástricos) e as enzimas de divisão de carboidratos precisam de um ambiente alcalino (saliva).
- A acidez de uma solução é determinada pela proporção de íons hidrogênio (= ácido) e íons hidróxidos (= alcalino).
- Shortages podem ocorrer porque a planta tem que secretar prótons para ser capaz de absorver estas moléculas. Um meio de crescimento com pH baixo já tem uma quantidade muito grande de prótons. Estes elementos também são enxaguados porque os prótons repelem as moléculas do meio no substrato.
- Bicarbonato é a substância que, quando combinada com o cálcio, é responsável pela escala. Em combinação com o sódio, o bicarbonato é utilizado em medicamentos para combater o excesso de ácido gástrico (Alka-seltzer).
- Alguns laboratórios também trabalham com a dureza do bicarbonato. Para traduzir isto para mg/l de bicarbonato você deve multiplicar a dureza do bicarbonato por 21.8.
Por exemplo: a dureza do bicarbonato é 11, então 1 litro de água contém (11 x 21.8=) 240 mg/litro de bicarbonato. -
Terra arenosa: Terra de terra pH 4.6 … 5.2 Terra de construção pH 5.0 … 5.6 >
Coloja: Coloja de maré pH 6.0 … 7.2 Colo de fígado pH 6.2 … 6.4 Peat: Não processado pH 4.0 - Se houver um crescimento significativo de algas, então o pH aumentará porque o dióxido de carbono será removido da solução. As bactérias podem transformar certas formas de nitrogênio para que tenham um efeito acidificante. Grandes quantidades de CO2 no ar geram mais dióxido de carbono na solução de alimentação e vice versa.
- Utilize apenas soda em pequenas quantidades, porque contém sódio, e as plantas só precisam de uma quantidade muito pequena de sódio. Lembre-se, altas concentrações de sódio irão danificar a planta.
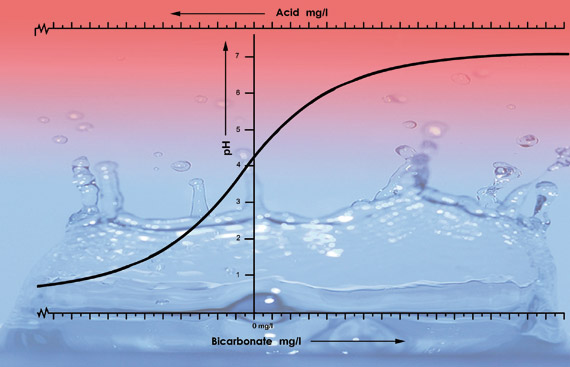
Ilhustração dos valores de pH da água da torneira de várias áreas com diferentes níveis de bicarbonato. Adicionamos 33 ml de ácido nítrico (38%) a cada 100 litros de amostra de cada tipo de água. A curva do pH cai mais rapidamente após o pH 5,3 porque para este tipo de água o ácido neutraliza todo o bicarbonato. Abaixo do pH 5,3 o nível de acidez irá acelerar rapidamente.
Em sistemas recirculantes, o valor do pH pode flutuar mais do que em sistemas de passagem para o lixo. O mesmo vale para o valor de EC, ppm. Se você quiser saber mais sobre CE, pH e ppm, aconselhamos a leitura do nosso artigo Tudo sobre CE, pH e ppm usando AQUA.