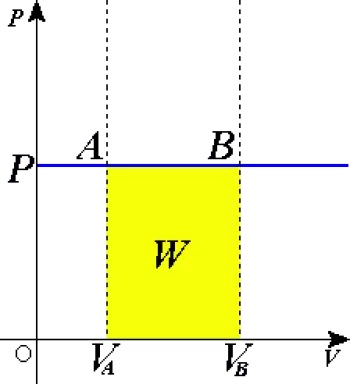
Um processo isobárico é um processo termodinâmico de mudança no estado de uma certa quantidade de matéria na qual a pressão permanece constante. O que ela pode mudar é uma ou mais variáveis de estado. Se o calor é transferido para o sistema, o trabalho é feito e a energia interna do sistema também muda.
Em um diagrama pressão-volume, ele aciona uma linha horizontal de acordo com a lei ideal do gás.
O processo isobárico é regido pela lei de Charles. De acordo com a lei de Charles, para uma massa fixa de gás ideal a pressão constante, o volume é diretamente proporcional à Kelvintemperatura.
Os processos isobáricos são regulados pela primeira lei da termodinâmica. Nestes processos, o aumento da energia é igual ao aumento da entalpia menos a pressão multiplicada pelo aumento do volume:ΔE = ΔH – P – ΔV.
Não confundir com processos isotérmicos, que são realizados a pressão constante ou com processos adiabáticos, que não trocam calor. Nestes processos, pode ocorrer uma mudança de pressão. Quando o processo é feito em volume constante é chamado processo isocórico.
Exemplos de processos isotérmicos
Para entender melhor este processo termodinâmico, ele nos ajudará a ver alguns exemplos.
-
Fase de expansão do cilindro de um motor.
-
Água de petróleo em um recipiente aberto.
>
-
Aquecimento de um globo devido aos efeitos da radiação solar.
>
- >
Balões de ar quente experimentam processo isobárico e isocrónico.
>
Aquecimento do Ar de um Balão
A mudança de volume que um balão experimenta à medida que os raios solares o atingem é um exemplo de um processo isobárico. Enquanto o sol aumenta a temperatura, o volume do gás (ar) experimenta uma expansão isobárica.
No início da manhã apresenta uma certa pressão, volume e temperatura, à medida que o ar dentro aquece, a pressão aumenta, mas isto não varia devido ao aumento do seu volume.
Fase de expansão do cilindro de um motor térmico
O cilindro de um motor térmico pode ser expandido ou contraído dependendo da fase do ciclo. A expansão do ar em um cilindro com um pistão móvel ao qual é fornecido calor é realizada por um processo isobárico. Da mesma forma, durante a compressão, o volume é reduzido isobaricamente.
O volume aumentará proporcionalmente à sua temperatura e a pressão permanecerá constante. Isto está de acordo com a Lei Charles.
Água a ferver num recipiente aberto
Um exemplo diário de um processo isobárico é a água a ferver num recipiente aberto. Ao fornecer energia térmica à água, ela sobe de temperatura e se transforma em vapor.
O vapor obtido tem uma temperatura mais alta e ocupa um volume maior, entretanto, a pressão permanece constante. Desde o início a pressão é igual à pressão atmosférica.
Aquecimento de um balão de ar quente
Um balão de ar quente é um exemplo do processo isobárico.
Balões de ar quente funcionam porque o ar quente sobe. Ao aquecer o ar dentro do balão com o queimador, este torna-se mais leve do que o ar mais frio no exterior. Isto faz com que o balão flutue para cima, como se estivesse na água.
A pressão dentro do balão é a mesma que a atmosférica. Quando o piloto injeta calor no ar, a temperatura sobe. Ele faz diminuir a densidade do ar e devido à diferença entre sua densidade e a do ar, o balão sobe.
Termodinamicamente, parte do calor é convertida em trabalho fazendo o balão de ar quente subir. Parte deste calor é libertado fora do sistema devido ao contacto termodinâmico do ar externo e devido à perda de ar quente quando este é expandido.
W 1-2 = P ( V 2 – V 1 ) W 1-2 = n R ( T 2 – T 1 ) Q 1-2 = m c p ( T 2 – T 1 ) Q 1-2 = ( k / ( k -1)) P ( V 2 – V 1 )
Onde,
-
W 1-2 quantidade de trabalho realizado por mudança de estado
- >
Q 1-2 a quantidade de calor fornecida ou removida
-
P pressão
>
-
V o volume
>
-
T a temperatura absoluta
>
-
n a quantidade de pó (geralmente expresso em moles)
-
m a massa da substância
-
cp o calor específico da substância a pressão constante
>
-
k é uma razão igual ao quociente entre o calor específico a pressão constante e o volume constante, respectivamente
Da primeira equação podemos ver que se o sistema se expande (ΔV é positivo), então o sistema faz um trabalho positivo. Pelo contrário, se o aumento de volume for negativo, o sistema contrai e o trabalho é negativo.
Equação de Estado de um Gás Ideal
A equação de estado de um gás ideal (às vezes a equação de Mendeleev – Clapeyron ou a equação de Clapeyron) é uma fórmula que estabelece a relação entre pressão, volume molar e a temperatura absoluta de um gás ideal. A equação é:
pV = nRT
Where,
p – pressão,
V- volume do gás,
n- a quantidade de gás,
R – constante universal do gás,R ≈ 8.314 J / (mol⋅K),
T – temperatura termodinâmica, K kelvin.