- Introduction – Distribution – Description – Cycle de vie – Liste annotée des espèces – Importance médicale et vétérinaire – Dommages aux cultures – Références choisies
- Distribution (Retour au début)
- Description (Retourner au début)
- Cycle de vie (Retour au début)
- Liste annotée des espèces en Floride (Retour au début)
- Importance médicale et vétérinaire (Retour en haut)
- Dommages aux cultures (Retour en haut)
- Références choisies (Retour au début)
Introduction – Distribution – Description – Cycle de vie – Liste annotée des espèces – Importance médicale et vétérinaire – Dommages aux cultures – Références choisies
La famille des Meloidae, les coléoptères vésiculeux, contient environ 2500 espèces, réparties entre 120 genres et quatre sous-familles (Bologna et Pinto 2001). La Floride compte 26 espèces, ce qui ne représente qu’une petite fraction du nombre total aux États-Unis, mais près de trois fois celui des Antilles (Selander et Bouseman 1960). Les coléoptères adultes sont phytophages et se nourrissent surtout de plantes des familles Amaranthaceae, Asteraceae, Leguminosae et Solanaceae. La plupart des adultes ne mangent que des parties florales, mais certains, notamment ceux des Epicauta spp, mangent aussi des feuilles.
Figure 1. Epicauta floridensis Werner adulte (à gauche), et E. cinerea Forster (à droite). Photographie de Lyle J. Buss, Université de Floride.
Figure 2. Pyrota lineata (Olivier) adulte, un coléoptère vésiculeux. Photographie de Lyle J. Buss, Université de Floride.
Quelques adultes sont nocturnes, mais la plupart sont diurnes ou ne présentent pas de cycle diurne distinct. Comme les adultes sont grégaires et souvent très colorés, ils ont tendance à être voyants. Cependant, à l’exception des larves de premier stade (triungulines) fréquentant les fleurs ou s’accrochant aux abeilles adultes, les larves de vrillette sont rarement observées. Pour autant que l’on sache, toutes les larves sont des prédateurs spécialisés. Les larves de la plupart des genres pénètrent dans les nids des abeilles sauvages, où elles consomment à la fois les abeilles immatures et les provisions d’une ou plusieurs cellules. Les larves de certains Meloinae, y compris la plupart des Epicauta spp. s’attaquent aux œufs de sauterelles acariâtres. Quelques larves s’attaquent manifestement aux œufs de scarabées vésiculeux (Selander 1981). Parmi les espèces de Floride, Nemognatha punctulata LeConte (mal identifié comme Zonitis vittigera (LeConte)) a été trouvé dans un nid d’une Megachile sp. à Cuba (Scaramuzza 1938) et plusieurs membres du genre Epicauta ont été associés aux ovoïdes de Melanoplus spp.
Distribution (Retour au début)
Quatorze des espèces de Floride sont limitées en grande partie ou entièrement aux côtes de l’Atlantique et/ou du Golfe des États-Unis. Douze espèces sont plus ou moins largement distribuées dans les États du centre et/ou de l’est. Deux espèces sont présentes à la fois dans le sud-est des États-Unis et dans les Antilles. Ces deux espèces appartiennent à des groupes d’Amérique du Sud et d’Amérique centrale et ont probablement atteint les États-Unis continentaux à partir des îles. Un troisième lien faunistique plus faible avec les Antilles est représenté par Pseudozonitis longicornis (Horn), qui appartient à un groupe comprenant une espèce antillaise et deux espèces relictuelles dans l’est du Texas (Enns 1956, Selander et Bouseman 1960). Aucune espèce n’est indigène.
Description (Retourner au début)
Les adultes sont des coléoptères à corps mou, à longues pattes, avec la tête défléchie, entièrement exposée et brusquement rétrécie derrière pour former un cou exceptionnellement étroit, le pronotum est beaucoup plus étroit à l’extrémité antérieure qu’à l’extrémité postérieure et n’est pas caréné latéralement, les cavités du cox antérieur sont ouvertes derrière et (chez toutes les espèces de Floride) chacune des griffes du tarse est fendue en deux lames. La longueur du corps varie généralement entre 3/4 et 2 cm chez les espèces de Floride. Les coléoptères vésiculés (Meloidae) sont communément confondus avec les coléoptères de la famille Oedemeridae (faux coléoptères vésiculés) (Arnett 2008) et la sous-famille des Tenebrionidae Lagriinae (coléoptères à longues articulations).
Les larves de premier stade de la famille Nemognathinae trouvées dans les fleurs ou attachées aux poils des abeilles sont parfois confondues avec celles des Ripiphoridae. Dans les deux groupes, le corps est naviculaire (en forme de bateau) et fortement sclérotisé et il y a un motif défini de setation. Les larves de Nemognathine se distinguent par la présence d’un à deux (et non de quatre à cinq) stemmata de chaque côté de la tête, d’une ligne ecdysiale sur le thorax et de l’absence de pulvilli (appendices vésicaux).
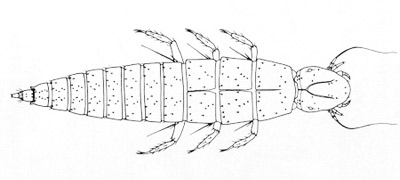
Figure 3. Nemognatha plazata Fabricius, larve de premier stade.
Les clés des genres pour les coléoptères adultes (Arnett 1960) et les larves triungulines (MacSwain 1956) sont données dans les références. Une clé des espèces d’Epicauta se trouve dans Pinto (1991). Les adultes de la plupart des espèces de Floride sont décrits par Enns et Werner (Enns 1956, Werner 1945).
Cycle de vie (Retour au début)
Les œufs sont pondus en masse dans le sol ou sous les pierres (Meloinae) ou sur les plantes alimentaires des adultes (Nemognathinae). Le développement larvaire est hypermétamorphique, avec quatre phases distinctes.
Au premier stade ou phase de triunguline (T), la larve atteint son site d’alimentation par ses propres moyens (la plupart des Meloinae) ou s’attache à une abeille adulte et y est transportée (Meloini (pas en Floride) et Nemognathinae). Après s’être nourrie jusqu’à épuisement, la larve, grâce à l’ecdysis, devient scarabéiforme et entre dans une période de croissance rapide (première phase de larve, FG) qui dure jusqu’à la fin du cinquième ou sixième stade. Chez certaines espèces qui s’attaquent aux abeilles, la larve FG n’utilise qu’une seule cellule, tandis que chez d’autres, elle creuse dans les cellules voisines et dévore leur contenu. Chez Meloinae, la larve FG entièrement nourrie creuse généralement une chambre à part du site d’alimentation. Au sixième ou septième stade, la larve devient généralement fortement sclérotisée et immobile (phase coarctée, C). Dans cette phase, la musculature subit une profonde dégénérescence et la respiration est réduite à un niveau extrêmement bas, permettant la survie pendant plus d’un an, si nécessaire. Lorsque le développement reprend, les muscles se régénèrent et, grâce à l’ecdysis, la larve redevient scarabéiforme (deuxième phase de larve, SG) ; à ce stade, elle peut ou non creuser une chambre nymphale. Les Nemognathinae sont inhabituels en ce que la larve SG et la nymphe et l’adulte qui suivent sont encapsulés par les peaux moulées mais intactes de la larve FG du dernier stade et de la larve C.
Plusieurs voies de développement alternatives ont été identifiées. En réponse à une température élevée, de nombreuses larves d’Epicauta se nymphosent directement à partir de la phase FG ou échouent à la diapause dans la phase C ; les deux schémas sont propices au multivoltinisme. Rarement, une larve se nymphose directement à partir de la phase C. Probablement en réponse à des conditions environnementales défavorables, les larves de plusieurs genres de Meloinae peuvent retourner à la phase C après avoir atteint la phase SG. La plupart des espèces passent l’hiver ou la saison sèche sous forme de larves en phase coarctée, tandis que quelques-unes le font sous forme d’œufs diapausés, de larves triungulines ou d’adultes.
Les adultes vivent couramment trois mois ou plus. Les femelles s’accouplent généralement et pondent périodiquement tout au long de leur vie adulte.
Liste annotée des espèces en Floride (Retour au début)
Dans la liste suivante, la distribution saisonnière n’est pas mentionnée pour les espèces qui sont actives au stade adulte du printemps à la fin de l’été ou au début de l’automne. En général, les résumés des plantes alimentaires ne concernent pas exclusivement la Floride. La plupart des distributions et certaines données sur les hôtes proviennent de Piinto (1991).
Epicauta batesii Horn – Est et sud-est des États-Unis, du New Jersey au sud de la Floride et à l’ouest du Mississippi. Hôtes adultes : inconnus.
E. cincerea (Forster) – le scarabée vésiculeux de la clématite. Est de l’Amérique du Nord, de la côte atlantique vers l’ouest jusqu’aux grandes plaines, sud du Canada jusqu’au Texas et à la côte du Golfe. Trois formes de couleurs principales : gris teinté de noirâtre, marginé (noir avec des marges gris cendré), et noir. Hôtes adultes : Clematis spp.
Figure 5. Adulte de la cloque de la clématite, Epicauta cinerea Forster, forme de couleur marginale. Photographie de Lyle J. Buss, Université de Floride.
E. excavatifrons Maydell – Mississippi et Alabama côtiers, et au sud de la Floride jusqu’à Marion County. Septembre-octobre. Hôtes adultes : enregistrés à partir de l’herbe.
E. fabricii (LeConte) – le scarabée vésiculeux cendré. Est de l’Amérique du Nord, de l’est du Canada au golfe du Mexique, moins commun à l’ouest du Mississipii. Nord de la Floride, y compris le panhandle, au sud jusqu’au Highlands County. Avril-mai. Hôtes adultes : communément sur des Leguminosae, dont la luzerne, Baptisia, le haricot, le pois et le mélilot ; attaque parfois la pomme de terre et le coton sans glands. Souvent pris à la lumière.
Figure 6. Epicauta fabricii (LeConte) adulte, la vésicule cendrée. Photographie de John L. Capinera, Université de Floride.
Figure 7. Adulte de la vésicule de « Floride », Epicauta floridensis Werner. Photographie de Lyle J. Buss, Université de Floride.
E. funebris (=pestifera) Horn – la vésicule marginée. Est des États-Unis, à l’ouest du Texas et du Dakota du Sud et au nord du Massachusetts. Nord de la Floride, y compris le panhandle, au sud jusqu’à Indian River County Hôtes adultes : De nombreuses Leguminosae et Solanaceae, dont la luzerne, la betterave, l’aubergine, la pomme de terre, le soja, la betterave à sucre et la tomate. Également pris sur Amaranthus, et Cynachum nigrum (L.).
Figure 8. Adulte de la vésicule marginale, Epicauta funebris Horn. Photographie de James Castner, Université de Floride.
E. heterodera Horn – Sud-est des États-Unis, de la côte du Mississippi à la Géorgie et au sud de la Floride jusqu’au comté d’Osceola. Signalé sur la côte, sud-est de la Caroline du Nord. Septembre-novembre. Hôtes adultes : Helenium et autres Asteraceae.
Figure 9. Epicauta heterodera Horn femelle adulte, un coléoptère vésiculeux. Photographie de Lyle J. Buss, Université de Floride.
Figure 10. Epicauta heterodera Horn adulte mâle, un coléoptère vésiculeux. Photographie de Lyle J. Buss, Université de Floride.
E. obesa (Chevrolat) – Sud-est du Canada, sud à travers l’est des États-Unis, sud jusqu’à Veracruz et Oaxaca, Mexique. En Floride, signalé dans les comtés d’Alachua et d’Orange. Hôtes adultes : Signalé sur Clematis dans toutes les régions ; et Amaranthus, luzerne, Tribulas et tomate en Oklahoma et Arkansas.
E. pensylvanica (De Geer) – le coléoptère noir de la cloque. Sud du Canada, de l’Alberta à la côte atlantique au sud, dans une grande partie des États-Unis, mais pas les États de la côte pacifique, jusqu’au nord du Mexique. Hôtes adultes : Une grande variété de plantes, dont de nombreuses Asteraceae, et des cultures comme la luzerne, la betterave et la pomme de terre. Il est le plus souvent pris sur les inflorenscences de Solidago.
Figure 11. Epicauta pensylvanica (De Geer) adulte, le scarabée vésiculeux noir. Photographie de John L. Capinera, Université de Floride.
E. sanguinicollis (LeConte) – Connu uniquement en Caroline du Sud, en Géorgie et en Floride. En Floride, signalé dans les comtés d’Alachua, Citrus, Sumter et Brevard. Hôtes adultes : Asteraceae, Schrankia (Leguminosae), Asteraceae, et coton.
E. strigosa (Gyllenhal) – De l’est du Texas à l’Atlantique, puis au nord le long de la côte jusqu’au Massachusetts, probablement dans tout l’état de la Floride. Hôtes adultes : Principalement sur le coton, le gombo, les Asteraceae, Opuntia (Cactaceae), Ipomoea (Convolvulaceae), et Vigna (Leguminosae).
Figure 12. Epicauta stigosa (Gyllenhal) adulte, un coléoptère vésiculeux. Photographie de Jeff Hollenbeck.
E. tenuis (LeConte) – Caroline du Sud, Géorgie et Forida. Enregistré en Floride depuis les comtés de Baker et Volusia au sud jusqu’au comté de Highlands. Mai-Juin.
E. vittata (Fabricius) – le scarabée vésiculeux rayé. Connu dans le sud de l’Ontario et du Québec au Canada et dans tous les États américains à l’est de la longitude 100°, sauf le Texas, le Dakota du Nord, le Maine, le New Hampshire et le Vermont. Représenté en Floride, où il est communément présent dans tout l’état sauf dans les Keys, l’extrême sud de la Géorgie et le sud-est de la Caroline du Sud par la race « lemniscate » ou côtière du sud-est (Adams et Selander 1979). Hôtes adultes : Grande variété de plantes, y compris Amaranthaceae (Amaranthus), Solanaceae (Solanum) et Fabaceae (Medicago, luzerne), et des cultures comme le haricot, la betterave, le coton, la pomme de terre et la tomate. Attiré par les lumières.
Figure 13. Epicauta vittata (Fabricius) adulte, la vésicule rayée. Photographie de James Castner, Université de Floride.
Lytta polita Say – le coléoptère vésiculeux bronze. Frontière de la Géorgie au sud des comtés de Charlotte et des Highlands. Décembre-Juin. A été pris en grand nombre aux feux.
Figure 14. Adulte de la vésicule du bronze, Lytta polita Say. Photographie de James Castner, Université de Floride.
Pyrota limbalis LeConte – Washington, D.C., sud jusqu’à Highlands County, Floride. Un signalement à la lumière.
P. lineata (Olivier) – Nord de la Floride, y compris le panhandle, au sud jusqu’à Polk County. Août-octobre. Plusieurs Asteraceae et Gerardia (Scrophulariaceae).
Figure 15. Pyrota lineata (Olivier) adulte, un coléoptère vésiculeux. Photographie de Lyle J. Buss, Université de Floride.
P. mutata (Gemminger) – Nord de la Floride, y compris le panhandle, au sud jusqu’à Polk County. Cicuta, Daucus, Eryngium, et plusieurs autres Umbelliferae.
P. sinuata (Olivier) – Plaine côtière du Mississippi à la Caroline du Nord ; au sud en Floride jusqu’au comté de Highlands. Gerardia (Scrophulariaceae).
Nemognatha nemorensis Hentz – Nord de la Floride, au sud jusqu’aux comtés de Pinellas et Brevard. Plusieurs Asteraceae, dont Bidens, Erigeron, Heterotheca, et, particulièrement, Rudbeckia.
Figure 16. Adulte de Nemognatha nemorensis Hentz, un coléoptère vésiculeux. Photographie de Sean McCann.
N. piazata Fabricius – Représentée en Floride par la race nominale (du Mississippi au sud de la Virginie occidentale), qui est présente dans tout l’État, y compris les Keys. Cirsium et Tetraognotheca (Asteraceae).
N. punctulata LeConte – Îles Bahamas et Caïmans, Cuba, Jamaïque et le sud-est des États-Unis. Enregistré en Floride uniquement dans les Keys et le comté de Dade. Bidens et « chardon » (Asteraceae). Pas commun.
Figure 17. Adulte de Nemognatha punctulata LeConte, un coléoptère vésiculeux. Photographie de Sean McCann.
Pseudozonitis longicornis (Horn) – Kansas et est du Texas vers l’est le long de la plaine côtière jusqu’à la Caroline du Sud ; enregistré en Floride du comté de Highlands vers le sud jusqu’aux Keys. Mars-juillet. Aux feux. Rare.
P. pallida Dillon – Oklahoma et est du Texas à l’est jusqu’en Floride, où elle s’étend au sud à travers les comtés de Dixie et d’Alachua jusqu’au comté de Hillsborough. Aux feux. Pas commun.
Tetraonyx quadrimaculata (Fabricius) – Trinidad, Petites Antilles, Porto Rico, Hispañola, et la plaine cÃ?tiÃ?re américaine du nord de la Floride (comtés d’Alachua et de Putnam) à l’Alabama et à la Caroline du Nord. Convolvulaceae (Ipomoea) et Leguminosae (Bradburya, Coelosia) aux Etats-Unis et ces familles et Bignoniaceae, Euphorbiaceae, et Verbenaceae aux Antilles. Signalé comme endommageant les fleurs de pamplemousse à Porto Rico.
Zonitis cribricollis (LeConte) – Largement distribué en Floride, au sud jusqu’à Dade County Achillea, Coreopsis, Helianthus, et Rudbeckia (Asteraceae). Rare.
Zonitis vittigera (LeConte) – Est des États-Unis et sud-est du Canada. Représentée en Floride, où elle est présente au sud jusqu’au comté de Highlands, par la race nominale, orientale. Nombreuses Asteraceae et Psoralea (Leguminosae).
Importance médicale et vétérinaire (Retour en haut)
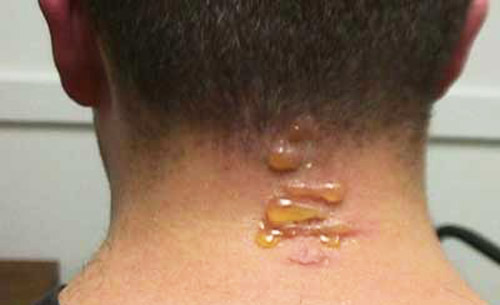
Les vésicules reçoivent leur nom commun de la capacité de leur hémolymphe à produire des cloques au contact de la peau humaine. L’hémolymphe est souvent exsudée copieusement par saignement réflexe lorsqu’un coléoptère adulte est pressé ou frotté. Les cloques apparaissent souvent sur le cou et les bras, suite à l’exposition à des coléoptères adultes attirés par les lumières extérieures la nuit. La manipulation générale des adultes entraîne rarement des cloques, sauf si l’hémolymphe entre en contact avec la peau relativement fine entre les doigts. À moins qu’il ne s’agisse de lésions importantes, il n’est probablement pas nécessaire d’administrer un traitement médical autre que les premiers soins pour la formation de cloques chez l’homme. Les ampoules sur l’individu montré sur la photo, bien qu’inconfortables, n’étaient pas douloureuses. Les cloques ont rapidement diminué d’elles-mêmes.
Figure 18. Ampoules résultant de l’écrasement d’un seul scarabée vésiculeux sur le cou. Bien qu’inconfortables, aucun traitement médical n’a été mis en œuvre et les cloques ont rapidement diminué d’elles-mêmes. Photographie de Samuel Grubb.
L’agent vésicant est la cantharidine, un terpène inodore (exo-1,2-cis-diméthyl-3,6-ep- oxyhexahydro-phtalique anhydride) présent ailleurs uniquement chez les coléoptères de la famille Oedemeridae (Arnett 2008). La cantharidine ou cantharides (corps séchés et pulvérisés de coléoptères adultes) était autrefois largement utilisée en médecine humaine et vétérinaire, principalement comme vésicant et irritant, et est encore utilisée aux États-Unis comme ingrédient actif d’un produit anti-verrues (Epstein et Epstein 1960, Kartal Durmazlar et al, 2009). Prise par voie interne ou absorbée par la peau, la cantharidine est hautement toxique pour les mammifères. Il existe une littérature abondante traitant de ses propriétés aphrodisiaques réputées et de nombreux rapports d’empoisonnements humains, tant accidentels que délibérés. La cantharide est parfois désignée comme la mouche espagnole eurasienne, Lytta vesicatoria (Linnaeus). Cependant, d’autres genres, en particulier Mylabris et Epicauta, ont été plus couramment utilisés, notamment pour l’extraction de la cantharidine. La teneur en cantharidine enregistrée chez les coléoptères adultes (en poids sec) varie de moins de 1% à un maximum de 5,4%. La synthèse et la fonction biologiques ont été largement négligées. Il est largement admis que la cantharidine confère une protection chimique contre les prédateurs, mais il existe peu de preuves à cet égard. Chez certaines espèces au moins, les femelles reçoivent de grandes quantités de cantharidine des mâles pendant la copulation. Dans tous les cas, les femelles incorporent cette matière dans un revêtement appliqué sur les œufs.
Des cas d’empoisonnements mortels de chevaux de valeur par l’ingestion de scarabées vésiculés piégés dans du foin de luzerne en balles (Kinney et al. 2006, Mackay et Wollenman 1981, Schoeb et Panciera 1979) ont relancé l’intérêt pour la pathologie de la toxicose à la cantharidine et ont conduit à la mise au point d’une technique très sensible de détection du composé (Ray et al. 1979). Des recherches sont disponibles pour indiquer la quantité de cantharidine présente dans les espèces communes, ainsi que le nombre estimé de coléoptères nécessaires pour fournir une dose létale aux chevaux (Kinney et al. 2006, Sansome 2002).
Des empoisonnements ont été attribués à plusieurs espèces. Les scarabées vésiculeux représentent une menace potentielle si les propriétaires de chevaux utilisent la luzerne comme source de foin. Cependant, la luzerne n’est pas couramment cultivée en Floride et les scarabées vésiculés sont rarement abondants. La plupart des empoisonnements en Floride résultent de l’importation de foin de luzerne en provenance d’États occidentaux connaissant des pullulations de sauterelles (Capinera, communication personnelle).
Dommages aux cultures (Retour en haut)
Plusieurs des vrillettes de Floride se nourrissent de plantes cultivées. Les espèces d’Epicauta, notamment la vrillette marginée, E. funebris, et la vrillette rayée, E. vittata, endommagent souvent la luzerne, la betterave, la pomme de terre, la tomate et d’autres cultures par défoliation. En raison du comportement grégaire de ces coléoptères, leurs attaques peuvent être localement catastrophiques. Dans les petits jardins, il peut être suffisant de simplement cueillir les coléoptères sur les plantes.
Figure 19. Dommages aux cultures causés par les adultes de la vésicule marginale, Epicauta pestifera Werner. Photographie de James Castner, Université de Floride.
Références choisies (Retour au début)
- Adams CL, Selander RB. 1979. La biologie des coléoptères vésiculeux du groupe Vittata du genre Epicauta (Coleoptera, Meloidae). Bulletin du Musuem américain d’histoire naturelle 162 : 139-266.
- Arnett Jr RH. 1960. The Beetles of the United States. Catholic University Press, Washington, D.C. 1112 pp.
- Arnett JR RH. (août 2008). Faux coléoptères de la cloque, Coleoptera : Oedemeridae. Créatures en vedette. EENY-154. (7 mai 2020)
- Bologna MA, Pinto JD. 2001. Études phylogénétiques des Meloidae (Coleoptera), en mettant l’accent sur l’évolution du phorsey. Entomologie systématique 26 : 33-72.
- Enns WR. 1956. Une révision des genres Nemognatha, Zonitis, et Pseudozonitis (Coleoptera, Meloidae) en Amérique au nord du Mexique, avec une proposition de nouveau genre. Bulletin scientifique de l’Université du Kansas 37 : 685-909.
- Epstein J, Epstein W. 1960. Traitement à la cantharidine des verrues digitales et péri-unguéales. California Medicine 93 11-12.
- Kartal Durmazlar SP, Atacan D, Eskioglu F. 2009. Traitement à la cantharidine des verrues plates faciales récalcitrantes : A preliminary study. Journal of Dermatological Treatment 20 : 114-119.
- Kinney KK, Peairs FB, Swinker AM. (mars 2006). Les coléoptères vésiculeux dans les cultures fourragères. Extension de l’Université d’État du Colorado. (7 mai 2020)
- Kirk VM. 1969. Une liste des coléoptères de la Caroline du Sud. Partie I – Plaine côtière du nord. Bulletin technique de la station d’expérimentation agricole de Caroline du Sud 1033 : 1-124.
- MacKay RJ, Wollenman P. 1981. Une épidémie d’empoisonnement par le blister beetle chez les chevaux en Floride. Florida Veterinary Journal 10 : 11-13.
- MacSwain JW. 1956. Une classification des larves de premier stade des Meloidae (Coleoptera). Entomologie Volume 12. Presse de l’Université de Californie. 182 pp.
- Pinto JD. 1991. La taxonomie des Epicauta nord-américains (Coleoptera : Meloidae), avec une révision du sous-genre nommé et une enquête sur le comportement de courtisanerie. Entomology Volume 110. University of California Press. 372 pp.
- Ray AC, Tamulinas SH, Reagor JC. 1979. Détermination par chromatographie liquide à haute pression de la cantharidine, à l’aide d’une méthode de dérivatisation dans des spécimens provenant d’animaux gravement empoisonnés par l’ingestion de scarabées vésiculeux, Epicauta lemniscata. Revue américaine de recherche vétérinaire 40 : 498-504.
- Sansome D. (mai 2002). Blister beetles. Insectes dans la ville. (n’est plus disponible en ligne).
- Scaramuzza LC. 1938. Breve nota acerca de dos parásitos de « Megachile sp. » (Hymenoptera, Apoidea, Megachilidae). Mem. Soc. Cubana Hist. Nat. 12 : 87-88.
- Schoeb TR, Panciera RJ. 1979. Pathologie de l’empoisonnement par le scarabée vésiculeux (Epicauta) chez les chevaux. Pathologie vétérinaire 16 : 18-31.
- Selander RB. 1981. Preuve d’un troisième type de proie larvaire chez les coléoptères vésiculeux (Coleoptera : Meloidae). Journal de la société entomologique du Kansas 54 : 757-783.
- Selander RB, Bouseman JK. 1960. Meloid beetles (Coleoptera) of the West Indies. Actes du Musuem national des États-Unis 111 : 197-226.
- Townsend LH. (décembre 2002). Blister beetles in alfalfa. Entomologie de l’Université du Kentucky. (17 février 2017)
- Werner FG. 1945. Une révision du genre Epicauta en Amérique au nord du Mexique (Coleoptera, Meloidae). Bulletin du Musée de zoologie comparée (Université de Harvard) 95 : 421-517.