History
1900年代初頭、研究者はラットの食事に生の卵白を大量に含めると毒性症状が生じることを発見しました。 1926年、ボアスはこれらの毒性症状を卵白損傷症候群と名付けました。 主な所見は、重度の皮膚炎、脱毛、筋肉の協調性の欠如などであった。 また、ボアは、酵母やレバーなどいくつかの食品に、卵白損傷症候群からラットを保護する物質が含まれていることに注目した。 卵白損傷症候群の生化学的根拠は、生の卵白にビオチンとの親和性が高いアビジンという糖タンパク質が含まれていることが判明して、すぐに明らかになりました。 ビオチンとアビジンの結合は基本的に不可逆的であるため、ビオチンは食物から遊離せず、ビオチン-アビジン複合体は糞便中に失われるのである。 卵白損傷症候群の謎を解く最後のステップは、卵白を加熱することで症候群を予防できることを示したことである。この加熱は、アビジンを変性させ、ビオチンとの親和性を破壊するプロセスである。
構造
ビオチンは、ウレイド環とテトラヒドロチオフェン環が融合した二環式分子で、ウレイド環は卵白に含まれる糖タンパク質のアビジンへの高い親和性に関与していることが分かっています。 テトラヒドロチオフェン環の2つの炭素原子のうちの1つに、吉草酸の置換基が結合している。
ビオチンの機能
ビオチンはカルボキシル化反応の補因子としてよく知られていますが、最近の研究では、遺伝子発現や免疫機能の調節にも重要な役割を果たしていることが分かっています。
ビオチン依存性カルボキシル化反応
脂質、グルコース、アミノ酸の代謝に関わるカルボキシル化反応において、ビオチンは補酵素として機能する。 ビオチン依存性カルボキシラーゼは5種類あり、それぞれ不活性型アポフォームとして存在する。 ホロカルボキシラーゼ合成酵素(HCLS)は、不活性型アポフォームにビオチンを付加(ビオチン化)し、活性型カルボキシラーゼを生成する触媒作用を持つ。 5つのカルボキシラーゼは、いずれもビオチンが補酵素または補欠基として機能し、多段階の反応においてCO2の運搬役を果たしている
5つのビオチン依存性カルボキシラーゼとその機能を以下に簡単に説明する。
ピルビン酸カルボキシラーゼ(PC)は、ピルビン酸からオキサロ酢酸の生成を触媒し、TCAサイクル、糖新生および脂肪生成において重要なステップであり、この機能の欠如は低血糖、ケトーシス、乳酸中毒を引き起こす可能性がある。
プロピオニルCoAカルボキシラーゼ(PCC)は、プロピオニルCoAからメチルマロニルCoAへの変換を触媒し、これが異性化してスクシニルCoAになり、TCA(クレブス)サイクルに入る。 PCCは奇数鎖脂肪酸、アミノ酸のイソロイシン、バリン、メチオニン、スレオニンの代謝に重要である。 この酵素の機能が欠落するとプロピオン酸血症になることがある。
3-Methylcrotonoyl-CoA carboxylase (MCC) は、分岐鎖アミノ酸であるロイシンの異化に関与しています。 ビオチンが不足すると、ロイシン異化産物が別の異化経路に移行し、3-ヒドロキシイソ吉草酸が生成され、尿中に排泄される。
Acetyl-CoA carboxylase I (ACC I) は、細胞質でアセチルCoAからマロニルCoAへの変換を触媒し、脂質合成に重要なステップとなる。 Acetyl-CoA carboxylase II (ACC II) はミトコンドリアで同一の反応を触媒し、その結果のマロニルCoAは脂肪酸酸化に制御的役割を担っている。
ACC Iは細胞質酵素であり、残りのカルボキシラーゼはミトコンドリアに存在する。
ビオチン欠乏の臨床症状は、ホロカルボキシラーゼ合成酵素の欠損または個々のカルボキシラーゼ酵素の欠損を引き起こす遺伝病の結果としても起こり得る。
遺伝子発現
研究により、ヒストンのビオチン化は遺伝子発現に関与している可能性があることが示されている。 ヒトのヒストンには、ビオチンと結合する部位が複数同定されています。 また、ビオチンは他のメカニズムで遺伝子発現に影響を与える可能性もある。 ヒトの細胞では、数千のビオチン依存性遺伝子が知られている。 ビオチンの影響を受ける遺伝子には、グルコース代謝に関わる酵素(例:グルコキナーゼ)、インターロイキン2のようなサイトカイン、インスリン受容体をコードするものがある。
免疫機能
研究では、抗体産生、マクロファージ機能、TおよびBリンパ球の分化、ナチュラルキラー細胞の正常な機能におけるビオチンの役割が示唆されています。 ビオチン欠乏症の患者では、特に真菌の感染症がよく再発します。
ビオチン-チアミン反応性基底核疾患(BTBGD)は、発作や脳症を呈し、昏睡や死に進行するまれな神経学的な状態です。 高用量のビオチン(5-10mg/kg/日)がこの症状の治療に成功しているが、その作用機序は不明である。
最近、高用量ビオチン治療(100-300mg/日)が、多発性硬化症の患者のサブセットで症状を改善することがわかった。 神経症状の改善には、長鎖脂肪酸の合成に対する高用量ビオチンの効果による二次的なミエリン産生の改善が関与していると考えられています。
髪、皮膚、爪の障害を持つ個人におけるビオチンの役割
ビオチンサプリメントは、髪、皮膚、爪を健康にすることを望む人々によって広く使用されています。 しかし、この用途におけるビオチンの有効性については、限られたエビデンスしかありません。 ビオチンを大量に摂取すると、家族性非可逆性毛髪症候群と脆性爪症候群という2つのまれな症状において有用であることが判明しています。 脱毛を呈する541人の女性を対象とした研究では、患者の38%で血清ビオチンレベルが低いことが判明している。 著者は、脱毛の病因は多因子性であり、ビオチン欠乏が証明され、他の原因が除外された場合には、ビオチンのサプリメントを検討することができると結論付けている。
ビオチンの供給源
ビオチンは、さまざまな食品(肉、乳製品、野菜、種子、ナッツ)に含まれ、腸内細菌によっても生産されている。 さらに、かなりの割合の個人が、ビオチンを含む栄養補助食品を消費している可能性がある。
ビオチン生理
摂取したビオチンは、遊離型とタンパク質結合型で存在します。 タンパク質結合型は、消化管のプロテアーゼやペプチダーゼによって消化され、ビオシチンやビオチンオリゴペプチドが形成されます。 遊離型ビオチンは、腸内ビオチニダーゼの作用により、ビオシチンおよびビオチンオリゴペプチドから遊離される。 ビオチンは小腸でNa+依存性キャリアを介し吸収されるが、このキャリアは他の2つの栄養素、パントテン酸とリポ酸も輸送するため、Na依存性マルチビタミントランスポーター (SMVT) として知られる。 ヒトのSMVT遺伝子は染色体2p23に位置している。 SMVTの活性はビオチン濃度によって制御されており、ビオチン欠乏時には活性が上昇し、ビオチン過剰摂取時には活性が下降することがわかっています。 細菌によって合成されたビオチンは、結合していない状態で存在し、同様のキャリアを介したメカニズムによって大腸で吸収されます。 尿と便に含まれるビオチンの1日の排出量を合わせると、食事からの摂取量を上回ることから、ビオチンの供給源として腸内細菌叢が果たしている重要な役割が示唆される。
一旦吸収されたビオチンは、様々なビオチン化プロセスに利用できるようになります。 ビオチンは5つのアポカルボキシラーゼのそれぞれに結合し、ホロカルボキシラーゼ合成酵素の働きで対応するホロカルボキシラーゼ(下の画像参照)を形成する。
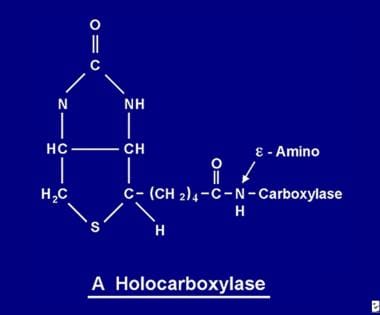 ビオチン分子はアポカルボキシラーゼのeアミノ基とペプチド結合でタンパク質と結びつき、ホロカルボキシラーゼとなる。
ビオチン分子はアポカルボキシラーゼのeアミノ基とペプチド結合でタンパク質と結びつき、ホロカルボキシラーゼとなる。 ビオチンのリサイクル
ホロカルボキシラーゼ酵素が数回のカルボキシル化を行った後、細胞内のリソソームに捕捉される。 リソソームでは、様々なタンパク質分解酵素がホロカルボキシラーゼを分解してビオシチンを生成し、これがビオチニダーゼという酵素によって加水分解されてビオチンとリジンが生成される。 遊離したビオチンはアポカルボキシラーゼに挿入され、新しいホロカルボキシラーゼ分子を形成することができる。 このリサイクルプロセスは100%効率的ではありません。 その結果、少量の遊離ビオチン(および一部のビオシチン)がサイクルから外れて、糞便や尿中に失われる。 このため、体内から失われたビオチンを補給するために、腸にビオチンを供給する必要がある。 ビオチンは、腸に入り、吸収され、ホロカルボキシラーゼに取り込まれ、ホロカルボキシラーゼが分解されて遊離ビオチンとなり、ビオチンサイクルを構成している(下図)。
ビオチニダーゼという酵素はビオチンの再利用に不可欠であり、ビオチニダーゼ欠乏症の人はビオチン欠乏症の兆候や症状を呈することになります。
ビオチン欠乏症の原因
前述のように、ビオチンは食品中に広く存在し、腸内フローラによっても生成され、酵素ビオチニダーゼの助けを借りて体内で広くリサイクルされているため、通常の食事をする健康な人がビオチン欠乏症を起こすことはまれである。 ビオチン欠乏症になる可能性のある状態を以下に説明します:
生の卵白の過剰摂取。 生の卵白に含まれるアビジンは、ビオチンとの親和性が高く、吸収されない。 熱でアビジンは破壊されるので、加熱した卵を食べる人はビオチン不足の心配はない。 生卵の白身は、過剰に(おそらく1日に1ダース以上)食べた場合にのみ、ビオチン欠乏症につながるのである。
ビオチンの補給をしない完全非経口栄養法。 ビオチンを添加しない長期の完全非経口栄養(TPN)療法を受けている患者におけるビオチン欠乏症のいくつかの症例が報告されている。 したがって、TPNを受けているすべての患者は、特にTPN療法が1週間以上続くと予想される場合は、ビオチンも推奨1日投与量で投与する必要がある。 現在、すべての病院の薬局では、TPN製剤にビオチンが含まれています。
ビオチンが不十分な乳児用ミルクの使用:ビオチン欠乏症は、低アレルギー性フォーミュラを投与された乳児で報告されている。
慢性的な抗けいれん剤治療。 抗けいれん剤であるフェノバルビタール、フェニトイン、プリミドン、カルバマゼピンの長期使用は、ビオチン欠乏症に関連している。 そのメカニズムとしては、腸粘膜を介したビオチンの取り込み阻害、ビオチンの異化作用の促進、ビオチンの腎再吸収障害などが考えられている。 したがって、ビオチン欠乏症に関連する抗けいれん剤で治療を受けている患者には、ビオチンの補給が提案されている。
長期の抗生物質経口投与。 経口抗生物質の長期使用は、ビオチン欠乏症と関連している。 ビオチンを産生する腸内細菌叢の阻害がビオチン欠乏症の基礎と推定されています。 また、ビオチンを消費する細菌が抗生物質によって過剰に繁殖することもメカニズムとして考えられる。
喫煙と慢性アルコール中毒。 喫煙は、特に女性においてビオチンの異化を促進する可能性があることが研究により示されている。 慢性アルコール中毒は、ビオチンの腸内吸収不良を引き起こす可能性があります。
ショートガット症候群と炎症性腸疾患:ショートガット症候群と炎症性腸疾患は、ビオチンの吸収を促進します。 短腸症候群と炎症性腸疾患の個人は、ビオチンの腸内吸収不良の結果として、ビオチン欠乏症のリスクもある。
妊娠中や授乳期のビオチン欠乏症。 最近の研究では、妊娠中および授乳中の女性のかなりの割合でビオチンレベルが低下していることが示されている。 妊娠中の限界的なビオチン欠乏は催奇形性を持つかもしれないと懸念されており、一部の専門家は妊婦によるビオチンの高い摂取を推奨しています。
ビオチン代謝の特定の先天性異常もまた、ビオチン欠乏症の発現につながる可能性があります。
ビオチニダーゼ欠損症(BTD)は常染色体劣性遺伝で、約6万人に1人の頻度で発生する。 本疾患のホモ接合体では、ビオチニダーゼレベルが< 30%正常であり、ビオチンのリサイクルの減少による遊離ビオチンの放出不足からビオチン欠乏症が引き起こされる。 ビオチン欠乏症の症状は、通常、生後1週間から1年の間に発症する。 酵素欠乏の重症度は様々である。 重度のビオチニダーゼ欠損症ではBTD値が正常値の10%未満であり、部分的なビオチニダーゼ欠損症では酵素値が正常値の10~30%である。 米国をはじめとする多くの国では、新生児スクリーニング検査にビオチニダーゼ欠損症の検査が含まれています。 BTD遺伝子の変異は約150種類報告されており、ビオチニダーゼ欠乏症の原因となっています。 BTD遺伝子は染色体3p25に位置しています。 ビオチニダーゼ欠損症のモデルマウスは、本疾患の様々な側面を研究するために開発されました。
ホロカルボキシラーゼ合成酵素(HCLS)欠損症も常染色体劣性遺伝性の疾患で、出生前に診断されることがある。 先に述べたように、酵素HCLSはアポカルボキシラーゼ酵素を活性型ホロカルボキシラーゼにビオチン化するのに必要であり、欠損すると複数のカルボキシラーゼ欠損となる。 この疾患を持つ乳児は、生後数ヶ月でアシドーシス、高アンモニア血症、低血圧、発作および発達遅滞を呈する。 HCLS遺伝子に変異があるとHCLS欠損症になる。
ビオチニダーゼとHCLSの両方が欠損すると、ビオチン依存性カルボキシラーゼのレベルが低下するため、この2つの疾患は多重カルボキシラーゼ欠損症とも分類される。 以前は、ビオチニダーゼ大量欠損症は早期発症型多発性カルボキシラーゼ欠損症、ビオチニダーゼ部分欠損症は晩発性または若年性多発性カルボキシラーゼ欠損症、HCLS欠損症は新生児または早期発症型多発性カルボキシラーゼ欠損症と呼ばれていました。
まれに、5つの個々のビオチン依存性カルボキシラーゼのそれぞれの単独欠損も起こりうる。
ビオチン輸送の欠陥によるビオチン欠乏症も報告されている。
ビオチン欠乏症の病因に関係なく、臨床症状は類似している。 しかし、発症年齢、症状発現の速度、症状発現の順序は大きく異なることがあります。 症状の発現に関与するすべてのメカニズムは確立されていません
。