Voltaïsche (Galvanische) cellen
Om de basisprincipes van een galvanische cel te illustreren, laten we de reactie van metallisch zink met koperion (Cu2+) beschouwen om kopermetaal en Zn2+ ion te geven. De chemische reactievergelijking is als volgt:
We kunnen deze reactie laten plaatsvinden door een zinkstaaf in een waterige oplossing van koper(II)sulfaat te brengen. Tijdens de reactie lost de zinkstaaf op en vormt zich een massa metallisch koper. Deze veranderingen vinden spontaan plaats, maar alle energie die vrijkomt is in de vorm van warmte en niet in een vorm die kan worden gebruikt om arbeid te verrichten.
Dezelfde reactie kan worden uitgevoerd met de galvanische cel die is afgebeeld in figuur {PageIndex{3a}). Om de cel in elkaar te zetten wordt een koperstrip in een bekerglas met een 1 M oplossing van Cu2+ ionen gelegd, en een zinkstrip in een ander bekerglas met een 1 M oplossing van Zn2+ ionen. De twee metalen strips, die als elektroden dienen, zijn met elkaar verbonden door een draad, en de compartimenten zijn met elkaar verbonden door een zoutbrug, een U-vormige buis die in beide oplossingen is geplaatst en die een geconcentreerde vloeibare of gegeleerde elektrolyt bevat. De ionen in de zoutbrug worden zo gekozen dat zij de elektrochemische reactie niet verstoren door zelf geoxideerd of gereduceerd te worden of door een neerslag of complex te vormen; algemeen gebruikte kationen en anionen zijn respectievelijk Na+ of K+ en NO3- of SO42-. (De ionen in de zoutbrug hoeven niet dezelfde te zijn als die in het redoxpaar in beide compartimenten). Wanneer de kring gesloten is, treedt een spontane reactie op: zinkmetaal wordt geoxideerd tot Zn2+-ionen aan de zinkelektrode (de anode), en Cu2+-ionen worden gereduceerd tot Cu-metaal aan de koperelektrode (de kathode). Naarmate de reactie vordert, lost de zinkstrip op en neemt de concentratie van Zn2+-ionen in de Zn2+-oplossing toe; tegelijkertijd wint de koperstrip aan massa en neemt de concentratie van Cu2+-ionen in de Cu2+-oplossing af (figuur). We hebben dus dezelfde reactie uitgevoerd als met één bekerglas, maar nu zijn de oxidatieve en reductieve halfreacties fysisch van elkaar gescheiden. De elektronen die vrijkomen aan de anode stromen door de draad, waardoor een elektrische stroom ontstaat. Galvanische cellen zetten dus chemische energie om in elektrische energie, die vervolgens kan worden gebruikt om arbeid te verrichten.
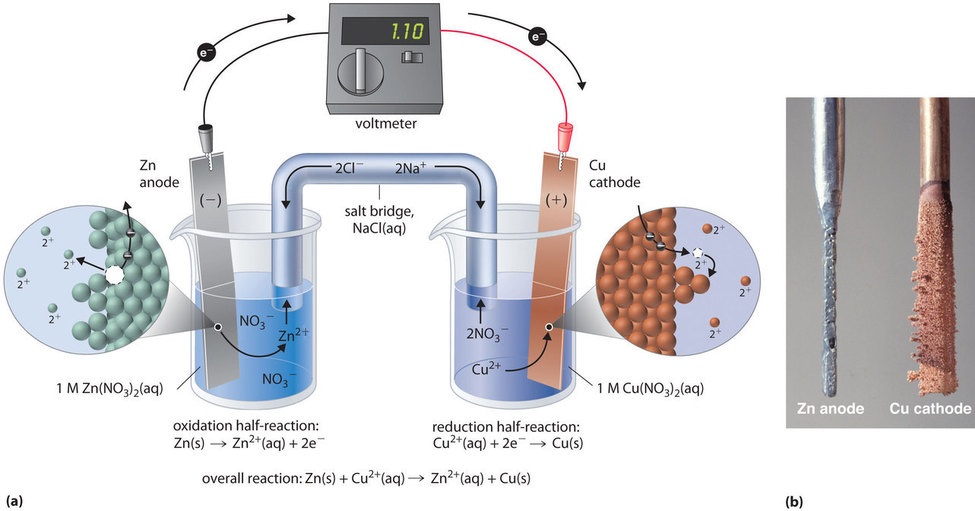
De elektrolyt in de zoutbrug dient twee doelen: het vervolledigt de stroomkring door elektrische lading te dragen en handhaaft de elektrische neutraliteit in beide oplossingen door ionen tussen beide oplossingen te laten migreren. De identiteit van het zout in een zoutbrug is onbelangrijk, zolang de samenstellende ionen niet reageren of een redoxreactie ondergaan onder de werkingsomstandigheden van de cel. Zonder een dergelijke verbinding zou de totale positieve lading in de Zn2+-oplossing toenemen naarmate het zinkmetaal oplost, en de totale positieve lading in de Cu2+-oplossing zou afnemen. Door de zoutbrug kunnen ladingen worden geneutraliseerd door een stroom van anionen in de Zn2+ oplossing en een stroom van kationen in de Cu2+ oplossing. Bij afwezigheid van een zoutbrug of een andere soortgelijke verbinding zou de reactie snel ophouden omdat de elektrische neutraliteit niet kan worden gehandhaafd.
Met een voltmeter kan het verschil in elektrische potentiaal tussen de twee compartimenten worden gemeten. Het openen van de schakelaar die de draden met de anode en de kathode verbindt, verhindert het vloeien van een stroom, zodat geen chemische reactie optreedt. Als de schakelaar echter gesloten is, is het externe circuit gesloten en kan er een elektrische stroom vloeien van de anode naar de kathode. De potentiaal (E_{cell}) van de cel, gemeten in volt, is het verschil in elektrische potentiaal tussen de twee halfreacties en is gerelateerd aan de energie die nodig is om een geladen deeltje in een elektrisch veld te bewegen. In de beschreven cel geeft de voltmeter een potentiaal van 1,10 V aan (figuur \PageIndex{3a})). Omdat elektronen van de oxidatiehalfreactie vrijkomen aan de anode, is de anode in een galvanische cel negatief geladen. De kathode, die elektronen aantrekt, is positief geladen.
Niet alle elektroden ondergaan een chemische transformatie tijdens een redoxreactie. De elektrode kan worden gemaakt van een inert, sterk geleidend metaal, zoals platina, om te voorkomen dat het reageert tijdens een redoxproces, waarbij het niet in de totale elektrochemische reactie optreedt. Dit verschijnsel wordt geïllustreerd in Voorbeeld
Een galvanische (voltaïsche) cel zet de energie die vrijkomt bij een spontane chemische reactie om in elektrische energie. Een elektrolytische cel verbruikt elektrische energie van een externe bron om een niet-spontane chemische reactie aan te drijven.
Voorbeeld (PaginaIndex{1})
Een chemicus heeft een galvanische cel geconstrueerd die uit twee bekerglazen bestaat. Het ene bekerglas bevat een strip tin ondergedompeld in waterig zwavelzuur, en het andere bekerglas bevat een platina elektrode ondergedompeld in waterig salpeterzuur. De twee oplossingen zijn verbonden door een zoutbrug, en de elektroden zijn verbonden door een draad. Er begint stroom te lopen en er verschijnen gasbellen aan de platina-elektrode. De spontane redoxreactie die optreedt, wordt beschreven door de volgende evenwichtige chemische vergelijking:
Voor deze galvanische cel,
- schrijf de halfreactie die optreedt bij elke elektrode.
- geef aan welke elektrode de kathode en welke de anode is.
- aangeven welke elektrode de positieve elektrode is en welke de negatieve.
Gegeven: galvanische cel en redoxreactie
Vraag: halfreacties, identiteit van anode en kathode, en toewijzing van de elektrode als positief of negatief
Strategie:
- Identificeer de oxidatiehalfreactie en de reductiehalfreactie. Identificeer vervolgens de anode en kathode van de halfreactie die bij elke elektrode optreedt.
- Vanuit de richting van de elektronenstroom, wijs je elke elektrode aan als positief of negatief.
Oplossing
A In de reductiehalfreactie wordt nitraat gereduceerd tot stikstofmonoxide. (Het stikstofmonoxide zou dan met zuurstof in de lucht reageren tot NO2, met zijn karakteristieke rood-bruine kleur). In de oxidatiehalfreactie wordt metallisch tin geoxideerd. De halfreacties die overeenkomen met de werkelijke reacties die in het systeem optreden, zijn als volgt:
reductie:
oxidatie:
Hierdoor wordt nitraat gereduceerd tot NO, terwijl de tinelektrode wordt geoxideerd tot Sn2+.
Omdat de reductiereactie plaatsvindt bij de Pt-elektrode, is deze de kathode. Omgekeerd vindt de oxidatiereactie plaats bij de tinelektrode, die dus de anode is.
B Elektronen stromen van de tinelektrode door de draad naar de platina-elektrode, waar ze overgaan in nitraat. Het elektrisch circuit wordt gecompleteerd door de zoutbrug, die de diffusie van kationen naar de kathode en van anionen naar de anode mogelijk maakt. Omdat elektronen van de tinelektrode wegvloeien, moet deze elektrisch negatief zijn. Daarentegen stromen elektronen naar de Pt-elektrode, zodat die elektrode elektrisch positief moet zijn.
Oefening
Bedenk een eenvoudige galvanische cel die bestaat uit twee bekers die door een zoutbrug met elkaar zijn verbonden. Het ene bekerglas bevat een oplossing van MnO_4^{-}} in verdund zwavelzuur en heeft een Pt-elektrode. Het andere bekerglas bevat een oplossing van Sn^{2+}} in verdund zwavelzuur, ook met een Pt-elektrode. Wanneer de twee elektroden door een draad met elkaar zijn verbonden, gaat er stroom lopen en ontstaat er een spontane reactie die wordt beschreven door de volgende evenwichtige chemische vergelijking:
Voor deze galvanische cel
- schrijf de halfreactie die bij elke elektrode optreedt.
- geef aan welke elektrode de kathode en welke de anode is.
- geef aan welke elektrode positief en welke negatief is.
Antwoord a
&→ \ce{Sn^{4+}(aq) + 2e^{-}}
Antwoord b
De Pt-elektrode in de permanganaatoplossing is de kathode; die in de tinoplossing is de anode.
Antwoord c
De kathode (elektrode in het bekerglas dat de permanganaatoplossing bevat) is positief, en de anode (elektrode in het bekerglas dat de tinoplossing bevat) is negatief.