Tijdens de bijeenkomst van de American Academy of Ophthalmology in 2013 nam ik deel aan een debat over de voor- en nadelen van het gebruik van generieke versus merkmedicijnen. Er werd mij gevraagd om te pleiten voor merkgeneesmiddelen, maar zoals in de meeste debatten is het een oversimplificatie om blindelings de ene of de andere kant te kiezen. De realiteit is gecompliceerder. Generieke medicijnen hebben kosten in hun voordeel, maar soms bieden ze niet dezelfde behandelingsspecificaties of resultaten als merkmedicijnen, ondanks de inspanningen van de Food and Drug Administration om ervoor te zorgen dat ze dat wel doen.
Hier wil ik het hebben over enkele van de manieren waarop generieken kunnen verschillen van de merkmedicijnen die ze vervangen, en waar artsen op moeten letten.
De kwestie van bio-equivalentie
De hindernissen die nodig zijn om een nieuw, “innovator” geneesmiddel op de markt te krijgen zijn wezenlijk anders dan die voor een generiek opvolgmedicijn. Dat is natuurlijk een deel van de reden waarom een merkmedicijn meer kost. Waar het initiële innovator-geneesmiddel veiligheid en werkzaamheid moet bewijzen via klinische proeven, hoeft een generiek geneesmiddel alleen bio-equivalentie aan te tonen.
Hoewel bio-equivalentie klinkt alsof het zou kunnen inhouden dat er biologische studies moeten worden uitgevoerd, definieert de FDA het zo dat u moet aantonen dat de ingrediënten van uw generieke versie een exacte kopie zijn van de ingrediënten in het oorspronkelijke geneesmiddel, met inbegrip van zowel actieve ingrediënten als hulpstoffen. (Als de actieve bestanddelen en de hulpstoffen niet identiek zijn, wordt het geneesmiddel niet als generiek beschouwd; het moet dan de gewone FDA-goedkeuring ondergaan, net als elk nieuw geneesmiddel). De veronderstelling is dat het generieke geneesmiddel daardoor dezelfde veiligheid en werkzaamheid zal hebben als het merkgeneesmiddel.
Helaas is het idee dat generieke geneesmiddelen gelijk zijn aan merkgeneesmiddelen omdat de ingrediënten hetzelfde zijn, niet noodzakelijk waar. Veel factoren die de werkzaamheid van een topisch geneesmiddel beïnvloeden, zijn onafhankelijk van de ingrediënten in het flesje. Bijvoorbeeld:
– Het materiaal van de fles is van belang. De ingrediënten van veel merkmedicijnen zijn afgestemd op het materiaal van de fles die wordt gebruikt. Dit was zeker het geval bij latanoprost, waarbij de compatibiliteit met het materiaal van de flacon een groot deel uitmaakte van het onderzoeks- en ontwikkelingsproces toen Xalatan op de markt werd gebracht. Dit is niet iets dat rechtstreeks door de FDA wordt onderzocht.
– De vorm en grootte van de fles beïnvloedt het gebruik. Bij proeven met innovatieve geneesmiddelen wordt niet alleen het geneesmiddel getest, maar ook de fles waarin het aan patiënten zal worden geleverd, dus de impact van de vorm en grootte van de fles is in aanmerking genomen. Fabrikanten van generieke geneesmiddelen zijn echter niet verplicht om de vorm en grootte van de flesjes te kopiëren, en dit kan een verschil maken in hoe gemakkelijk patiënten het geneesmiddel kunnen gebruiken.
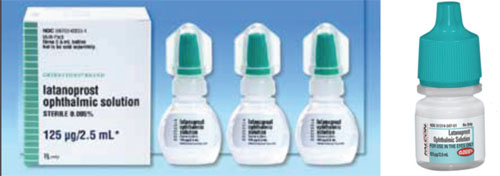
Een kwestie die verwarring kan veroorzaken bij de overstap van een merkgeneesmiddel naar een generiek geneesmiddel, of van het ene generieke geneesmiddel naar het andere, is het verschil in dopvorm en -kleur.
Zo wordt Xalatan bijvoorbeeld geleverd in een plat, klein flesje dat een zekere inspanning en finesse vergt om erin te knijpen om er een druppel uit te krijgen. Sommige van de generieke flesjes latanoprost zijn daarentegen rond en stijver, waardoor het voor de patiënt moeilijker is om in het flesje te knijpen. (Zie voorbeelden op de volgende pagina.) Veel van onze patiënten zijn bejaard en hebben lichamelijke beperkingen. Als zij gewend zijn in een bepaald flesje te knijpen dat plat en iets minder stijf is, en dan overschakelen op een flesje dat rond en stijver is, kan de toedieningsprocedure – en hun therapietrouw – anders zijn dan wanneer zij het vorige flesje gebruikten. Aangezien de vorm en grootte van de flesjes door elke generieke fabrikant wordt gekozen, krijgen patiënten het geneesmiddel de ene keer in een plat flesje en de andere keer in een rond flesje. Dat heeft tot veel verwarring bij onze patiënten geleid.
– De kleur van de dop komt niet altijd overeen. De kleuren van de dopjes van oogheelkundige geneesmiddelen moeten overeenkomen met die van de geneesmiddelencategorie. De FDA probeert ervoor te zorgen dat de kleur correct is, maar er zijn gevallen geweest waarin een dop van een andere kleur er doorheen geglipt is. Als gevolg daarvan verschilt soms de kleur (en ook de vorm en grootte) van de dop van het flesje van het generieke geneesmiddel van dat van het merkgeneesmiddel (zie het voorbeeld hierboven). Dit schept veel verwarring wanneer patiënten zich proberen te herinneren welke van de verschillende druppels zij op welk moment moeten innemen.
Zelfs als een patiënt nooit het merkgeneesmiddel met de juiste dopkleur heeft gebruikt, is een veranderde kleur nog steeds een probleem; de nieuwe dopkleur kan in feite dezelfde kleur zijn als een ander geneesmiddel dat de patiënt gebruikt. Zo horen flesjes met prostaglandine-analogen een groenblauwe dop te hebben. Als uw patiënt een generieke versie gebruikt waarvan het flesje een witte dop heeft, zou ze het kunnen verwarren met andere klassen van medicatie die een witte dop horen te hebben.
– Als u een voorbeeld van een onjuiste dopkleur opmerkt, heeft de FDA gezegd dat het dit graag zou willen horen, zodat stappen kunnen worden ondernomen om de discrepantie te corrigeren.
– De druppelgrootte kan anders zijn. Topische druppelflacons op de markt geven op dit moment een dosis van 30 tot 50 µl per druppel. Helaas kan er veel verschil zijn tussen merkformuleringen en generieke formuleringen, simpelweg omdat de tip een groter of kleiner gaatje kan hebben. Dit kan uiteraard gevolgen hebben voor de hoeveelheid geneesmiddel die daadwerkelijk in het oog terechtkomt: misschien minder, misschien meer.
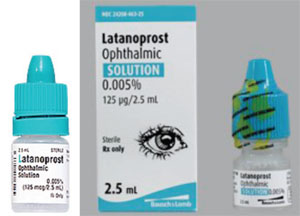
Een ander probleem zijn de verschillen in vorm en stijfheid van de flesjes, die het aanbrengen van druppels voor een oudere patiënt moeilijker kunnen maken. xalatan wordt bijvoorbeeld geleverd in een plat flesje; veel generieke geneesmiddelen hebben een rond flesje dat moeilijker is uit te knijpen.
Nog interessanter is dat er een generiek timolol op de markt is gekomen dat helemaal geen gaatje in de tip heeft; de patiënt moest in de tip prikken om de medicatie eruit te krijgen, vergelijkbaar met een tube superlijm. Dat zorgde voor verwarring bij veel patiënten; sommigen realiseerden zich niet dat ze dit moesten doen, en probeerden de druppels toch te gebruiken. Ze dachten dat ze er een druppel op deden, maar ze hadden het flesje nooit geopend, dus kwam er niets uit. Anderen dachten dat het flesje defect of leeg was. Plus, een zelfgemaakt gaatje kan uiteindelijk elke grootte hebben, wat de dosis beïnvloedt, en het proces van het maken van het gaatje kan gemakkelijk de steriliteit van de inhoud in gevaar brengen.
Al deze overwegingen – flesje materiaal, vorm en grootte, dop kleur en diameter van de druppelopening – zijn zeer belangrijk voor zowel de arts als de patiënt. Helaas kunnen deze overwegingen over het hoofd worden gezien, omdat de nadruk ligt op het proberen te bewijzen van bio-equivalentie.
– Het generieke geneesmiddel van een patiënt kan er van maand tot maand anders uitzien. Dit is een ander ongelukkig neveneffect van generieke geneesmiddelen. Het gebeurt omdat er meerdere fabrikanten kunnen zijn van een bepaald generiek geneesmiddel, elk met een andere fles. Zo zijn er op dit moment zes tot acht verschillende fabrikanten van generieke latanoprost op de Amerikaanse markt. Welke een bepaalde apotheek verkoopt, kan veranderen, omdat een keten zoals CVS, Walgreens of Walmart meestal zal kiezen voor de fabrikant die de apotheekgroep op een bepaald moment de beste deal geeft. Als gevolg daarvan kan een apotheek van generiek geneesmiddel veranderen wanneer een andere fabrikant van generieke geneesmiddelen een lager bod uitbrengt. Dus zelfs als de patiënt naar dezelfde apotheek gaat, kan hij verschillende generieke versies van een geneesmiddel krijgen op verschillende tijdstippen. Dat kan verwarrend zijn als de flesjes er anders uitzien en/of zich anders gedragen. (Er kan zelfs een verschil zijn in tolerantie en IOP-controle tussen de twee.)
De bijsluiter
Indirect, zelfs als een generiek geneesmiddel een probleem blijkt te hebben, verhinderen de huidige regels de fabrikanten om artsen of patiënten te waarschuwen. Er is een regel die fabrikanten van generieke geneesmiddelen verplicht een exacte kopie bij te voegen van de bijsluiter die bij het innovatieve geneesmiddel zit. Hoewel deze regel bedoeld was om het idee te weerspiegelen dat de geneesmiddelen bio-equivalent zijn, is het onbedoelde neveneffect geweest dat de fabrikanten van generieke geneesmiddelen niet dezelfde zorgvuldigheidseisen en veiligheidslast opgelegd krijgen die we van fabrikanten van merkgeneesmiddelen eisen.
Het gevolg is dat als de generieke fabrikant een geneesmiddel op de markt brengt en merkt dat sommige bijwerkingen of ongewenste voorvallen zich voordoen bij het generieke product, hij de bijsluiter niet mag wijzigen om artsen en patiënten te waarschuwen dat er een probleem kan zijn. Bovendien kan deze regel de motivatie van generieke fabrikanten om adequaat toezicht te houden op hun producten daadwerkelijk verminderen; er is immers geen dreiging van een rechtszaak als er een probleem optreedt.
Gelukkig is deze kwestie onder de aandacht van de FDA gekomen. In november 2013 heeft de FDA een regel voorgesteld die fabrikanten van generieke geneesmiddelen zou toestaan hun etiketten bij te werken als ze informatie ontvangen over potentiële veiligheidsproblemen. Als dit wordt aangenomen, zal dit een heel eind in de richting gaan van het waarborgen van de veiligheid voor onze patiënten.
geïmporteerde generieke geneesmiddelen
Een ander probleem met generieke geneesmiddelen is dat veel ervan buiten de Verenigde Staten worden geproduceerd, waar de kwaliteitscontrole soms een echt punt van zorg is geweest. De problemen variëren van mysterieuze onzuiverheden die in de geneesmiddelen worden aangetroffen, tot gebrekkige afstemming van ingrediënten, tot ronduit frauduleuze formuleringen die geen enkel heilzaam doel dienen (wat in sommige gevallen kan resulteren in ernstige schade voor patiënten).
De realiteit is dat generieke geneesmiddelen niet noodzakelijkerwijs hetzelfde zijn als de merkgeneesmiddelen, zelfs niet als ze voldoen aan de bioequivalentie-eisen van de FDA. Dat betekent dat wij en onze patiënten bij het gebruik van generieke geneesmiddelen de verantwoordelijkheid hebben om de veiligheid en werkzaamheid te waarborgen.
Volgens de New York Times levert de Indiase farmaceutische industrie momenteel 40 procent van de receptvrije en generieke geneesmiddelen die in de Verenigde Staten worden geconsumeerd. Veel van de Indiase fabrieken zijn van wereldklasse en “vrijwel niet te onderscheiden” van Amerikaanse productiefaciliteiten (aldus de Times), waar kwalitatief hoogwaardige en betrouwbare medicijnen worden geproduceerd. Maar tegelijkertijd heeft de Wereldgezondheidsorganisatie geschat dat één op de vijf in India geproduceerde geneesmiddelen namaak is. (Soortgelijke problemen zijn gemeld met geneesmiddelen die in andere landen, waaronder China, zijn vervaardigd.)
Onze groep heeft een paar jaar geleden een onderzoek gedaan waarbij latanoprost die in India is vervaardigd, werd vergeleken met Xalatan. We ontdekten dat de stabiliteit van de actieve ingrediënten niet hetzelfde was in de loop van de tijd of bij blootstelling aan hitte. Bovendien vonden we verontreinigingen in alle geïmporteerde flessen, waaronder microscopische filamenten die op touw leken, en wat we “UFO’s” noemden.”
Het punt is dat het toezicht op productiepraktijken die in het buitenland plaatsvinden bij niet in de Verenigde Staten gevestigde bedrijven, vooral bedrijven die geen merkmedicijnen op de markt hebben, gewoon niet hetzelfde is.
Sommige artsen gaan er misschien van uit dat dergelijke geïmporteerde geneesmiddelen alleen een probleem zijn wanneer patiënten geneesmiddelen buiten de Verenigde Staten via internet kopen om geld te besparen, maar de realiteit is dat deze import hier in toenemende mate beschikbaar is. Indiase formuleringen van timolol en travoprost zijn momenteel verkrijgbaar via in de VS gevestigde distributeurs, en andere geneesmiddelen zoals NSAID’s zullen binnenkort verkrijgbaar zijn. Het is duidelijk dat veel bedrijven buiten de Verenigde Staten generieke geneesmiddelen van hoge kwaliteit produceren; de zorg is dat een aantal van hen dat niet doet. Dat legt de last op de schouders van artsen en patiënten om zich ervan te vergewissen dat een bepaald generiek geneesmiddel veilig en werkzaam is. (De geneesmiddelen die in de Verenigde Staten verkrijgbaar zijn, hebben tenminste het bio-equivalentieproces van de FDA doorlopen; de geneesmiddelen die sommige patiënten buiten het land via internet kopen, hebben dat misschien niet, waardoor ze nog verdachter zijn.)
Inclinische strategieën
Omwille van alle variabelen die we hebben besproken, moeten artsen goed in de gaten houden wat er met patiënten gebeurt wanneer ze van een merkgeneesmiddel naar een generiek geneesmiddel overstappen, of van het ene generieke geneesmiddel naar het andere. We moeten waakzaam zijn om er zeker van te zijn dat de controle over de intraoculaire druk niet verslapt en dat patiënten zich niet presenteren met nieuwe tekenen en symptomen van intolerantie voor de medicatie.
Hier zijn een paar dingen die u kunt doen om uw patiënten (en uw praktijk) te beschermen:
– Vraag patiënten om hun druppels in te brengen. Ik vraag mijn patiënten dit te doen, ongeacht de medicijnen die ze gebruiken, en velen van hen doen dat ook. Dat geeft mij de gelegenheid om te registreren welke generieke fabrikant ze gebruiken en mijn best te doen om dat in de gaten te houden, zodat als er een probleem optreedt of iets verandert, ik kan zoeken naar een mogelijk verband.
– Laat patiënten die overstappen op een nieuwe generieke eerder terugkomen naar de kliniek dan u ze anders zou laten terugkomen. Zo kunt u zich ervan vergewissen dat er geen ongewenste gevolgen optreden. Blijf alert op veranderingen in de werkzaamheid of nieuwe tekenen of symptomen.
– Als u problemen ziet ontstaan wanneer een patiënt overstapt op een generiek middel, waarschuw dan de FDA. Vergeet niet dat deze situatie de last op de arts legt om ervoor te zorgen dat het generieke geneesmiddel echt veilig en effectief is.
– Als een patiënt het niet zo goed doet met een generiek geneesmiddel, doe dan de moeite om de verzekeraar zover te krijgen dat hij het merkgeneesmiddel vergoedt. Ik heb te maken gehad met patiënten die de merkmedicatie goed verdroegen, maar moeite hadden met een generiek geneesmiddel vanwege bijwerkingen zoals roodheid of irritatie. In die gevallen schrijven we naar de verzekeringsmaatschappij en doen we alles wat we kunnen om de patiënt terug te krijgen naar de merkformule.
Een merkmedicijn kan bijvoorbeeld een specifiek conserveermiddel bevatten, terwijl de generieke formulering een alternatief conserveermiddel heeft waar de patiënt gevoelig voor is. Travatan Z is een merkmedicijn van Alcon dat het conserveermiddel SofZia bevat in plaats van benzalkoniumchloride; de generieke versies bevatten BAK omdat hun bioequivalentie was gebaseerd op de oudere versie van travoprost. Als een apotheek een patiënt die allergisch is voor BAK overschakelt op het generieke geneesmiddel, wordt het een probleem.
Terwijl we in onze praktijk duizenden patiënten per jaar zien, is het echt moeilijk om ervoor te zorgen dat we de strijd winnen voor elke patiënt die in deze situatie terechtkomt. Maar we doen wel ons best.
De last ligt bij ons
Generieke geneesmiddelen zijn niet meer weg te denken, en ze worden een belangrijk onderdeel van de behandeling van alle ziekten, niet alleen in de oogheelkunde. Ze zijn over het algemeen veilig en effectief, en ze kunnen kostenbesparingen opleveren voor zowel patiënten als de gezondheidszorg in het algemeen. Vergis u niet, ik ben een groot voorstander van kostenbesparing. Als we een veilige manier kunnen vinden om kosten te besparen met behoud van uitstekende zorg, ben ik daar helemaal voor. Het is het tweede deel van die vergelijking dat we in de gaten moeten houden.
Ik gebruik zelf elke dag generieke medicijnen, en de overgrote meerderheid van mijn patiënten gebruikt nu generieke medicijnen. Ze doen het bijna allemaal heel goed, met een goede IOP-controle en een goede tolerantie voor de medicijnen. Dus ik zeg zeker niet dat we het gebruik van generieke medicijnen moeten vermijden. De realiteit is echter dat generieke geneesmiddelen niet noodzakelijkerwijs hetzelfde zijn als de merkgeneesmiddelen, zelfs als zij voldoen aan de bioequivalentie-eisen van de FDA. Dat betekent dat bij het gebruik van generieke geneesmiddelen, de last van het waarborgen van veiligheid en werkzaamheid op ons en onze patiënten rust. Dr. Kahook is The Slater Family Endowed Chair in Ophthalmology en vice-voorzitter van klinisch en translationeel onderzoek aan de University of Colorado School of Medicine in Denver. Hij is adviseur voor en ontvangt onderzoekssteun van Allergan en Alcon.